2株H9N2亚型AIV分离株的遗传演化及其对小鼠的致病性研究
田苗,范梦璐,郑一青,平继辉
(南京农业大学动物医学院,江苏 南京 210095)
禽流感病毒(avian influenza virus,AIV)属于A型流感病毒,可引起绝大多数家禽、野鸟感染,甚至可以跨越宿主屏障,感染包括人在内的多种哺乳动物[1]。根据A型流感病毒表面蛋白HA和NA的差异,可分成18种HA亚型(H1~H18)和11种NA亚型(N1~N11),不同HA、NA亚型之间可相互组合产生重组病毒[2]。1966年在火鸡中分离出第1株H9N2亚型AIV,1994年在广东病鸡体内分离出国内第1株H9N2毒株,之后该亚型AIV迅速在全国蔓延。1997年香港地区发生禽流感感染人事件,H9N2为感染人的H5N1提供内部基因。1998年以后,H9N2病毒在我国偶尔传染给家猪等哺乳动物,甚至人类,导致轻微的呼吸道疾病。2013年从湖南男童身上分离到1株H9N2病毒,属于S基因型、Y280谱系[3]。迄今为止,已确诊的H9N2感染人事件已超过39例[4],表明部分H9N2病毒已具有感染人的能力。因此,H9N2亚型AIV的传播不仅具有大流行潜力,也是一个潜在的公共卫生问题。
目前国内H9N2亚型AIV的防控主要依靠灭活疫苗免疫,但是AIV在疫苗选择压力下正在不断发生变异、重组,有效地控制其流行传播难度巨大[5]。因此,系统监测H9N2病毒并进行及时疫苗更新,对科学防控AIV具有重要科学意义。本实验室于2019年在江苏地区分离到2株H9N2亚型AIV,进行全基因组测序,开展了遗传演化分析及其对小鼠的致病性研究,旨在为防控H9N2亚型禽流感提供参考数据。
1 材料与方法
1.1 毒株
2株H9N2亚型AIV:A/chicken/Jiangsu/25/2019(H9N2),简称CK/JS/25/19和A/chicken/Jiangsu/43/2019(H9N2),简称CK/JS/43/19,2019年分离自江苏某养殖场。
1.2 主要试剂
反转录试剂、DNA聚合酶及其Buffer和分子量Marker,购自南京诺唯赞生物科技股份有限公司;胎牛血清,购自Invitrogen公司;DMEM培养液,购自Thermo Fisher公司。
1.3 鸡胚及实验动物
9~10日龄的SPF鸡胚购自南京天邦生物科技有限公司。6~8周龄雌性BALB/c小鼠购自上海西普尔-必凯实验动物有限公司。
1.4 病毒的分离与鉴定
采集病鸡的泄殖腔拭子和喉拭子,加入灭菌PBS处理后离心取上清,过滤除菌后经尿囊腔接种9~10日龄SPF鸡胚,每胚0.2 mL,置于37 ℃恒温培养箱内孵育。24 h内死亡的鸡胚直接高压弃掉,收获24~96 h死胚和活胚的尿囊液进行血凝测定,阴性者再盲传3代。血凝检测呈阳性判定该样品为病毒分离阳性,通过血凝抑制试验来确定尿囊液中病毒亚型。
1.5 病毒的纯化与增殖
将上述收获的尿囊液按10-4~10-10有限稀释度接种9~10日龄SPF鸡胚,收获有血凝价且最高稀释度的尿囊液作为下一次接种材料,3次有限稀释进行病毒纯化增殖,测定病毒的血凝价,分装置于-80 ℃保存,半数细胞感染量(TCID50)测定病毒滴度。
1.6 病毒的基因组提取、PCR扩增及测序
提取病毒的总RNA,利用流感病毒基因组的通用引物进行反转录制备cDNA,上游引物U12:5′-CACACACGTCTCCGGGAGCAAAAGCAGG-3′;下游引物U13:5′-CACACACGTCTCCTATTAGTAGAAACAAGG-3′。使用基因特异性引物分别扩增流感病毒的8个基因片段,PB2、PB1、PA基因序列分2段进行扩增,HA、NP、NA、NS、M基因直接扩增全长。PCR产物经1%琼脂糖凝胶电泳初步鉴定,送通用生物系统(安徽)有限公司测序。
1.7 序列分析及绘制进化树
测序结果使用Lasergene 9.0软件套装中的SeqMan软件进行序列拼接,通过NCBI的BLAST功能比对分析,使用MegAlign软件分析各个基因片段的核苷酸序列及其推导的氨基酸序列的同源性,使用Mega 7.0.26软件绘制病毒各个基因的进化树,根据相关文献分析分离株的关键性氨基酸位点。主要的H9N2代表性毒株:BJ/94即A/chicken/Beijing/1/1994(H9N2),SD/6即A/chicken/Shandong/6/1996(H9N2),Y280即A/duck/Hong Kong/Y280/1997(H9N2),G1即A/quail/Hong Kong/G1/1997(H9N2),G9即A/chicken/Hong Kong/G9/1997(H9N2),Y439即A/duck/Hong Kong/Y439/1997(H9N2),F/98即A/chicken/Shanghai/F/1998(H9N2),HK/1073即A/Hong Kong/1073/1999(H9N2),HK/33982即A/Hong Kong/33982/2009(H9N2)。
1.8 小鼠致病性研究
将6~8周龄的BALB/c小鼠随机分为3组,每组5只,异氟醚麻醉小鼠,其中2组通过滴鼻方式接种病毒,105TCID50/小鼠,每只50 μL,剩余1组使用PBS进行滴鼻作为对照组。对照组和攻毒组每天正常饲喂,在每天同一时间称量小鼠的体重,连续称量14 d。
1.9 病毒的聚合酶活性分析
分别将2株分离株的聚合酶(PB2、PB1和PA)和NP基因片段克隆到pCAGGS载体上构建真核蛋白表达质粒,与萤火虫荧光报告基因质粒和海肾荧光素酶表达质粒共转染人源293T细胞,置于37 ℃、5% CO2培养箱。48 h后,预冷的PBS润洗细胞2次,加入适量的细胞裂解液,充分裂解后,12 000 r/min离心3~5 min,取上清用双萤光素酶报告基因检测试剂盒测定荧火虫荧光素酶活性和海肾荧光素酶活性,计算二者比值,分析聚合酶活性的差异。
1.10 数据统计与分析
试验组之间差异统计显著性使用GraphPad Prism 8.0.1软件Studentt检验确定,数据表示方式为“平均数±标准差”。
2 结果与分析
2.1 病毒的分离鉴定与增殖
本研究从我国江苏地区分离得到2株AIV分离株,CK/JS/25/19和CK/JS/43/19,血凝价均为6log2。2株分离株8个基因片段PCR产物大小与预期相符,血凝抑制试验和测序结果表明分离株为H9N2亚型AIV。利用鸡胚3次有限稀释纯化并增殖后,血凝价分别为9log2和8log2;TCID50测定病毒滴度,前者为107.613±0.098TCID50/mL,后者为106.647±0.137TCID50/mL。
2.2 序列同源性比较
毒株CK/JS/25/19与CK/JS/43/19的各基因核苷酸同源性为94.0%~98.4%,推导出的各基因氨基酸同源性为96.0%~100%,表明2株分离株的各基因具有较高的同源性。与H9N2代表性毒株相比,各基因核苷酸同源性较低,尤其是HA基因,其核苷酸和氨基酸同源性分别为78.0%~88.8%、84.2%~90.8%,具体结果见表1、表2。
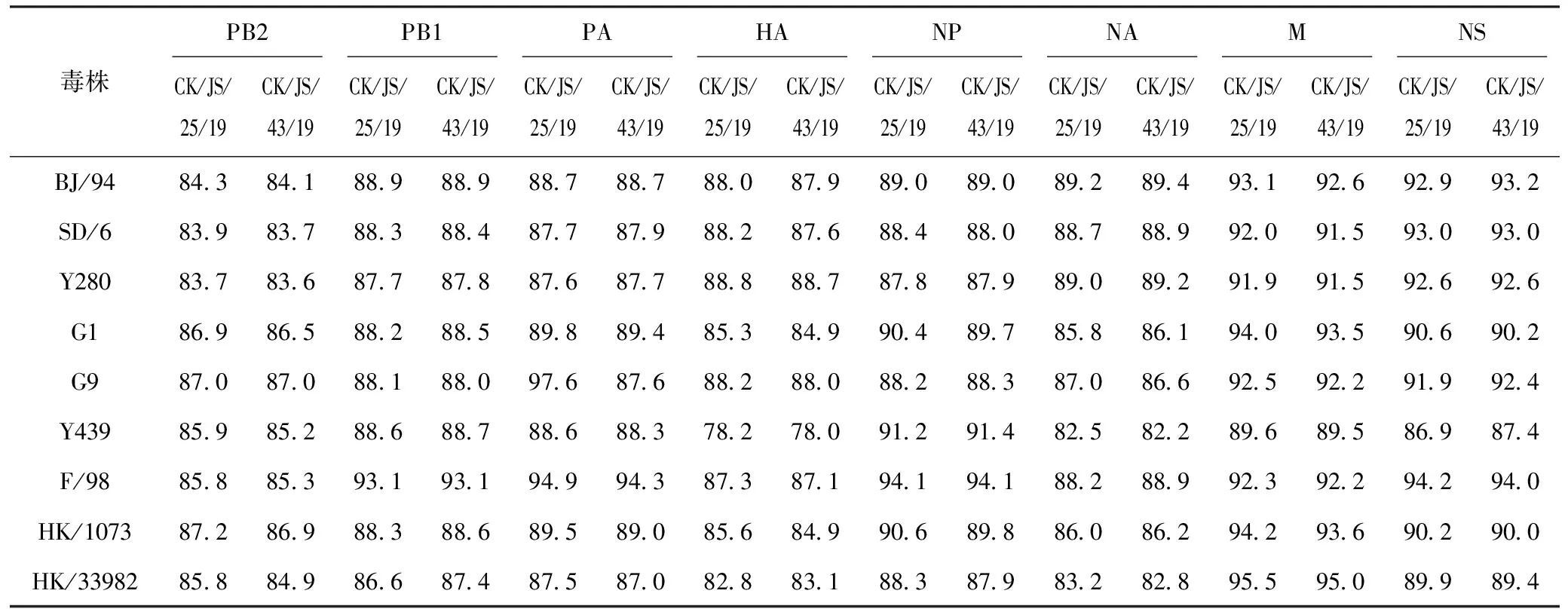
表1 CK/JS/25/19、CK/JS/43/19与H9N2代表性毒株的核苷酸同源性分析 %
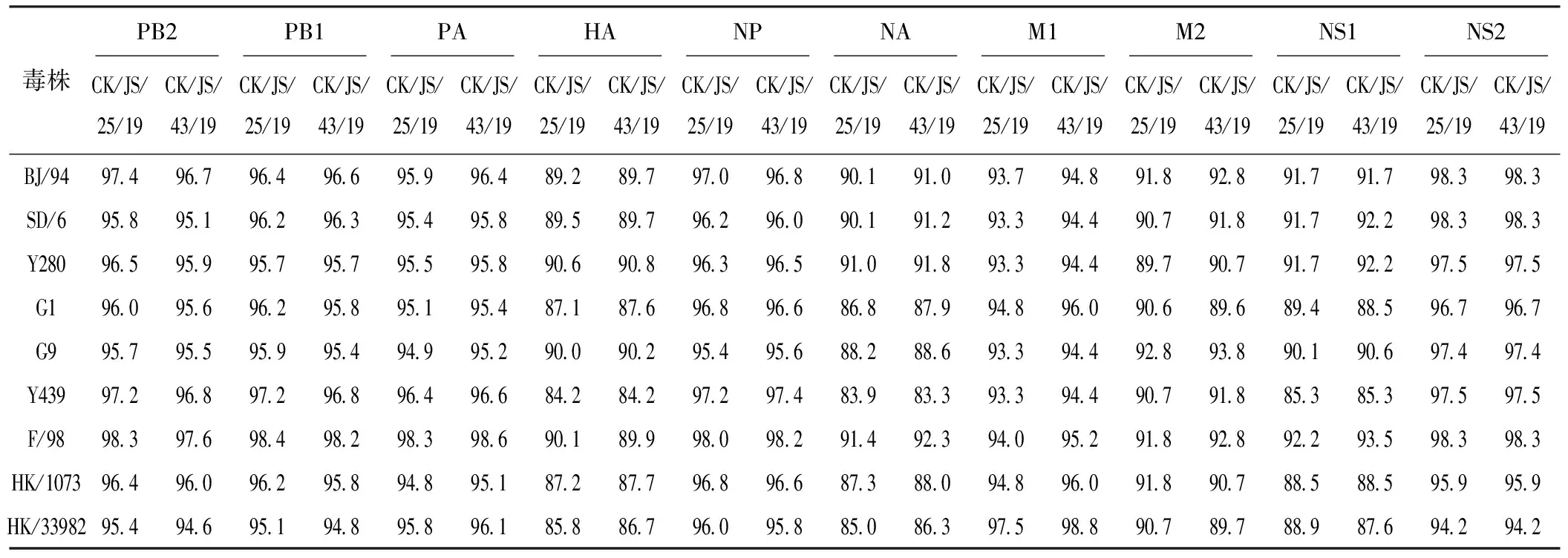
表2 CK/JS/25/19、CK/JS/43/19与H9N2代表性毒株的氨基酸同源性分析 %
2.3 遗传演化分析
根据2株H9N2分离株以及NCBI所获得的代表性毒株的核苷酸序列,使用Mega 7.0.26软件绘制病毒8个基因的进化树,结果如图1、2所示。2株分离株各个基因均属于相同分支,且与江苏、浙江、安徽等地的分离株亲缘关系较近。其中,HA、NA基因位于Y280分支,PB2、M基因位于G1分支,PB1、PA、NP、NS基因位于F/98分支。

进化树树根为A/turkey/Wisconsin/1966(H9N2);■表示本研究中使用的分离株,●表示经典疫苗株。下同
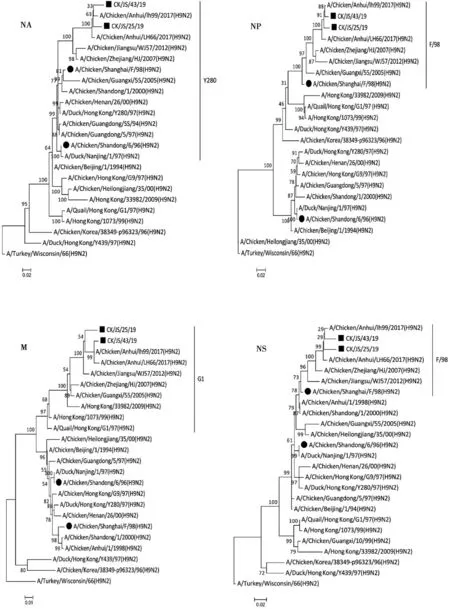
图2 CK/JS/25/19、CK/JS/43/19分离株的NA、NP、M、NS基因的遗传演化分析
2.4 关键性氨基酸位点分析
2.4.1 HA基因受体结合位点和裂解位点分析
分析HA基因受体结合位点发现(表3),2株H9N2分离株受体结合位点91、143、145、184、185位(H9编码,下同)均较为保守,与BJ/94、Y280、G1、F/98等代表性毒株保持一致。受体结合右缘128~132位点出现K131N、K131T突变;受体结合左缘214~219位点中,216位点与疫苗株不同,均为L,且均出现Q217M突变。2株分离株的裂解位点位于317~323,序列均为RSSR↓GLF,符合低致病性AIV的基本特征。
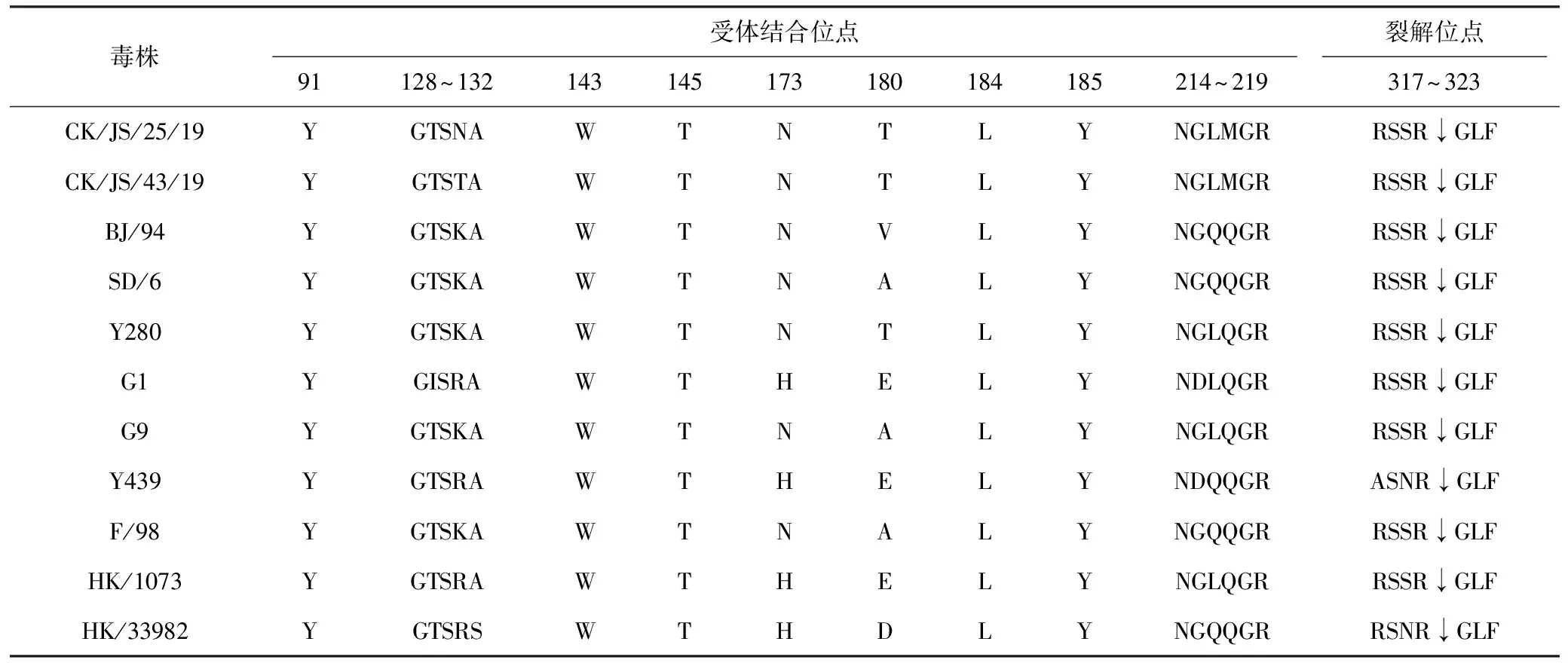
表3 CK/JS/25/19与CK/JS/43/19的HA受体结合位点和裂解位点分析
2.4.2 HA基因抗原性相关位点分析
H9亚型AIV HA的关键性氨基酸位点影响其抗原性。121、249位点较为保守,2株分离株均为121I、249I,与疫苗株SD/6和F/98一致。但与疫苗株相比,均存在G72E、S/T127D、D135G、T182R、T195A、D198E、Q216L、N264K突变,CK/JS/25/19存在K131N突变,CK/JS/43/19出现K131T、N183G突变(表4)。
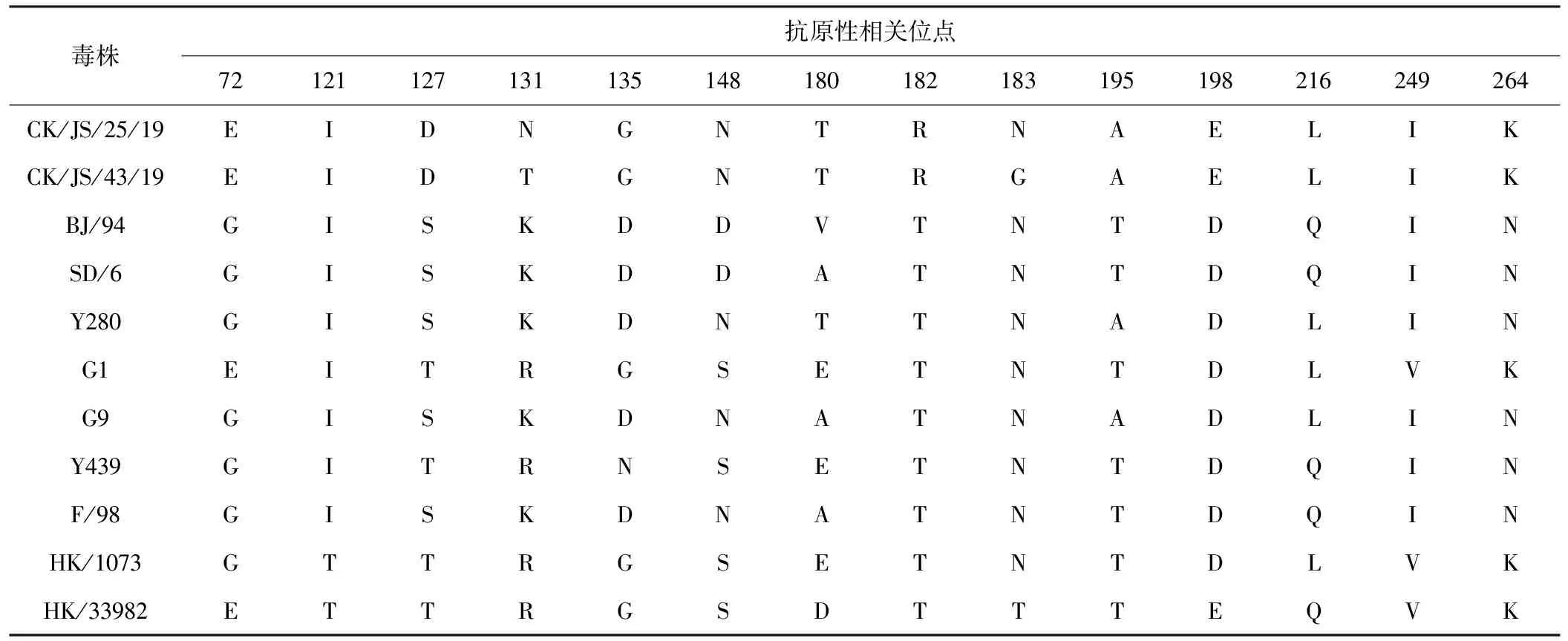
表4 CK/JS/25/19与CK/JS/43/19的HA基因抗原性相关位点分析
2.4.3 HA和NA基因的潜在糖基化位点分析
本研究中2株分离株潜在糖基化位点无差异,HA存在7个潜在糖基化位点(表5),即11、123、280、287、295、474、533;NA存在6个潜在糖基化位点(表6),即69、86、146、200、234、368。与代表性毒株BJ/94、Y280、G1、F/98等相比,大部分位点较为保守,HA295位、NA368位出现潜在糖基化位点,HA200位、NA402位缺失潜在糖基化位点。
2.4.4 致病性相关位点分析
AIV各基因特定氨基酸位点的突变可以显著影响其致病性。2株H9N2毒株的PB2基因均未发生E627K、D701N突变,但CK/JS/43/19出现E627V突变形式。CK/JS/25/19的PB2基因发生A588V突变,CK/JS/43/19发生A588T突变,二者均存在PA基因K356R突变、NA基因63~65位缺失、M2上S31N突变(表7)。
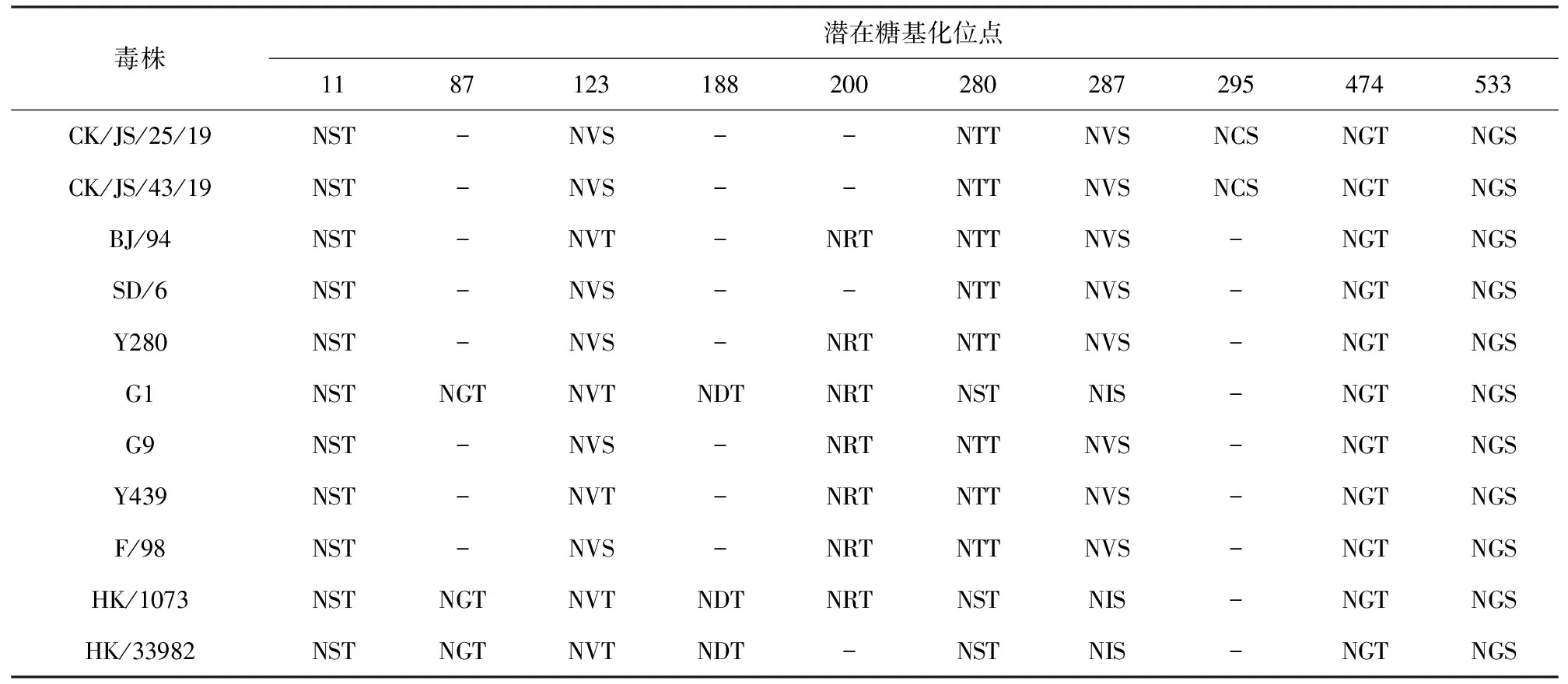
表5 CK/JS/25/19与CK/JS/43/19 HA基因的潜在糖基化位点分析
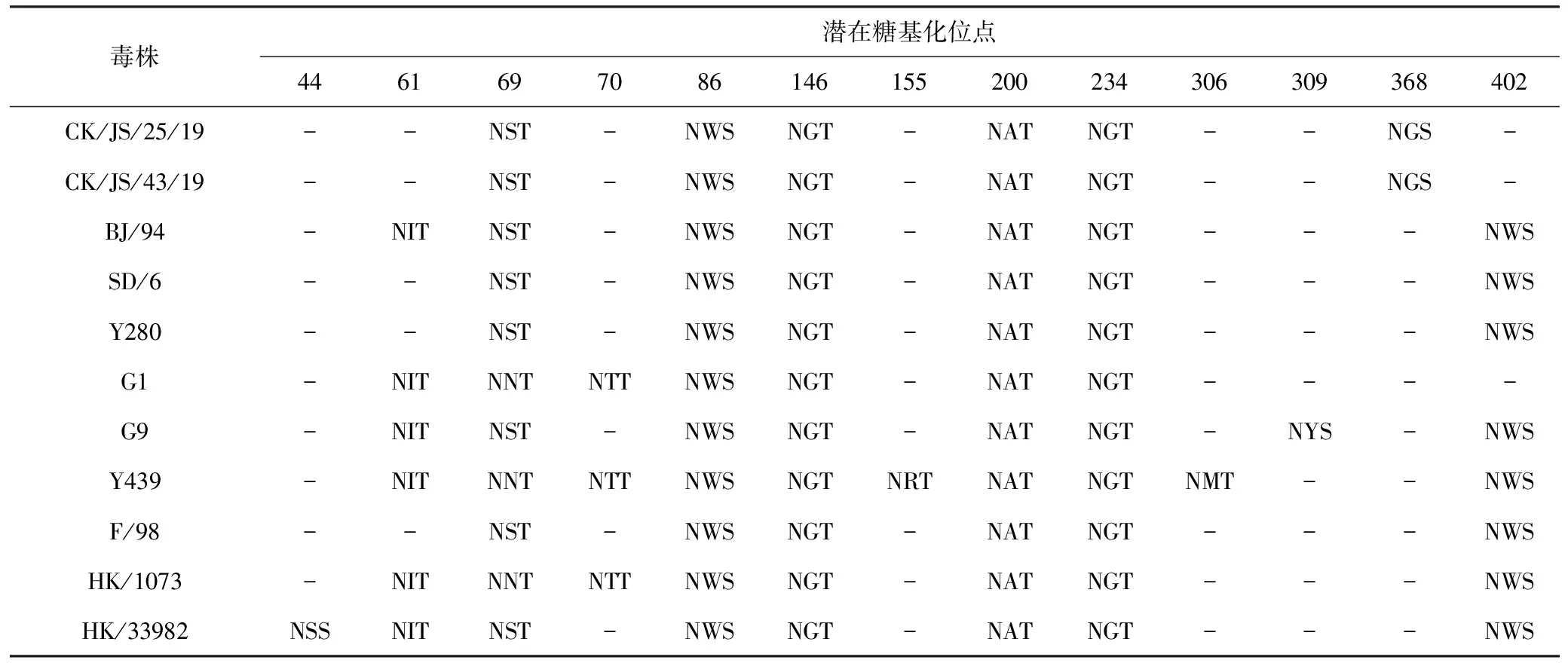
表6 CK/JS/25/19与CK/JS/43/19 NA基因的潜在糖基化位点分析

表7 CK/JS/25/19与CK/JS/43/19的致病性相关位点分析
2.5 对小鼠的致病性分析
分离株CK/JS/25/19接种小鼠后,小鼠均未死亡,且未表现出明显的临床症状;分离株CK/JS/43/19接种小鼠后,虽然小鼠均未死亡,但感染3 d后,小鼠出现临床症状,表现为精神沉郁、行动迟缓、缩头、被毛凌乱,与对照组相比体重出现下降,在感染后第6天大约下降10%的体重,8 d后逐渐恢复正常(图3)。
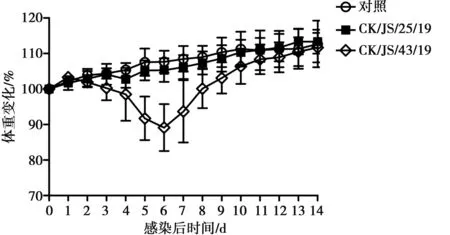
图3 小鼠感染H9N2亚型AIV后体重变化
2.6 聚合酶活性测定
通过构建2株病毒聚合酶和NP基因的蛋白表达质粒,并测定2株分离株的聚合酶活性,结果显示,CK/JS/43/19聚合酶活性是CK/JS/25/19的6.7倍,P<0.001(图4)。

***表示P<0.001
3 讨论
目前,国内外很多学者对H9N2亚型AIV的遗传进化及生物学特性进行了大量研究。Xia等[6]发现2013—2016年我国西南地区家禽H9N2亚型AIV部分分支已发生显著的抗原性变化。蒋大秀[7]发现2016—2018年华东地区H9N2亚型AIV G57基因型占主导。本研究所分离的2株H9N2亚型AIV符合当前H9N2亚型AIV的流行趋势,与代表性毒株BJ/94、Y280相比,除M、NS基因外,核苷酸序列同源性均在90%以下;与经典疫苗株SD/6、F/98相比,HA氨基酸序列差异较大,表明2株分离株存在不同程度的进化差异。
HA裂解位点的氨基酸序列特征是决定AIV致病性的重要因素之一。大部分高致病性AIV在HA裂解位点附近含有多个碱性氨基酸,可被细胞内多种蛋白酶所识别和裂解,而引起全身多器官感染;低致病性AIV通常仅存在单个碱性氨基酸,仅被存在于呼吸道和消化道内的精氨酸特异蛋白酶识别和水解,因此呈局部感染。本研究中2株分离株HA裂解位点均为RSSR↓GLF,符合低致病性AIV的特征。
HA结合唾液酸受体的能力与AIV跨物种传播密切相关,通常人流感病毒倾向与α-2,6唾液酸受体结合,而AIV主要与α-2,3受体结合[8]。受体结合位点及其周围氨基酸的改变可能会改变病毒的受体结合特性,已报道I145T、H173N、Q216L突变形式可以促使病毒更好的结合α-2,6唾液酸受体[9]。本研究2株分离株145、173、216位点分别为T、N、L,具有感染人的潜在危险。
禽流感之所以难以防控,主要是因为疫苗更新速度难以跟上病毒的变异速度。有研究表明HA上G72E、K131N、D135G、A180E/T/V、T182R、A195T、D/T198N、L216Q、K264N等氨基酸位点的改变会引起抗原性发生变化[10],与经典疫苗株SD/6、F/98相比,分离株的HA在这些位点存在上述差异形式,表明抗原性可能发生不同程度的改变。
HA、NA上潜在糖基化位点的增加或减少可以影响病毒的生物学特性。本研究中,2株分离株潜在糖基化位点符合国内流行规律,与BJ94、Y280等代表性毒株相比,增加HA295位、NA368位,缺失HA200位、NA402位。
8个片段上某些特定氨基酸位点的突变也是影响AIV致病性的重要因素之一[11]。例如,PB2的I292V、A588V/I,PB1的K577E,PA的K356R可增强病毒聚合酶活性,促进病毒在小鼠中的复制[12-14];HA的148位点也与致病性相关,D148N可增强对小鼠的致病性[15]。CK/JS/25/19、CK/JS/43/19毒株PB2的588位点分别为V、I,PA的356位点为R,HA的148位点均为N,推测可能具有增强对哺乳动物致病性的可能性。CK/JS/43/19毒株627位点为V,虽不及E627K、D701N作用显著,但研究报道表明该突变也能够显著增强病毒在哺乳动物细胞中的聚合酶活性,并增强对小鼠的致病性[16],这也与本研究中的小鼠致病性和聚合酶活性试验结果相符合。NA的63~65位点缺失,有研究证明可增强病毒对鸡的致病性[17]。M2上31位点与病毒耐药性有关[18],分离株均发生S31N突变,推测可能对金刚烷胺类等药物已产生耐药性。
目前,世界范围内已分离到超过39株人源H9N2毒株,因此研究其对哺乳动物的致病性具有重要的公共卫生意义。本研究发现CK/JS/43/19对小鼠具有致病性,推测部分H9N2毒株已获得感染哺乳动物的潜力。在人源293T细胞上测定H9N2分离株的聚合酶活性,与小鼠致病性结果一致,表明2株分离株存在致病性差异,具体是某个或某几个氨基酸位点决定致病性差异有待深入研究。

