铜绿假单胞菌肺炎鼠动物模型中炎性介质浓度分析
于柏峰,谷海瀛,赵振东,翟英超
(海南省人民医院输血科,海口 570311)
铜绿假单胞菌(pseudomonas aeruginosa,PA)是引起人类感染的传统致病菌,也是医院内呼吸道感染的常见病原菌之一。由其引起的感染具有难治性、高耐药性和高病死率的特点,在院内感染和临床抗感染治疗中占有极其重要的地位[1]。感染后引发炎性反应,在炎性反应的基础上,会引起一定程度的肺纤维化[2]。本研究应用PA引起的慢性呼吸道感染的鼠动物模型,通过检测其肺泡灌注液中白细胞介素-1β(IL-1β),白细胞介素8(IL-8)以及血清中核基质蛋白-2(MMP-2)浓度变化,对由其引起的炎性反应及肺纤维化程度进行研究,为由该菌引起疾病的诊断和治疗提供科学依据。
1 材料与方法
1.1 实验动物与主要试剂 6~8周龄雄性昆明小鼠(清洁级标准,体质量26~32g)由海南省人民医院实验动物中心负责饲养,所有的小鼠处于自然活动状态。IL-1β、IL-8及M MP-2检测试剂盒由美国R&D Systems公司提供。
1.2 菌株配制[3]将标准菌株PA27853(来自于军事医学科学院菌种保藏中心)接种到血平板,选取经过对数生长期的标准菌株27853单个菌落接种到2mL TSB中,37℃、18h扩增。菌液浓度用10倍稀释的TSB琼脂培养基评估。用麦氏比浊管比浊,相当于 0.5个麦氏单位(大约 1.3×108CFU/mL)。
1.3 实验动物分组情况 将55只小鼠分为3组:A组25只,经支气管接种无菌琼脂糖珠悬液50μ L;B组25只,经支气管接种富含PA琼脂糖珠悬液50μ L;C组5只,不接种,作为健康对照组。
1.4 感染实验动物 小鼠气管切开,分别注入50μ L有PA或无菌琼脂糖珠悬液。立即竖起小鼠,保持2min,使菌液流下进入肺内,小鼠有类似呛咳反应。切开伤口不做处理,自然愈合。对照组小鼠只做切口不接种。
1.5 标本的采集及处理 分别于接种后1、2、3、5、7d用10%乙醚麻醉小鼠后,先经心脏取血,血清标本收集贮存于-80℃冰箱中用于MMP-2及IL-1β、IL-8浓度检测。用7号有斜面的静脉采血针进行肺泡灌注,分3次,每次灌注1.0mL无菌PBS,收集回收液,总回收液要大于2mL,用于IL-1β、IL-8浓度检测
1.6 标本检测 应用酶联免疫定量技术检测IL-1β、IL-8及MMP-2,严格按照说明书进行。
1.7 统计学处理 所有数据均用Excel及SAS8.0统计软件分析处理。计量数据以±s表示,每组不同时间点的标本检测结果的差异用方差分析处理,各检测指标峰值间差异用方差分析处理,以P<0.05为差异有统计学意义。
2 结果
2.1 IL-1β、IL-8浓度 B组比C组中炎性介质浓度明显升高,两组比较差异有统计学意义(P<0.05)。而A组与C组比较差异无统计学意义(P>0.05)。IL-1β、IL-8浓度在接种PA(B组)2~3d肺泡灌洗液中浓度达到高峰,与接种无菌琼脂(A组)肺泡灌洗液中炎性介质峰值比较差异有统计学意义(P<0.05)。两种细胞因子在接种7d后接近正常水平。血清中未检测到IL-1β及IL-8,仅有极少数小鼠有低水平表达(数据未显示),见表1、2。2.2 血清中MMP-2浓度 B组血清中M MP-2峰值与A组峰值比较差异有统计学意义(P<0.05),而A组与C组比较差异无统计学意义(P>0.05)。B组M MP-2浓度在第3天达峰值,见表3。
表1 小鼠肺泡灌注液中lL-1β浓度(±s)

表1 小鼠肺泡灌注液中lL-1β浓度(±s)
△:P<0.05,与C组比较;*:P<0.05,与A组峰值比较。-:表示无数据。
取样时间(d)A组n IL-1β(ng/mL)B组n IL-1β(ng/mL)C组n IL-1β(ng/mL)1 4 75.5±21.3 4 555.4±5.9 5 62.5±13.42 5 97.0±10.7△5 105.7±23.9 - -3 5 59.3±11.3 5 122.3±29.2*△- -5 4 61.4±14.9 3 94.4±11.0 - -7 3 58.9±11.5 4 77.9±6.5 - -
表2 小鼠肺泡灌注液中IL-8浓度(±s)
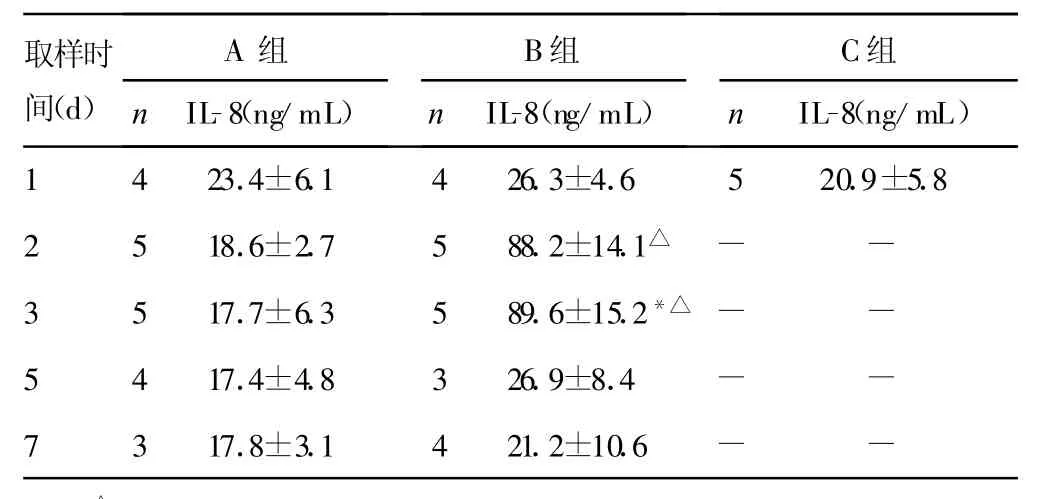
表2 小鼠肺泡灌注液中IL-8浓度(±s)
△:P<0.05,与C组比较;*:P<0.05,与A组峰值比较。-:表示无数据。
取样时间(d)A组n IL-8(ng/mL)B组n IL-8(ng/mL)C组n IL-8(ng/mL)1 4 23.4±6.1 4 26.3±4.6 5 20.9±5.82 5 18.6±2.7 5 88.2±14.1△- -3 5 17.7±6.3 5 89.6±15.2*△ - -5 4 17.4±4.8 3 26.9±8.4 - -7 3 17.8±3.1 4 21.2±10.6 - -
表3 小鼠血清中MM P-2浓度(±s)

表3 小鼠血清中MM P-2浓度(±s)
△:P<0.05,与C组比较;*:P<0.05,与A组峰值比较。-:表示无数据。
取样时间(d)A组n MMP-2(ng/mL)B组n MMP-2(ng/mL)C组nMMP-2(ng/mL)1 4 8.4±1.6 4 8.7±1.6 5 8.9±2.42 5 9.4±2.4 5 18.2±5.2 - -3 5 9.9±5.4 5 21.7±11.7*△ - -5 4 6.2±0.76 3 8.6±1.6 - -7 3 7.1±1.4 4 7.9±2.6 - -
3 讨论
炎症是机体对外来刺激产生的一种病理反应过程,IL-1β、IL-8等是已知的各种炎性反应的起始[4],它们可促进炎症细胞的聚集、活化和炎症介质的释放[5],并具有趋化作用,产生炎性反应。IL-1β可直接作用于下丘脑体温调节中枢,引起发热,增强炎性反应,促进机体对外来异物的清除;IL-8也可使中性粒细胞和内皮细胞粘连,使急性炎性反应增强。本研究证实,PA引起的肺部炎性反应使肺泡灌注液中IL-1β、IL-8在感染后迅速增加,在2~3d达到峰值,5~7d恢复正常。
在本实验中,两组小鼠血清中均未检测到IL-1β、IL-8,分析原因可能是血中浓度太低,另外因为酶联免疫法只能检测游离的细胞因子,对结合至细胞或受体的细胞因子不能测出;也可能与本实验采用方法的灵敏度、实验动物的炎性反应水平在阈值以下有关。这与Brown等[6]报道相同,因为从信号功能上看,虽然细胞因子很像内分泌激素,但细胞因子大多数是释放在细胞周围短距离传递信号,而内分泌是分泌至血液远距离传递,这些分泌在局部的细胞因子常常不能在血中测出其浓度。但Matthys和Billiau[7]在1997年指出,恶病质很少归因于一种细胞因子单独作用,而是多组细胞因子的共同作用。他们认为,即使某种独立的细胞因子在系统中未被检测到,但它已经有足够的数量充当增效剂引起炎性反应。
致病性PA感染容易导致肺纤维化,从而导致微循环系统的阻断和损伤[5],进而引起患者肺部更严重的感染[8]。蛋白酶和抗蛋白酶的失衡是肺气肿形成的机制之一[9];肺纤维化另一个主要原因是基底膜的降解,而金属基质蛋白酶(MM Ps)几乎能降解所有的细胞外基质(ECM)。目前,有学者认为除了中性粒细胞弹性蛋白酶外,MMPs家族在肺纤维化中起的重要作用不可忽视[10]。
MMPs是一组具有相同功能、结构高度同源、依赖锌离子的肽链内切酶的总称,MMPs在转录、分泌、激活和活化后等水平上受到严格调控。其中MM P-2主要表达于肺泡巨噬细胞、淋巴细胞和支气管上皮细胞,MMP-2能溶解基底膜中Ⅳ型胶原、明胶、层粘蛋白和ECM,导致肺纤维化。有实验证实,检测MMP-2可观测肺纤维化的进展程度[11]。本实验检测了动物模型血清中MM P-2浓度,观察由PA感染引起的肺部炎症变化及肺纤维化的进展程度。
通过检测动物模型肺泡灌注液 lL-1β、IL-8及血清中MMP-2浓度变化,证实由PA慢性感染引起的炎性反应在2~3d达到峰值,并在肺部炎症基础上引起肺部一定程度的囊性纤维化,与相关研究[12]及临床进程相符,为临床诊断、治疗及该菌的致病性研究提供了依据。
[1]季海生,朱德全.重症监护病房病原菌耐药性分析[J].中华医院感染学杂志,2007,17(1):103-106.
[2]Smith EE,Buckley DG,Wu Z,et al.Genetic adaptation by pseudomonas aeruginosa to the airways of cystic fibrosis patients[J].Proc Natl Acad Sci USA,2006,103(22): 8487.
[3]Starke JR,Edwards C,Langston CJ,et al.A mouse model of chronic pulmonary infection with pseudomonas aeruginosa and pseudomonas cepacia[J].Pediatr Res,1987,22(6):698-702.
[4]Noah T L,Black PW,Cheng RE,et al.Nasal and bronchoalveolar lavage fluid cytokines in early cvstic fibrosis [J].J Infect Dis,1997,175(3):638-647.
[5]Drews J.Immunopharmacology.Principles and perspectives[M].Berlin,Germang:Spring-Verlag KG,1990,66-71:209-237.
[6]Brown MA,Morgan WJ,Finley PR,et al.Circulating levels of tumor necrosis factor and interleukin-1in cystic fibrosis[J].Pediatr Pulmonol,1991,10(2):86-91.
[7]Matthys P,Billiau A.Cytokines and cachexia[J].Nutrition,1997,13(9):763-770.
[8]Imai K,Dalal SS,Chen ES,et al.Human collagenase(matrix metalloproteinase-1)expression in the lungs of patients with emphsema[J].Am J Respir Crit Care Med,2001,163(3Pt 1):786-791.
[9]Finlay GA,O′Driscoll LR,Russell KJ,et al.M atrix metalloproteinase expression and production by alveolar macrophages in emphysema[J].Am J Respir Crit Care Med,1997,156(1):240-247.
[10]陈小菊,程德云.金属基质蛋白酶与慢性阻塞性肺疾病[J].临床肺科杂志,2003,8(5):419-421.
[11]Delcaux C,d′Ortho MP,Delacourt C,et al.Gelatinases in epithelial lining fluid of patients with adult respiratory distress syndrome[J].Am J Physid,1997,272(3Pt 1): L442-451.
[12]谷海瀛.铜绿假单胞菌鞭毛功能的影响因素及其致病性[J].中华微生物学和免疫学杂志,2008,28(12):1149-1151.

