VEGF对内皮抑素诱导的血管内皮细胞凋亡的抑制作用
马 颖,何援利
(南方医科大学珠江医院妇产科,广州510280)
子宫内膜异位症(endometriosis,EMs)是育龄期妇女的多发病,主要表现为痛经及不孕,危害严重。EMs虽是一种良性病,却具有易增生、浸润和复发的恶性特点,目前治疗效果有限[1-2]。有研究提示EMs与血管生成关系密切,抑制血管生成可以达到抑制病灶生长的目的。内皮抑素(endostatin,ES)是一种强效的抗血管生成物质,可诱导血管内皮细胞凋亡,但ES蛋白不稳定,需借助基因治疗发挥作用[3-4]。血管内皮细胞生长因子(VEGF)可抑制ES诱导的血管内皮细胞凋亡。为探讨血管生成在EMs中的作用,本研究构建了携带ES基因的重组腺病毒,体外感染脐静脉内皮细胞ECV-304并诱导其凋亡,同时观察VEGF对这一现象的抑制作用。
1 材料与方法
1.1 实验材料 Pshuttle-ES质粒由本科保存。大肠杆菌BJ5183、AAV293细胞株、ECV-304细胞由中山大学生命科学院提供。腺病毒AdEasy-1系统,包括骨架质粒pAdEasy-1及穿梭质粒pAdT rack-CMV。限制性内切酶PmeⅠ、PacⅠ为NEB公司产品;蛋白酶K为Sigma公司产品;质粒抽提试剂、DNA胶回收试剂盒为Omega公司产品;Trizol试剂盒、LipofectAMINE2000、DM EM培养基、RPM I-1640培养基为Gibco公司产品;Taq DNA聚合酶、T4DNA Ligase、限制性内切酶KpnⅠ、XbaⅠ为TaKaRa公司产品;鼠抗人内皮抑素单克隆抗体为Oncogene公司产品、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗小鼠IgG为中北京山生物工程公司产品。DNA序列测定由中山大学生命科学院测序中心完成。
1.2 方法
1.2.1 重组腺病毒Ad-ES的构建、包装、纯化、滴度及感染效率测定 以Pshuttle-ES质粒为模板,PCR扩增出ES片断(约650bp),构建重组穿梭质粒pAdTrack-ES,在大肠杆菌BJ5183中构建重组腺病毒质粒pAd-ES。同法,制备出无外源基因插入的空载质粒pAd-T rack。pAd-ES转染85%~90%融合的AAV293细胞,约14d后收集细胞,-80℃、37℃反复冻融,收集腺病毒Ad-ES,经用氯化铯密度梯度离心纯化。终点稀释法测定病毒滴度(Titer)。同法得到空载腺病毒Ad-Track。以1×104密度接种ECV-304于6孔板,用感染复数(multiplicity of infection,MOI)分别为1、10、100的Ad-ES感染,48h后在荧光显微镜下计数绿色荧光蛋白(GFP)阳性细胞百分率,测定病毒的感染效率。
1.2.2 RT-PCR及Western blot检测ES的转录和表达 Ad-ES(MOI=100)感染85%~90%融合的ECV-304,72h后收集细胞,用Trizol试剂盒抽提总RNA,加入无RNase的DNaseⅠ37℃孵育10min后,于70℃灭活15min。用获得的RNA进行逆转录,取2μ L cDNA产物为模板进行ES基因的PCR扩增。同样将感染的细胞沉淀经 SDS-PAGE电泳及 Western blot检测;Ⅰ抗为鼠抗人内皮抑素单克隆抗体(1∶50),Ⅱ抗为HRP标记的羊抗小鼠IgG(1∶100),DAB法显色。
1.2.3 VEGF对ES诱导的ECV-304凋亡的抑制作用测定分组:(1)实验组为Ad-ES+VEGF(10ng/mL)组;(2)阴性对照组为Ad-ES组;(3)空白对照组为Ad-Track组。各组细胞感染72h后,用胰酶处理得到单细胞悬液。加入200μ L的RNase酶(1g/L),37℃水浴30min,再加入800μ L的PI染色液4℃避光放置30min,用流式细胞仪检测凋亡细胞的特征性亚二倍体峰。各组细胞感染72h后加入Hochest 33258染液(7.5μ g/mL)避光染色15~20min;再用-20℃预冷的PBS清洗细胞2次,弃上清液,荧光显微镜观察核染色及凋亡小体的情况。10%甲醛(formalin)固定细胞20min,加入0.1g/L结晶紫染液染色30min,用10%冰醋酸2mL抽提,抽提液与双蒸水混匀,在酶标仪上读取590nm处吸光度值,绘制细胞生长曲线图。
1.3 统计学处理 采用SPSS10.0统计软件进行Dunnett t检验。
2 结果
2.1 重组腺病毒Ad-ES的包装过程 重组腺病毒质粒pAd-ES转染AAV293细胞16h后,在荧光显微镜下可见绿色荧光蛋白(GFP)表达,荧光逐渐增多增亮,转染后5~9d,细胞膨胀变圆,触角逐渐消失,荧光不再增加,部分细胞开始悬浮,呈串珠样改变,表明病毒的形成和扩增;约在转染后14d,大部分AAV293细胞胞体固缩、悬浮,见封3图1~4。
2.2 ES的转录和表达 Ad-ES感染的ECV-304细胞有ES片段的扩增,而空白对照组无特异性条带产生,表明插入的ES基因在mRNA水平能有效转录,见图5。以MOI=100的Ad-ES感染ECV-304,约20kD处有特异性条带,与ES蛋白的相对分子质量一致,证明Ad-ES在ECV-304中有效地的表达,见图6。
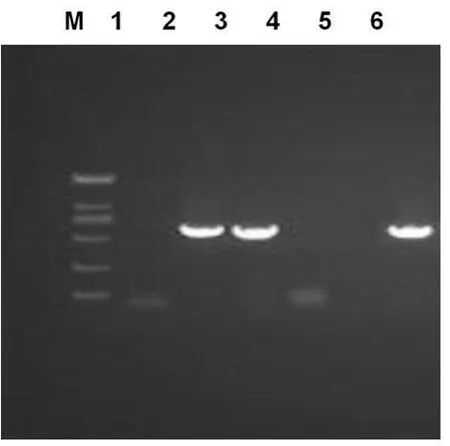
图5 RT-PCR检测ES在ECV-304细胞中的表达

图6 Western blot检测ES蛋白的表达

图7 流式细胞仪检测各组细胞凋亡情况

图9 各组细胞生长曲线
2.3 各组细胞凋亡情况 Ad-ES感染ECV-304细胞72h后出现细胞凋亡特征性的亚二倍体峰,Ad-ES+VEGF组细胞凋亡减少,Ad-Track组未见明显细胞凋亡,见图7。Ad-ES感染ECV-304细胞72h后出现大量的凋亡小体,Ad-ES+VEGF组凋亡较少,Ad-Track组无明显凋亡,见封4图8。
2.4 各组细胞生长曲线 绘制不同处理时间的各组细胞生长曲线,Ad-ES组细胞增殖速度明显低于Ad-Track组和Ad-ES +VEGF组,而后两组细胞增殖速率相似,差异无统计学意义(P>0.05),见图9。
3 讨论
EMs是一种危害严重、治疗困难的多发病,其发病机制不明。多项研究提示,新生血管生成是异位内膜病灶存在与发展的前提,抗血管生成治疗有望成为治疗EMs的有效途径之一。
ES是一种强效的抗血管生成物,可诱导血管内皮细胞凋亡并抑制其迁移,但ES蛋白不稳定,必须借助基因治疗发挥作用。基因治疗的关键环节就是选择高效安全的基因载体,本研究采用的腺病毒AdEasy-1系统是一种高效安全的基因载体,其安全、遗传毒性低,控制转录复制单位E1基因和编码毒性产物E3基因已被剔除,故不会自身复制;感染率高,易繁殖,宿主广泛;不整合到宿主细胞的染色体中,因而不会带来严重的不良反应[5-7]。VEGF具有强大的促内皮细胞增殖、促血管生成作用,可对抗ES诱导的细胞凋亡作用。多项研究提示VEGF的过表达可能是导致EMs发生的重要因素[8]。
在本研究中,成功构建并在AAV293细胞中包装出携带ES基因的重组腺病毒Ad-ES,感染ECV-304细胞后,用RTPCR及Western blot检测到ES的转录和表达,细胞生长曲线及流式细胞术证实Ad-ES感染后的ECV-304细胞增殖速度明显下降并出现凋亡,如果同时加入VEGF,则细胞凋亡明显减少。提示ES能够改变ECV-304细胞的生物活性,使其凋亡增加,这可能是ES抑制血管生成的重要机制之一;而上述作用能够被VEGF所对抗,从另一个方面说明ECV-304细胞受ES影响而发生变化,为进一步研究EM s血管生成机制奠定了基础。
[1]朗景和.子宫内膜异位症的研究与设想[J].中华妇产科杂志,2003,38(8):478-480.
[2]Nothnick WB.Endometriosis:in search of optimal treatment[J].Minerva Ginecol,2010,62(1):17-31.
[3]Karamouzis MV,Moschos SJ.The use of endostatin in the treatment of solid tumors[J].Expert Opin Biol Ther,2009,9(5):641-648.
[4]May K,Becker CM.Endometriosis and angiogenesis[J]. Minerva Ginecol,2008,60(3):245-254.
[5]Sharma A,Tandon M,Bangari DS,et al.Adenoviral vector-based strategies for cancer therapy[J].Curr Drug ther,2009,4(2):117-138.
[6]Hogg RT,Garcia JA,Gerard RD.Adenoviral targeting of gene expression to tumors[J].Cancer Gene Ther,2010,17(6):375-386.
[7]Becker CM,Sampson DA,Rupnick MA,et al.Endostatin inhibits the growth of endometriotic lesions but does not affect fertility[J].Fertil Steril,2005,84Suppl 2:S1144-1155.
[8]Takehara M,Ueda M,Yamashita Y,et al.Vascular endothelial growth factor A and C gene expression in endometriosis[J].Hum Pathol,2004,35(11):1369-1375.

