羽扇豆醇对人共刺激细胞及结肠癌细胞株SW480的影响
毕亭亭,刘军权,陈复兴,刘 岩,朱炳喜
221002徐州,徐州医学院附属医院消化内科(朱炳喜);
221004徐州,解放军第九七医院实验科(刘军权、陈复兴)
0 引 言
结肠癌是目前威胁人类健康最常见的恶性肿瘤之一,是一种以局部表现为主的全身性疾病。目前一般采用手术、化疗、放疗等方案治疗结肠癌,但部分患者术后采用标准的化疗方案仍无法避免肿瘤的早期复发[1],因此提高其生存率成为治疗的关键。随着细胞免疫学的发展,生物治疗逐渐成为研究的热点。羽扇豆醇是一种可从草莓、芒果等多种果蔬以及植物中提取的五环三砧类化合物[2-4],具有抗炎症、抗氧化、促进创面愈合、抗肿瘤等作用[5]。有研究表明,一定浓度的羽扇豆醇能促进γδ T细胞的生长及其对胰腺癌细胞的杀伤作用[6],但有关羽扇豆醇在体外对人共刺激细胞杀伤结肠癌细胞株SW480的报道国内外鲜见。因此,本研究探讨羽扇豆醇对人共刺激细胞杀伤结肠癌细胞株SW480生长的影响。
1 材料与方法
1.1 材料 人结肠癌细胞株SW480(购于上海细胞生物研究所,本室传代保存);羽扇豆醇(lupeol)(Sigma公司);胰蛋白酶、RPMI 1640(GIBCO公司);人AB血清(徐州市血站);胎牛血清、淋巴细胞分离液(中国科学院血液病研究所);二甲基亚砜(dimethyl sulfoxide,DMSO)、甲基偶唑蓝(MTT)(美国Sigma公司);恒温CO2培养箱公司、倒置显微镜(德国Wilovert公司);超净工作台、低温离心机 (北京希亚克技术有限公司);ST-360酶标仪(上海科华实验系统有限公司);Encore自动生化分析仪(北京希亚克技术有限公司);流式细胞仪(flow cytometer,FCM)(美国BD公司)。
1.2 共刺激细胞的培养 取10份健康人外周抗凝血每份10 mL,用淋巴细胞分离液分离单个核细胞(离心半径12 cm,1500 r/min离心15 min),吸取单个核细胞层,等渗盐水洗涤3次(离心半径12 cm,1500 r/min离心,10 min/次),用RPMI l640 培养液(含 rhIFN-γ 2×106U/L、100 mL/L小牛血清、50 mL/L人AB血清)调整细胞密度为5×108/L,接种于6孔细胞培养板中,每孔5 mL,置37℃、50 mL/L CO2环境培养24 h后收集细胞,离心弃上清液后用RPMI 1640洗涤1次。用RPMI 1640完全培养液(含100 mL/L小牛血清、50 mL/L人AB血清、IL-1α 10 μg/L、rhIL-2 5 × 104U/L、CD3 mAb 1mg/L)调整细胞密度为5×108/L,接种于6孔细胞培养板中,每孔5 mL,然后根据分组分别加入下列细胞刺激因子:IL-15 20 μg/L、IL-21 10 μg/L、CD28 10 mg/L单抗,于37℃、50 mL/L CO2培养箱中培养,每2天半量换培养基(含相应的细胞刺激因子)1次,并调整细胞密度为5×108/L。收集共刺激细胞做相关检测。
1.3 人结肠癌细胞株SW480的培养 将复苏后的细胞配成1.75×104/L的细胞悬液,置于细胞培养瓶中,在37℃、50 mL/L CO2条件下培养,2~3 d更换细胞培养液,细胞达 80%瓶底时,以 0.02%EDTA消化脱壁,收集细胞,离心半径 12 cm,800 r/min离心3 min,弃去上清备用。
1.4 羽扇豆醇原液的配制 羽扇豆醇纯度≥95%,取3 mg,用温无水乙醇和二甲基亚砜(DMSO)按1∶1混匀,配成原液浓度为40 mg/mL,放入-20℃冰箱储存备用。
1.5 MTT法检测 将对数生长期的结肠细胞株SW480及培养7 d的共刺激细胞分别配成1.75×104/L、4×104/L的细胞悬液,均接种于96孔板中,0.2 mL/孔,加入不同浓度的羽扇豆醇(终浓度分别为200 mg/L,倍比稀释至0.005 mg/L)。同时设空白和溶剂(每孔加入与溶解羽扇豆醇等量的溶剂)对照组,每组设3个复孔,孵育24、48、72h后每孔加人MTT(5 g/L)液20 μL,37℃培养箱孵育4 h后弃去上清液,每孔加入DMSO 150 μL,轻轻震荡10 min使其充分溶解,在540 nm波长酶标仪上测定各孔吸光度值(A)。每试验重复3次,求其平均值,并计算细胞生长抑制率和细胞生长增殖率,公式如下:
细胞生长抑制率(%)=(对照A值-实验A值)/对照A值×100%
细胞生长增殖率(%)=(实验A值-对照A值)/对照A值×100%
1.6 LDH法检测共刺激细胞对SW480的杀伤活性
1.6.1 共刺激细胞对羽扇豆醇诱导后的结肠癌细胞株SW480杀伤活性的检测 将培养7d的共刺激细胞(效应细胞)及经羽扇豆醇(终浓度为 0.4、0.8、1.6、3.1、6.2、12.5、25.0、50.0 mg/L,浓度选择根据 MTT结果)诱导的对数期生长结肠癌SW480细胞(靶细胞)分别用含100 mL/L胎牛血清的RPMI 1640配成2×109/L和2×108/L细胞悬液。各取0.5 mL效靶细胞悬液充分混合,置37℃、50mL/L CO2孵箱中孵育6h后,离心半径为12cm,1500r/min离心10min收集上清液,按乳酸脱氢酶试剂盒要求操作,在全自动生化分析仪340 nm波长下测定LDH的活性单位(U/L)。每测试样本均设未加羽扇豆醇的对照组。同时检测单靶细胞的自然释放值和单效应细胞的自然释放值。每份测试样本重复3次,取平均值。
1.6.2 羽扇豆醇诱导后的共刺激细胞对结肠癌细胞株SW480的杀伤活性检测 取将经羽扇豆醇(终浓度为0.4、0.8、1.6、3.1、6.2、12.5、25.0、50.0mg/L)诱导培养7d的共刺激细胞(效应细胞)及对数期生长的结肠癌SW480细胞(靶细胞)分别配成2×109/L和2×108/L细胞悬液。余操作步骤及检测方法同1.6.1。计算共刺激细胞杀伤活性,公式如下。
共刺激细胞杀伤活性(%)=(测定管LDH单位-效应细胞自然释放LDH管)/(靶细胞最大释放LDH管-靶细胞自然释放LDH管)×100%
1.7 统计学分析 采用SPSS 13.0软件进行统计学处理。计量资料使用平均数±标准差(±s)表示。组间均数比较采用单因素方差分析(One-way ANOVA),多组间两两比较用Dunnet t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 共刺激细胞形态学观察结果 共刺激细胞为贴壁细胞,在培养过程中发现,培养24 h后动态观察细胞出现明显增殖现象,培养3 d后可见小集落状细胞,7 d后出现大的集落细胞生长,见图1。
2.2 羽扇豆醇对人共刺激细胞生长的影响 不同浓度的羽扇豆醇作用人共刺激细胞24、48、72 h后,浓度在0.1~12.5 mg/L时对人共刺激细胞的生长有促进作用,且随着浓度的逐渐升高细胞增殖率升高,浓度在12.5~100.0 mg/L时,其促进作用逐渐减弱,100.0~200.0 mg/L之间促进作用不再有明显变化,72 h浓度为12.5 mg/L时增殖率达到最大值,见图2。24、48、72 h各浓度组与空白对照组比较均有统计学意义(P<0.05),空白对照组与溶剂对照组比较均无统计学意义,见表1。
2.3 羽扇豆醇对结肠癌细胞株SW480生长的影响羽扇豆醇作用于结肠癌细胞株SW480 24、48、72 h后,在0.05~200.0 mg/L时,对 SW480的生长有抑制作用,随着浓度的升高抑制率逐渐上升,呈浓度依赖性,25.0 mg/L时抑制率开始显著增高,见图3。24、48、72 h各浓度组与空白对照组、溶剂对照组比较均有统计学差异(P<0.05),空白对照组与溶剂对照组比较均无统计学意义,见表2。
图1 显微镜下培养7 d共刺激细胞形态Figure 1 The shape of Co-stimulation cells under the microscope at the 7th day
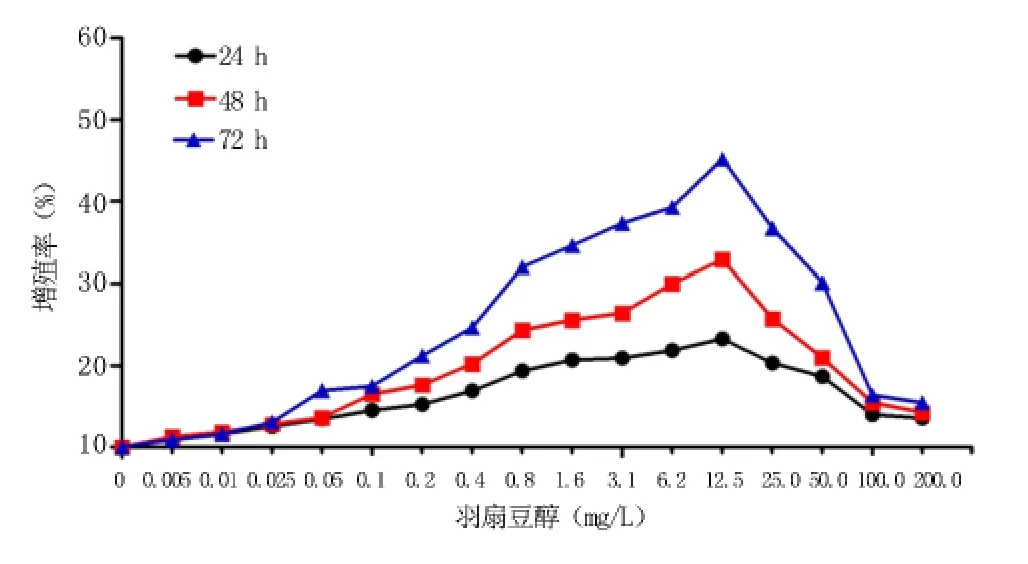
图2 不同浓度羽扇豆醇对共刺激细胞生长的影响(n=3)Figure 2 Effects of different concentrations of Lupeol on the growth of Co-stimulation cells(n=3)
表1 羽扇豆醇作用不同时间后人共刺激细胞的A值比较(±s,n=3)Table 1 Different concentrations of Lupeol effect on Co-stimulation cells after 24 h、48 h、72 h(±s,n=3)

表1 羽扇豆醇作用不同时间后人共刺激细胞的A值比较(±s,n=3)Table 1 Different concentrations of Lupeol effect on Co-stimulation cells after 24 h、48 h、72 h(±s,n=3)
与各时间点空白对照组比,*P<0.05
组 别A值24 h 48 h 72 h空白对照组0.2967 ±0.0025 0.2986 ±0.0025 0.3030 ±0.0010溶剂对照组 0.2987 ±0.0031 0.3003 ±0.0015 0.3040 ±0.0044羽扇豆醇组(mg/L)0.005 0.3030 ±0.0036* 0.3063 ±0.0031* 0.3083 ±0.0015 0.01 0.3060 ±0.0020* 0.3097 ±0.0015* 0.3127 ±0.0025*0.025 0.3117 ±0.0021* 0.3153 ±0.0040* 0.3217 ±0.0021*0.05 0.3170 ±0.0010* 0.3203 ±0.0025* 0.3450 ±0.0030*0.1 0.3233 ±0.0031* 0.3373 ±0.0015* 0.3483 ±0.0025*0.2 0.3277 ±0.0015* 0.3443 ±0.0025* 0.3710 ±0.0026*0.4 0.3377 ±0.0031* 0.3597 ±0.0015* 0.3920 ±0.0036*0.8 0.3520 ±0.0053* 0.3843 ±0.0040* 0.4363 ±0.0035*1.6 0.3600 ±0.0020* 0.3916 ±0.0015* 0.4523 ±0.0025*3.1 0.3613 ±0.0032* 0.3966 ±0.0021* 0.4687 ±0.0030*6.2 0.3670 ±0.0026* 0.4180 ±0.0020* 0.4803 ±0.0051*12.5 0.3753 ±0.0025* 0.4356 ±0.0021* 0.5163 ±0.0045*25.0 0.3577 ±0.0025* 0.3927 ±0.0031* 0.4650 ±0.0046*50.0 0.3480 ±0.0026* 0.3640 ±0.0036* 0.4250 ±0.0056*100.0 0.3203 ±0.0025* 0.3313 ±0.0061* 0.3417 ±0.0035*200.0 0.3177 ±0.0025* 0.3240 ±0.0056* 0.3360 ±0.0020*
表2 羽扇豆醇作用后SW480细胞的A值(±s,n=3)Table 2 Effect of different concentrations of Lupeol on the A value of SW480 cells(±s,n=3)
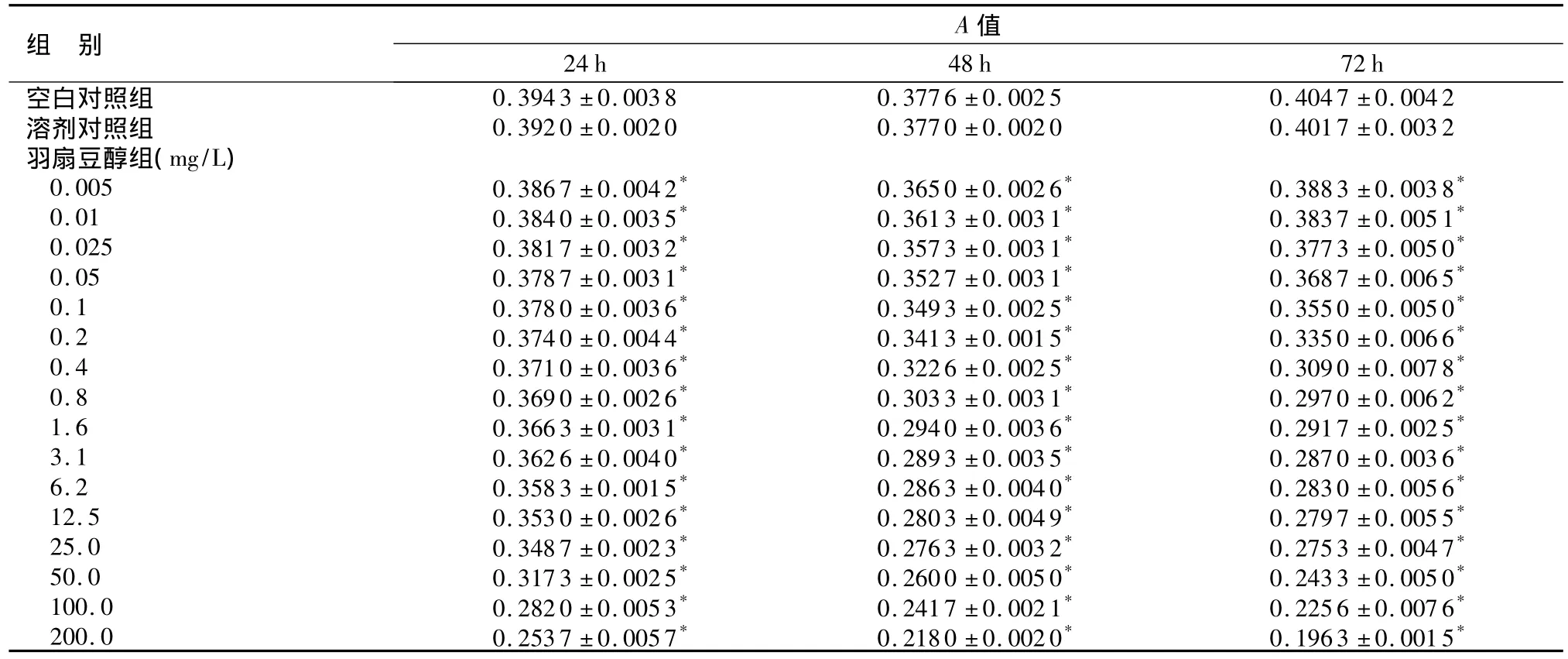
表2 羽扇豆醇作用后SW480细胞的A值(±s,n=3)Table 2 Effect of different concentrations of Lupeol on the A value of SW480 cells(±s,n=3)
与各时间点空白对照组及溶剂对照组相比,*P<0.05
组 别A值24 h 48 h 72 h空白对照组0.3943 ±0.0038 0.3776 ±0.0025 0.4047 ±0.0042溶剂对照组 0.3920 ±0.0020 0.3770 ±0.0020 0.4017 ±0.0032羽扇豆醇组(mg/L)0.005 0.3867 ±0.0042* 0.3650 ±0.0026* 0.3883 ±0.0038*0.01 0.3840 ±0.0035* 0.3613 ±0.0031* 0.3837 ±0.0051*0.025 0.3817 ±0.0032* 0.3573 ±0.0031* 0.3773 ±0.0050*0.05 0.3787 ±0.0031* 0.3527 ±0.0031* 0.3687 ±0.0065*0.1 0.3780 ±0.0036* 0.3493 ±0.0025* 0.3550 ±0.0050*0.2 0.3740 ±0.0044* 0.3413 ±0.0015* 0.3350 ±0.0066*0.4 0.3710 ±0.0036* 0.3226 ±0.0025* 0.3090 ±0.0078*0.8 0.3690 ±0.0026* 0.3033 ±0.0031* 0.2970 ±0.0062*1.6 0.3663 ±0.0031* 0.2940 ±0.0036* 0.2917 ±0.0025*3.1 0.3626 ±0.0040* 0.2893 ±0.0035* 0.2870 ±0.0036*6.2 0.3583 ±0.0015* 0.2863 ±0.0040* 0.2830 ±0.0056*12.5 0.3530 ±0.0026* 0.2803 ±0.0049* 0.2797 ±0.0055*25.0 0.3487 ±0.0023* 0.2763 ±0.0032* 0.2753 ±0.0047*50.0 0.3173 ±0.0025* 0.2600 ±0.0050* 0.2433 ±0.0050*100.0 0.2820 ±0.0053* 0.2417 ±0.0021* 0.2256 ±0.0076*200.0 0.2537 ±0.0057* 0.2180 ±0.0020* 0.1963 ±0.0015*

图3 羽扇豆醇对SW480生长的影响(n=3)Figure 3 Effect of Lupeol on the growth of SW480 cells(n=3)
2.4 共刺激细胞对SW480的杀伤活性影响
2.4.1 共刺激细胞对羽扇豆醇作用后的SW480的杀伤作用 浓度在0.4~12.5 mg/L时,共刺激细胞对SW480的杀伤活性明显高于空白对照组,浓度为12.5 mg/L时杀伤活性最强(71%),与空白对照组(38%)比较,差异有统计学意义(P<0.05)。当浓度超过12.5 mg/L后,杀伤活性开始下降,见图4。
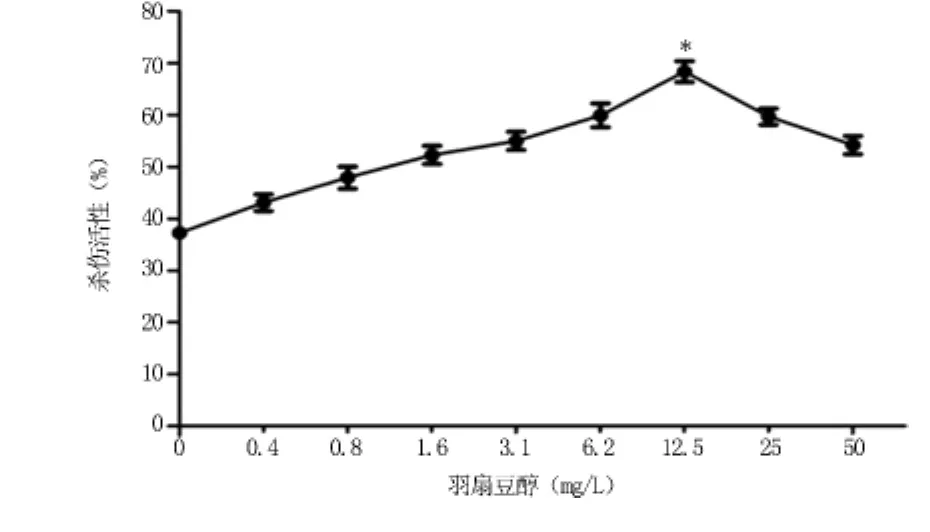
图4 共刺激细胞对羽扇豆醇作用后的SW480的杀伤作用(n=3)Figure 4 The killing effects of the Co-stimulation cells on SW480 cells cultured with Lupeol(n=3)
2.4.2 羽扇豆醇诱导后的共刺激细胞对SW480的杀伤作用 浓度在0.4~12.5 mg/L时,共刺激细胞对SW480的杀伤活性显著升高,12.5 mg/L达到最大值(76%),与空白对照组(40%)比较差异有统计学意义(P<0.05)。当浓度超过12.5 mg/L后,杀伤活性开始下降,见图5。
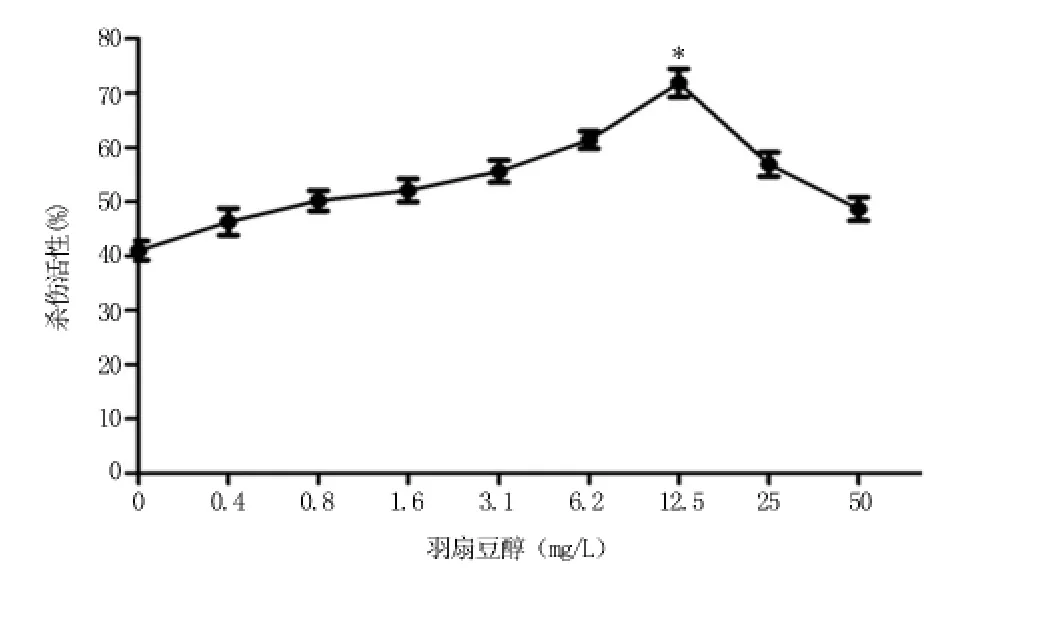
图5 羽扇豆醇诱导后的共刺激细胞对SW480的杀伤作用(n=3)Figure 5 The killing effects of the Co-stimulation cells which cultured with Lupeol on SW480 cells(n=3)
3 讨 论
羽扇豆醇具有抗炎止痛、抗糖尿病等药理活性[8-9]。近年来的研究发现羽扇豆醇也具有抗肿瘤的作用,张琳和张有成[10]的研究表明羽扇豆醇对黑色素瘤、白血病、皮肤癌、胰腺癌、乳腺癌都有抗肿瘤作用,抗肿瘤机制主要是诱发肿瘤凋亡、阻断肿瘤细胞的信号传导通路,抑制肿瘤血管生成及转移。
细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)是多种刺激因子联合诱导活化的NK样T细胞。不仅具有T淋巴细胞特异性抗瘤活性,而且有NK细胞的非MHC限制性杀瘤特性,其增值速度快、杀伤活性高、杀瘤谱广、副作用小和对正常骨髓造血影响轻等优点而被广泛应用于肿瘤的过继性免疫治疗[11]。许多研究发现,添加不同的共刺激因子对T细胞的增殖和抗肿瘤效应有一定的影响。在T细胞培养体系中增加CD28mAb,可促进其增殖[12];加入 IL-15能抑制 T细胞的凋亡及其中 IFN-γ、TNF-α的分泌[13];加入 IL-21 可促进肿瘤组织中Th17细胞的分化[14],参与固有免疫及适应性免疫[15],加入IL-2、IL-15来增强 T细胞的细胞毒活性并促进 IFN-γ 的分泌[16],促进记忆 T细胞的增殖[17]。在常规 CIK细胞培养基中加入刺激因子(CD3、CD28、IFN-γ、IL-2、IL-1α、IL-15 和 IL-21)后,发现这样不仅能促进细胞增殖,而且能提高特异性细胞毒T细胞的扩增,增加记忆性细胞比值[18]。将这些细胞因子刺激后得到的T细胞称为共刺激细胞。与CIK细胞的区别在于其培养前后细胞表型CD3、CD56、CD107a的表达明显高于CIK细胞,具有比CIK细胞更强的抗肿瘤活性。有研究证实,共刺激细胞有抗胃癌SGC-7901、SW-1990和SW-1116细胞的作用[18],其抗肿瘤的机制主要是通过释放穿孔素、颗粒酶而裂解靶细胞。穿孔素是存在于细胞毒性T淋巴细胞、自然杀伤细胞和γδT细胞胞质中的细胞毒颗粒,当这些细胞与靶细胞接触后可释放穿孔素,在靶细胞膜上形成多聚穿孔素管状通道,导致靶细胞溶解破坏[19]。颗粒酶B是杀伤性T淋巴细胞和NK细胞颗粒中最重要的丝氨酸蛋白酶,通过Caspases依赖途径、直接入核途径及不依赖Caspases的胞质途径杀伤靶细胞[20]。T细胞表面的CD107a分子,与抗原特异性细胞活化后的脱颗粒过程有关,脱颗粒则是穿孔素、颗粒酶依赖性靶细胞杀伤过程的关键步骤[21]。但共刺激细胞对抗结肠癌的报道尚不多见。
既往我们研究已证实,羽扇豆醇在一定时间、一定的浓度范围内能促进γδ T细胞、NK细胞的生长,抑制胰腺癌[6]、胃癌[22]细胞的增殖,增强 γδ T 细胞、NK细胞对胰腺癌、胃癌的杀伤活性。本实验主要研究羽扇豆醇诱导后共刺激细胞杀伤结肠癌的作用,结果发现羽扇豆醇的浓度在0.1~12.5 mg/L范围内对共刺激细胞的生长有促进作用,超过12.5 mg/L促进作用开始减弱,这说明在适当的浓度范围内,羽扇豆醇能促进共刺激细胞的生长。随着浓度的逐渐升高,羽扇豆醇对结肠癌细胞株SW480的抑制作用逐渐增强,说明其有抗结肠癌细胞增殖的作用。另外,羽扇豆醇诱导后,共刺激细胞对结肠癌细胞株SW480的杀伤活性明显增强,说明羽扇豆醇不仅能提高SW480对共刺激细胞的敏感性,而且能提高共刺激细胞对SW480的杀伤能力。其机制可能与羽扇豆醇能上调共刺激细胞内穿孔素、颗粒酶、CD107a的表达有关,其对共刺激细胞信号通路的影响还需进一步研究。
[1] 万岱维,何宋兵,汪 良.微小RNA在结肠癌中的研究进展[J].医学研究生学报,2013,26(4):421-424.
[2] Beveridge TH,Li TS,Drover JC.Phytosterol content in American ginseng seed oil[J].J Agric Food Chem,2002,50(4):744-750.
[3] Fournet A,Angelo A,Muñoz V,et al.Biological and chemical studies of Pera benensis,a Bolivian plant used in folk medicine as a treatment of cutaneous leishmaniasis[J].J Ethnopharmacol,1992,37(2):159-164.
[4] Kakuda R,Iijima T,Yaoita Y,et al.Triterpenoids from Gentiana scabra[J].Phytochemistry,2002,59(8):791-794.
[5] Saleem M.Lupeol,a novel anti-inflammatory and anti-cancer dietary triterpene[J].Cancer Lett,2009,285(2):109-115.
[6] 罗冠琴,朱炳喜,陈复兴,等.羽扇豆醇对胰腺癌细胞株SW1990及γδT细胞生长的影响[J].世界华人消化杂志,2011,19(28):2958-2962.
[7] Siddique HR,Saleem M.Beneficial health effects of lupeol triterpene:a review of preclinical studies[J].Life Sci,2011,88(7-8):285-293.
[8] Chaturvedi PK,Bhui K,Shukla Y.Lupeol:connotations for chemoprevention[J].Cancer Lett,2008,263(1):1-13.
[9] Tsan MF,Gao B.Pathogen-associated molecular pattern contamination as putative endogenous ligands of Toll-like receptors[J].J Endotoxin Res,2007,13(1):6-14.
[10] 张 琳,张有成.三萜类化合物羽扇豆醇的抗肿瘤作用[J].国际肿瘤学杂志,2012,39(2):113-116.
[11] Li Y,Liu S,Hernandez J,et al.MART-1-specific melanoma tumor-infiltrating lymphocytes maintaining CD28 expression have improved survival and expansion capability following antigenic restimulation in vitro[J].J Immunol,2010,184(1):452-465.
[12] Montagnoli C,Bacci A,Bozza S,et al.B7/CD28-dependent CD4+CD25+regulatory T cells are essential components of the memory-protective immunity to Candida albicans[J].J Immunol,2002,169(11):6298-6308.
[13] Araki A,Hazama S,Yoshimura K,et al.Tumor secreting high levels of IL-15 induces specific immunity to low immunogenic colon adenocarcinoma via CD8+T cells[J].Int J Mol Med,2004,14(4):571-576.
[14] 沈成龙.辅助性T细胞17相关细胞因子与结肠癌的研究进展[J].医学研究生学报,2013,26(4):402-406.
[15] Liu Y,Yang B,Ma J,et al.Interleukin-21 maintains the expression of CD16 on monocytes via the production of IL-10 by human naïve CD4+T cells[J].Cell Immunol,2011,267(2):102-108.
[16] Kmieciak M,Toor A,Graham L,et al.Ex vivo expansion of tumor-reactive T cells by means of bryostatin 1/ionomycin and the common gamma chain cytokines formulation[J].J Vis Exp,2011,14(47):2381-2386.
[17] Søndergaard H,Coquet JM,Uldrich AP,et al.Endogenous IL-21 restricts CD8+T cell expansion and is not required for tumor immunity[J].J Immunol,2009,183(11):7326-7336.
[18] 刘军权,朱 云,陈复兴,等.多种活化因子共刺激对人外周血单个核细胞体外增殖和表型的影响[J].细胞与分子免疫学杂志,2012,28(4):367-370.
[19] Walch M,Golic SL,Velic A,et al.Perforin enhances the granulysin-induced lysis of Listeria innocua in human dendritic cells[J].BMC Immunology,2007,8(14):1471-1472.
[20] Urrea Moreno R,Gil J,Roddriguez-Sainz C,et al.Functional assessment of perforin C domain mutations illustrates the critical role for calcium-dependent lipid binding in perforin cytotoxic function[J].Blood,2009,113(2):338-346.
[21] Prakash MD,Bird CH,Bird PI.Active and xymogen forms og granzyme B are constitutively released from cytotoxic lymphocytes in the absence of target cell engagement[J].Immunol Cell Biol,2009,87(3):249-254.
[22] Wu XT,Liu JQ,Lu XT,et al.The enhanced effect of lupeol on the destruction of gastric cancer cells by NK cells[J].Int Immunopharmacol,2013,16(2):332-340.

