槲皮素对人胶质母细胞瘤T98G凋亡及HSP27蛋白表达的干预作用
陶晓薇毛其芬
槲皮素对人胶质母细胞瘤T98G凋亡及HSP27蛋白表达的干预作用
陶晓薇1毛其芬2
目的 探讨天然药物槲皮素对人胶质母细胞瘤的生物效应及机制。方法 采用槲皮素治疗人胶质母细胞瘤细胞系T98G,MTT法检测治疗后T98G细胞的增殖抑制情况;流式细胞术检测槲皮素治疗后T98G细胞的凋亡情况,并用Western blot检测细胞活化caspase-3(cleaved caspase-3)的表达和热休克蛋白27(HSP27)的表达;将T98G细胞的HSP27基因用特异性HSP27 siRNA沉默后再用槲皮素治疗,检测槲皮素对T98G细胞的增殖抑制作用和凋亡诱导效应。结果 对照组及5μM、25μM、50μM、100μM、200μM槲皮素组对T98G细胞的48h增殖抑制率分别为0、(0.05± 0.02)%、(21.8±3.4)%、(42.2±5.7)%、(67.6±6.8)%、(76.9±7.0)%,各浓度槲皮素组与对照组比较,差异有统计学意义(P<0.05)。对照组及25μM、50μM、100μM槲皮素组对T98G细胞的凋亡诱导率分别为(0.8±0.3)%、(4.9±0.6)%、(8.1±0.9)%、(21.5±1.7)%,各浓度槲皮素组与对照组比较,差异有统计学意义(P<0.05)。对照组及25μM、50μM、100μM槲皮素组T98G细胞caspase-3活性分别为(0.01±0.01)、(0.05±0.03)、(0.12±0.03)、(0.22±0.05),50μM、100μM槲皮素组与对照组比较,差异有统计学意义(P<0.05);HSP27活性分别为(0.84±0.12)、(0.75±0.11)、(0.52±0.08)、(0.37±0.06),50μM、100μM槲皮素组与对照组比较,差异有统计学意义(P<0.05)。结论 槲皮素有良好的抗神经胶质母细胞瘤的生物活性,其抗肿瘤机制可能和下调HSP27蛋白有关。
人胶质母细胞瘤;槲皮素;T98G;HSP27;凋亡;caspase-3
神经胶质母细胞瘤是最常见的原发性恶性脑癌,恶性胶质瘤细胞通过扩散、渗透入侵正常脑组织,使患者无法进行肿瘤组织全切除手术[1]。据统计,大多数被确诊为神经胶质母细胞瘤的患者,尽管接受了包括手术、放疗、化疗等常规治疗措施,其生存周期仍短于一年[2],寻找新的治疗方法无疑十分重要。和其它的一些恶性肿瘤相似,人脑癌细胞高度表达热休克蛋白27(HSP27)[3]。HSP27的高度表达能显著促进肿瘤细胞的增殖和分化,更为重要的是,HSP27蛋白能保护细胞逃避凋亡这一大多数抗肿瘤药物的效应靶点[4]。槲皮素是一种广泛存在于水果、蔬菜、谷物中的天然黄酮类化合物,有很好的抗氧化和抗炎作用,近年研究发现槲皮素能激活肿瘤细胞的凋亡通路,诱导多种肿瘤细胞凋亡[5]。槲皮素对脑癌的抗肿瘤效应及其机制少见报道。本研究探讨槲皮素对神经胶质母细胞瘤的抗肿瘤效应及机制。
1 材料与方法
1.1 细胞培养 人神经胶质母细胞瘤T98G细胞系来源于美国ATCC(产品号:CRL-1690),培养在DMEM培养基中,含10%胎牛血清,100U/L青霉素和100mg/ mL链霉素,培养环境为37℃恒温,通入5%的CO2。
1.2 试 剂 DMEM培养基购于美国Gibco公司,胎牛血清购于杭州四季青生物工程有限公司。槲皮素、二甲亚砜、噻唑蓝(MTT)购于Sigma-Aldrich。PI/ AnnexinⅤ凋亡试剂盒购于美国ebioscience。活化caspase-3抗体(cleaved caspase-3,该抗体只和活化caspase-3结合,不和非活化全长caspase-3结合,产品号:#9664),HSP27抗体(产品号:#2402)及βactin抗体(产品号:#4967)购于美国cell signaling公司。细胞蛋白裂解液购于碧云天公司。PVDF膜购于美国Millipore公司。HSP27 siRNA合成于广州锐博生物有限公司。转染试剂Lipofectamine 2000购于Invitrogen公司。
1.3 MTT试验 将T98G细胞按2000个/孔接种于96孔板,加入200μL含10%胎牛血清的DMEM培养,设置3个复孔,并分别予5、25、50、100和200μM的槲皮素培养24、48h,对照组为不加槲皮素同样条件培养24、48h。加5mg/mLMTT 20μL,继续培养4h。弃上清,往孔中加入150μL二甲亚砜,570nm波长下用酶标仪检测OD值,细胞增殖抑制率计算公式:抑制率=(OD对照组-OD槲皮素组)/OD对照组× 100%。
1.4 细胞凋亡试验 T98G细胞的凋亡采用Annexin V/PI染色法检测。在T98G细胞培养瓶中分别加入25、50、100μM的槲皮素培养24h,对照组不加槲皮素同样条件培养24h,之后按照试剂说明书将PI和Annexin V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡。Annexin V单阳性细胞为早期凋亡细胞,Annexin V和PI双阳性细胞为晚期凋亡[6],因此细胞凋亡率用Annexin V阳性细胞占所有细胞比值表示。
1.5 Western blot试验 在T98G细胞培养瓶中分别加入25、50和100μM的槲皮素培养24h,对照组为不加槲皮素同样条件培养24h,收集细胞并裂解,裂解液用12.5%的丙烯酰胺进行SDS-PAGE,之后将凝胶取下将蛋白转膜到PVDF膜上。将膜在HSP27一抗或cleaved caspase-3一抗稀释液中孵育过夜,之后在带辣根过氧化物酶活性的二抗稀释液中孵育2h,ECL试剂显色曝光,于暗室中曝光X线胶片,以HSP27或cleaved caspase-3蛋白条带与β-actin蛋白条的灰度比值表示蛋白的相对表达水平。
1.6 细胞转染 将T98G细胞接种在6孔板中,待细胞密度生长到铺满板面约80%时按Lipofectamine 2000操作说明书在 T98G细胞中转染 100nM的HSP27 siRNA或无关对照siRNA培养16h,之后加100μM的槲皮素再培养24h,检测细胞增殖抑制率,凋亡水平和 cleaved caspase-3表达水平。HSP27 siRNA序列为:正向:5'-GAGUGGUCGCAGUGGUUAGUU-3';反向:5'-CUAACCACUGCGACCACUCUU-3'。无关RNA序列为正向:5'-UGGGAGCAGUCG UAGUGGUUU-3';反向:5'-CUCCCAACCACUGCGA CUAUU-3'
2 结果
2.1 槲皮素对神经胶质母细胞瘤T98G的抑制作用
与对照组比较,T98G细胞在较小浓度槲皮素作用下即呈现出抗肿瘤效应(浓度≥25μM),随着槲皮素剂量增加,抗肿瘤生长效应逐渐增强,用槲皮素治疗48h较24h抑制作用更加明显,提示槲皮素对肿瘤细胞的杀伤作用随着治疗时间的增加而增强。见表1。
表1 不同浓度槲皮素对T98G细胞的抑制作用(±s)
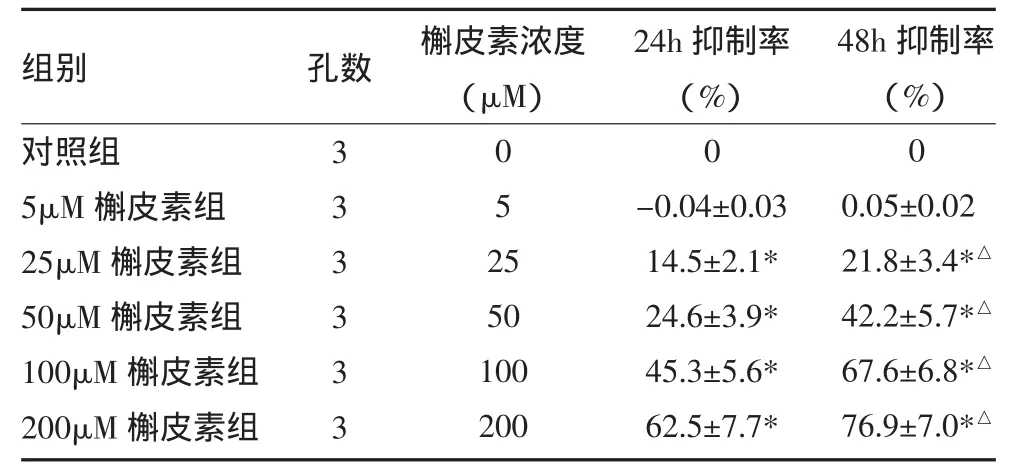
表1 不同浓度槲皮素对T98G细胞的抑制作用(±s)
注:与对照组比较,*P<0.05;与同浓度槲皮素处理24h比较,△P<0.05
组别对照组5μM槲皮素组25μM槲皮素组50μM槲皮素组100μM槲皮素组200μM槲皮素组孔数 槲皮素浓度(μM)3 3 3 3 3 3 0 5 2 5 50 100 200 24h抑制率(%)0 -0.04±0.03 14.5±2.1* 24.6±3.9* 45.3±5.6* 62.5±7.7* 48h抑制率(%)0 0.05±0.02 21.8±3.4*△42.2±5.7*△67.6±6.8*△76.9±7.0*△
表2 槲皮素下调HSP27表达并诱导T98G细胞凋亡(±s)
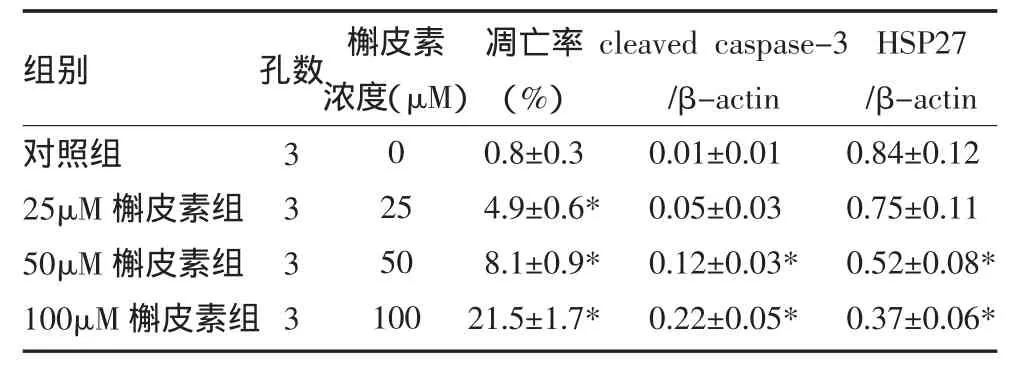
表2 槲皮素下调HSP27表达并诱导T98G细胞凋亡(±s)
注:与对照组比较,*P<0.05
组别对照组25μM槲皮素组50μM槲皮素组100μM槲皮素组孔数3 3 3 3槲皮素浓度(μM)0 25 50 100凋亡率(%)0.8±0.3 4.9±0.6* 8.1±0.9* 21.5±1.7* cleaved caspase-3 /β-actin 0.01±0.01 0.05±0.03 0.12±0.03* 0.22±0.05* HSP27 /β-actin 0.84±0.12 0.75±0.11 0.52±0.08* 0.37±0.06*
表3 HSP27 siRNA对槲皮素发挥抗肿瘤效应的影响(±s)
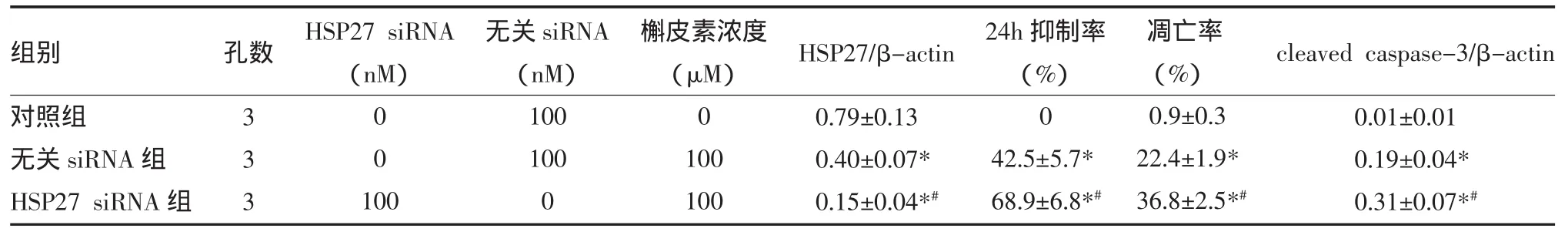
表3 HSP27 siRNA对槲皮素发挥抗肿瘤效应的影响(±s)
注:与对照组比较,*P<0.05;与无关siRNA组比较,#P<0.05
组别对照组无关siRNA组HSP27 siRNA组孔数HSP27 siRNA(nM)3 3 3 0 0 100无关siRNA(nM)100 100 0槲皮素浓度(μM)0 100 100 HSP27/β-actin 0.79±0.13 0.40±0.07* 0.15±0.04*#24h抑制率(%)0 42.5±5.7* 68.9±6.8*#凋亡率(%)0.9±0.3 22.4±1.9* 36.8±2.5*#cleaved caspase-3/β-actin 0.01±0.01 0.19±0.04* 0.31±0.07*#
2.2 槲皮素下调T98G细胞HSP27的表达并诱导细胞凋亡 T98G细胞用槲皮素治疗后用Annexin V/PI染色法检测细胞凋亡,发现槲皮素呈剂量依赖性诱导T98G细胞凋亡,见表2。Caspase-3是执行凋亡的关键蛋白,当caspase-3被激活后,通过切断多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)导致细胞进入凋亡程序[7]。Western blot试验发现槲皮素治疗使T98G细胞cleaved caspase-3水平显著提高。HSP27的表达水平显著降低,见表2。提示槲皮素可能通过下调HSP27的表达,诱导T98G细胞发生凋亡。
2.3 HSP27基因沉默增强槲皮素的抗肿瘤活性 利用基因沉默技术,将HSP27 siRNA或无关siRNA通过脂质体转染到T98G细胞中,之后将100μM槲皮素加入到细胞培养体系中,检测HSP27基因沉默后槲皮素对T98G细胞生长的抑制效应和凋亡诱导效应。结果显示,转染HSP27 siRNA可显著降低HSP27的表达,增强槲皮素对T98G细胞生长的抑制作用。与转染无关siRNA组比较,转染HSP27 siRNA槲皮素对T98G细胞的凋亡诱导能力显著增强,cleaved caspase-3表达水平大大提高,见表3。提示HSP27蛋白是神经胶质母细胞瘤抵抗凋亡的关键分子,槲皮素可能通过下调肿瘤细胞HSP27的表达发挥抗肿瘤效应。
3 讨论
神经胶质母细胞瘤的特征之一是高表达热休克蛋白,这可能是因为胶质瘤细胞处于高度低氧和pH失衡状态,热休克蛋白的细胞保护作用是肿瘤存活不可缺少的重要机制[8]。在热休克蛋白家族中,HSP27通过与凋亡信号通路中的关键分子相互作用,阻断凋亡信号的传导并抑制caspase的活化,从而对保护肿瘤细胞逃避凋亡起着关键的调节作用[9]。此外,HSP27还能抑制前caspase-9和前caspase-3的表达,并抑制从线粒体中释放的细胞色素C的活性来达到阻断凋亡的目的[10]。槲皮素是一种天然黄酮素,具有良好的抗肿瘤活性能诱导肿瘤细胞发生凋亡,其机制包括打开肿瘤细胞线粒体膜孔道释放细胞色素C,活化caspase-9和caspase-3等途径[11-12]。本研究发现,槲皮素具有显著的体外抗神经胶质母细胞瘤的生物效应,诱导脑癌细胞凋亡。进一步研究发现,槲皮素可显著下调热休克蛋白27这一关键的抗凋亡蛋白,这可能是槲皮素诱导肿瘤细胞凋亡的机制之一。当用HSP27 siRNA转染T98G细胞使HSP27基因沉默后,槲皮素对T98G细胞的凋亡效应和caspase-3的活化程度都显著增强,这些结果都支持了槲皮素诱导T98G细胞凋亡依赖于HSP27的下调这一观点。综上所述,本研究结果显示槲皮素有潜在的抗脑肿瘤的生物效应,为脑肿瘤的药物治疗提供了新的途径和理论依据。
[1]Grzmil M,Hemmings BA.Deregulated signaling networks in human brain tumors[J].Biochim Biophys Acta,2010,1804(3):476-483.
[2]Yamanaka R,Saya H.Molecularly targeted therapies for glioma[J].Ann Neurol,2009,66(6):717-729.
[3]Alexiou GA,Karamoutsios A,Vartholomatos G,et al.Expression of heat shock proteins in brain tumors[J].Turk Neurosurg,2014,24(5):745-749.
[4]Association of nuclear-localized.Nemo-like kinase with heat-shock protein 27 inhibits apoptosis in human breast cancer cells[J].PLoSOne,2014,9(5):e96506.
[5]Xiang T,Fang Y,Wang SX.Quercetin suppresses HeLa cells by blocking PI3K/Akt pathway[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(5):740-744.
[6]Gao M,Li Y,Li Y,et al.Down-regulation of CD59 inhibits proliferation and promotes apoptosis of HeLa cells[J].Xi Bao Yu Fen ZiMian Yi Xue Za Zhi,2014,30(6):585.
[7]Tian HY1,Li ZX,Li HY,et al.Effects of 14 single herbs on the induction of caspase-3 in tumor cells:a brief review[J]. Chin J Integr Med,2013,19(8):636-640.
[8]Liu Y,Zheng T,Zhao S,et al.Inhibition of heat shock protein response enhances PS-341-mediated glioma cell death[J].Ann Surg Oncol,2012,19(3):S421-429.
[9]Belkacemi L,Hebb MO.HSP27 knockdown produces synergistic induction of apoptosis by HSP90 and kinase inhibitors in glioblastomamultiforme[J].Anticancer Res,2014,34(9):4915-4927.
[10]Paul C,Manero F,Gonin S,et al.Hsp27 as a negative regulator of cytochrome crelease[J].Mol Cell Biol,2002,22(3):816-834.
[11]Dajas F.Life or death:neuroprotective and anticancer effects ofquercetin[J].JEthnopharmacol,2012,143(2):383-396.
[12]Vargas AJ,Burd R.Hormesis and synergy:pathways and mechanisms of quercetin in cancer prevention and management[J].Nutr Rev,2010,68(7):418-428.
(收稿:2014-10-23 修回:2014-12-26)
Effect of Quercetin on Apoptosis in Glioblastoma Cell Line T98G and the Expression of HSP27 Protein
TAO Xiaowei1,MAO Qifeng2. 1Gongshu District Xiaohe Hushu Street Community Health Center,Hangzhou (310011),China;2Tongde Hospital of Zhejiang Province,Hangzhou(310012),China
Objective To investigate the effect and mechanism of natural medicine quercetin on glioblastoma cells.M ethods T98G cells were treated with quercetin and the proliferation was measured by using the MTT assay.The apoptosis of T98G was measured by flow cytometry and the expression of cleaved caspase-3 and HSP27 in T98G cells treated with quercetin was detected by western blot.The specific siRNA transfected method was used for blocking the expression of HSP27 gene before T98G cells were treated with quercetin,then the proliferation and apoptosis were detected.Results The 48-hour proliferation inhibition rates of T98G cells in control group,5μM quercetin group,25μM quercetin group,50μM quercetin group,100μM quercetin group,and 200μM quercetin group were 0,(0.05±0.02)%,(21.8±3.4)%,(42.2±5.7)%,(67.6±6.8)%,(76.9±7.0)%,respectively,with significant difference among them(P<0.05).The apoptosis rate of T98G cells in control group,25μM quercetin group,50μM quercetin group,and 100μM quercetin group were(0.8±0.3)%,(4.9±0.6)%,(8.1±0.9)%,(21.5±1.7)%, respectively,with significant difference among them(P<0.05);caspase-3 activity ratio in control group,25μM quercetin group,50μM quercetin group,and 100μM quercetin group were 0.01±0.01,0.05±0.03,0.12±0.03,and 0.22±0.05,with significant difference between control group and 50μM quercetin group and 100μM quercetin group(P<0.05);HSP27 inhibition ratio in control group,25μM quercetin group,50μM quercetin group,and 100μM quercetin group were 0.84±0.12,0.75±0.11,0.52±0.08,and 0.37±0.06,with significant difference between control group and 50μM quercetin group and 100μM quercetin group(P<0.05).Conclusion Quercetin has some anti-glioblastoma effect,and the underlying mechanism may be through down-regulating the expression of HSP27.
glioblastoma;quercetin;T98G;HSP27;apoptosis;caspase-3
1杭州市拱墅区小河湖墅街道社区卫生服务中心检验科(杭州 310011);2浙江省立同德医院检验科(杭州 310012)
陶晓薇,Tel:13777406008;E-mail:qongshutaoxiaowei@163.com

