北京地区警犬皮肤伪中间型葡萄球菌药敏试验及耐药基因筛查
周传铎 , 赵 然, 金艺鹏, 周雅楠 , 李晓晓 , 林德贵, 张 迪
(1.中国农业大学动物医学院 , 北京海淀100193 ; 2.北京市公安局刑侦总队警犬技术支队 , 北京大兴102614)
北京地区警犬皮肤伪中间型葡萄球菌药敏试验及耐药基因筛查
周传铎1,2, 赵 然2, 金艺鹏1, 周雅楠1, 李晓晓1, 林德贵1, 张 迪1
(1.中国农业大学动物医学院 , 北京海淀100193 ; 2.北京市公安局刑侦总队警犬技术支队 , 北京大兴102614)
采用纸片扩散法对北京地区警犬皮肤分离出的23株伪中间型葡萄球菌进行药物敏感性试验, 并用PCR扩增技术进行相关耐药基因筛查。 结果显示: 23株伪中间型葡萄球菌对头孢西丁、 阿米卡星、 阿莫西林-克拉维酸、 头孢曲松、 氟苯尼考全部敏感, 对青霉素G耐药性最高, 为52.17%; 耐药基因筛查中, 3株未检出耐药基因, 占13.04%; 耐药基因中,linA/linA’检出率最高, 为47.83%; 耐药基因谱型以aacA-aphD、linA/linA′为主, 占17.39%。
伪中间型葡萄球菌 ; 警犬 ; 耐药基因 ; 脓皮病
现代研究表明,伪中间型葡萄球菌为犬脓皮病的最主要致病菌[1],而随着抗菌药物的大量使用,已有越来越多的细菌出现耐药表型[1-2]。为加强对北京地区警犬脓皮病的进一步了解,本试验对从北京警犬皮肤分离的23株伪中间型葡萄球菌进行药物敏感性试验及多种耐药基因筛查,为其流行病学研究、临床用药提供依据。
1 材料与方法
1.1 检测样本 从北京警犬体表皮肤分离的23株伪中间型葡萄球菌,其中脓皮病患处分离得到17株,健康犬体表分离得到6株。
1.2 试剂与设备 细菌培养所用各种培养基,购自北京奥博星生物技术责任有限公司;药敏试纸片,分别购自赛默飞世尔生物化学制品(北京)有限公司及北京天坛药物生物技术开发公司;培养基及其他试剂均按产品说明书或常规方法配制;标准菌株金黄色葡萄球菌ATCC25923、ATCC29213由中国农业大学药理实验室提供;DNA Marker,购自天跟生化科技(北京)有限公司;2 * EasyTaqSupper Mix,购自北京全式金生物技术有限公司;PCR引物设计参照相关文献[3,4],由北京三博远志生物技术有限公司合成,具体信息见表1。
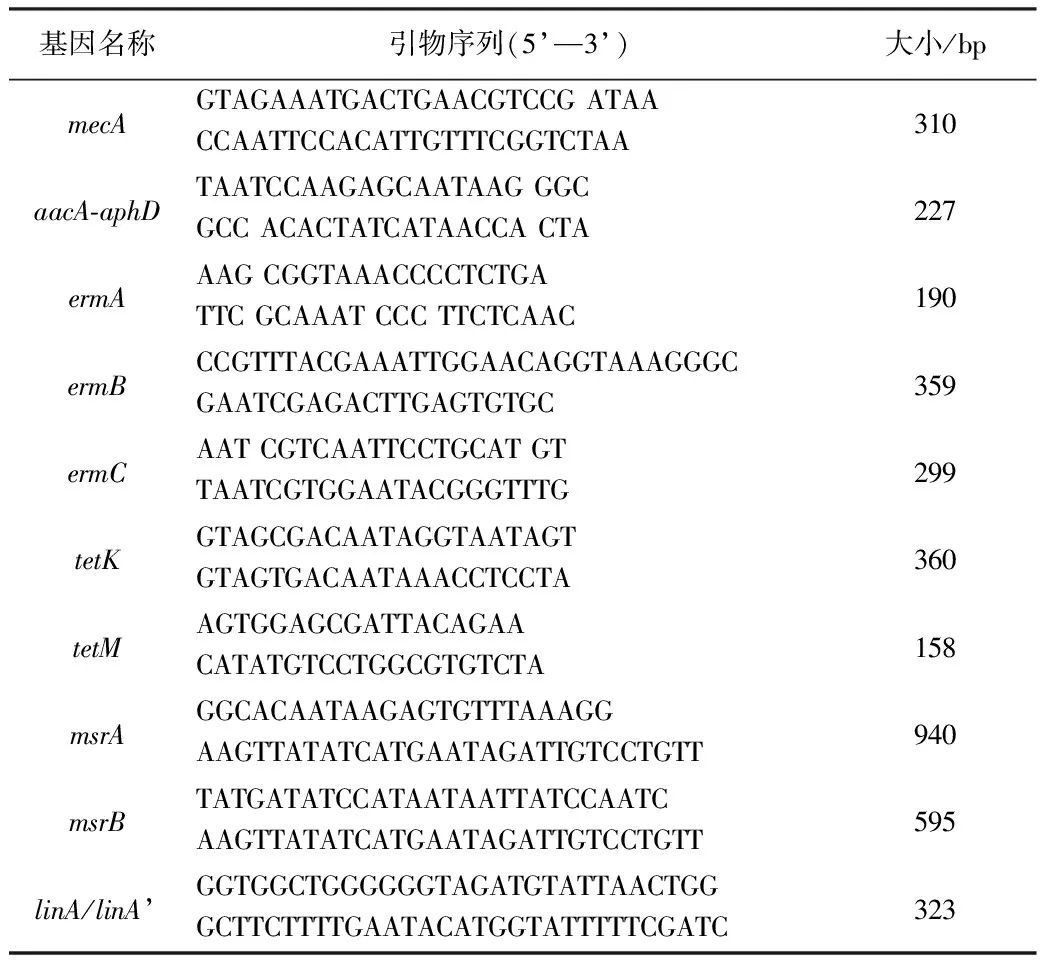
表1 PCR检测耐药基因引物序列、扩增片段长度
1.3 药敏试验 常规方法对菌株进行培养,并采用纸片扩散法进行药物敏感性试验。结果判定依CLSI(2015修订版)进行。
1.4 耐药基因筛查 (1)采用水煮法[5]提取细菌DNA;(2)在冰浴中冷启动Taq酶及上下游引物;(3)先后按照Taq酶、灭菌蒸馏水、各目标引物、水煮法提取的DNA的顺序加入至PCR离心管中,低速旋转混匀。以灭菌双蒸水为阴性对照组。具体加样量为Taq酶12.5 μL,上、下游引物各1 μL,样本DNA 2 μL,其他由灭菌双蒸水8.5 μL补充,构建25 μL反应体系;(4)PCR操作依表2标注的条件进行;(5)电泳时,加入DL100 Marker作为参照(M),最后一孔(25孔)为阴性对照组(C)。将阳性条带的PCR原液送到测序公司测序,得到的序列在NCBI网站中进行比对,并判读结果。
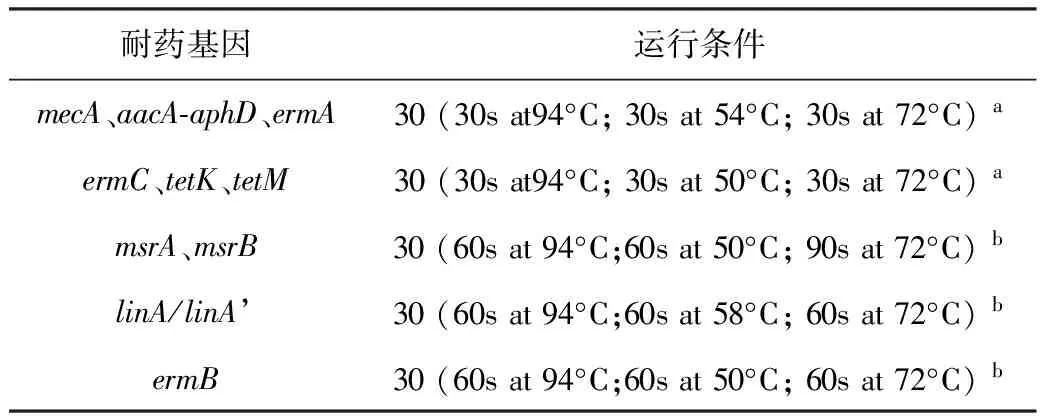
表2 PCR运行条件
注: a:预变性条件94 °C,3 min;延伸阶段条件72 °C,4 min; b:预变性条件 94 °C,10 min;延伸阶段条件72 °C,10 min
2结果
2.1 伪中间型葡萄球菌耐药情况 试验中,23株伪中间型葡萄球菌对头孢西丁、阿米卡星、阿莫西林-克拉维酸、头孢曲松、氟苯尼考全部敏感,对青霉素G耐药性最高,为52.17%,其他具体结果见表3。
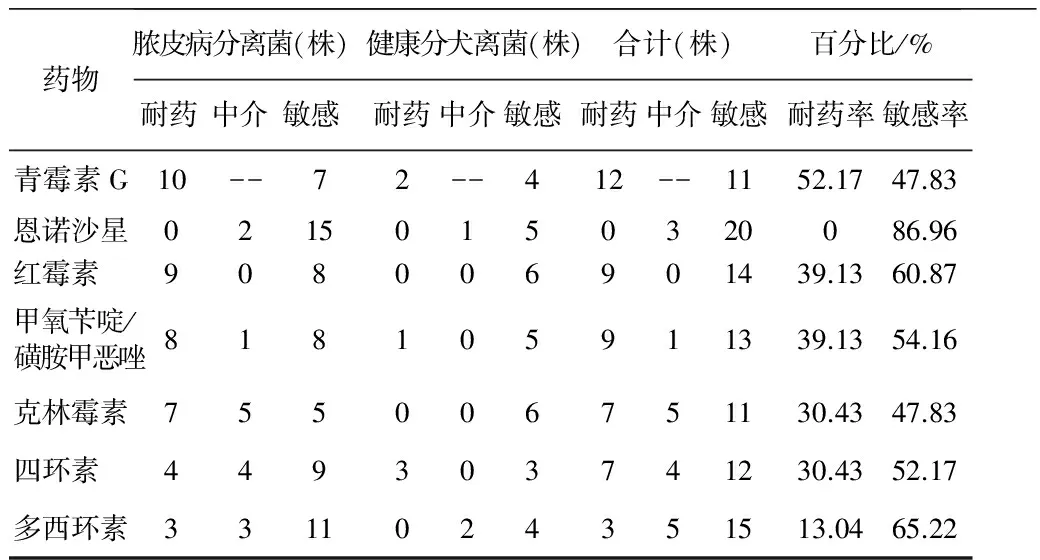
表3 非全部敏感伪中间型葡萄球菌耐药情况
2.2 伪中间型葡萄球菌耐药基因携带情况 对23株北京地区警犬皮肤采集的伪中间型葡萄球菌常见耐药基因携带情况的检测结果(见图1-5)显示,未检出耐药基因的菌株共3株,占13.04%;其余20株菌均检出耐药基因,其中linA/linA’检出率最高,为47.83%;aacA-aphD占比39.13%,次之;ermB、msrB和tetK分别为 34.78%、13.04%和8.70%;其他耐药基因未检出。耐药基因谱型中,检出aacA-aphD、ermB、tetK、linA/linA’谱型1株,占3.35%;检出aacA-aphD、msrB、linA/linA’谱型1株;aacA-aphD、linA/linA’谱型4株。具体结果见表4。

表4 伪中间葡萄球菌耐药基因谱型检出情况
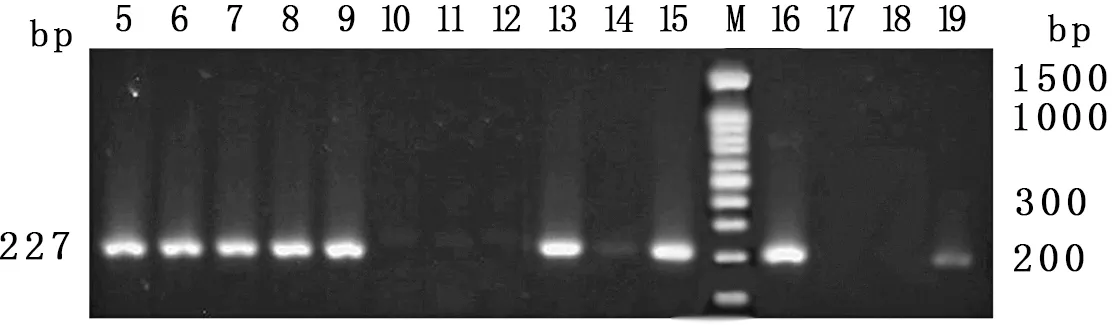
图1 aacA-aphD基因检测结果
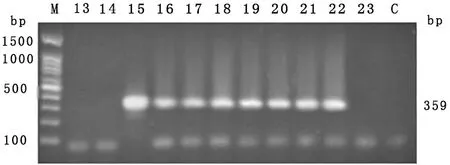
图2 ermB基因检测结果

图3 tetK基因检测结果
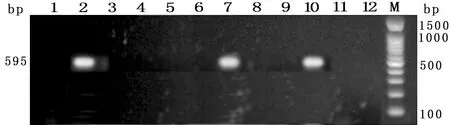
图4 msrB基因检测结果
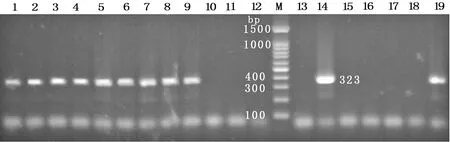
图5 linA/linA’基因检测结果注:M:DL-100 Marker;C:阴性对照;1~23:伪中间型葡萄球菌提取DNA(图1-5仅显示阳性结果,部分阴性结果及阴性对照未列出)
3 分析与讨论
3.1 耐药基因与细菌药物敏感性之间的关系mecA基因,为一种外源性基因,可与葡萄球菌基因结合后,降低药物对细菌细胞壁合成的阻碍作用,从而在临床表型方面表现为对β-内酰胺类抗生素耐药[6]。mecA为检测耐甲氧西林葡萄球菌的可靠方法。本试验中,未检出该基因,且所有试验菌均对头孢西丁敏感,可以推定试验菌中无耐甲氧西林伪中间型葡萄球菌。但试验中,有52.17%菌株对青霉素G耐药,因此提示在选择β-内酰胺类药物进行治疗时,仍要慎重。
aacA-aphD为氨基糖苷类抗菌药物耐药基因,其主要是通过编码氨基糖苷钝化酶作用于药物特异的氨基或羟基上,使药物难与细菌的核糖体结合、药物摄入的能量依赖阶段Ⅱ不能进行,从而导致耐药[7-8]。本试验中,共从9株伪中间型葡萄球菌中筛选出aacA-aphD基因,占比39.13%,但药敏试验结果显示,23株细菌对阿米卡星均敏感。杨静[2]试验中耐甲氧西林伪中间型葡萄球菌100%携带aacA-aphD基因,但对庆大霉素表现耐药的菌株只有39.4%。Perreten[9]等的试验中,亦有19株菌出现类似情况。以上信息均提示伪中间型葡萄球菌对于aacA-aphD基因可能存在基因耐药、表型不耐药的情况。
Tet类基因为四环素类药物耐药基因,通过阻止氨酰tRNA与核糖体结合位点(A)的结合来阻止菌体蛋白合成而发挥作用。tetM基因可介导细菌则对所有四环素类药物耐药,而tetK基因则仅致细菌四环素耐药,但对多西环素等其他药物敏感,且tetK在甲氧西林敏感葡萄球菌中存在较多,而tetM基因则普遍存在于耐甲氧西林葡萄球菌中[10-11]。本试验,2株菌检出tetK基因,该两株菌均对四环素耐药、对多西环素中介,所有菌株菌未检出tetM基因,与先前论述相符;另5株菌对四环素耐药、3株菌对多西环素耐药,其可能存在其他耐药基因型,或为表型耐药而无基因耐药。
葡萄球菌对大环内酯类、林可酰胺类药物与链阳菌素类药物这三类通过抑制细菌蛋白质合成而发挥抗菌作用的药物产生耐药的机制主要有两种。一类由erm类基因介导,编码核糖体甲基化酶,催化23S rRNA的核糖体形态改变,降低抗生素与细菌核糖体靶位的亲和力,从而导致耐药。该类又可分为诱导型和组成型。诱导型为erm基因受药物诱导而表达,其表型为对大环内酯类抗生素耐药,但对克林霉素敏感;组成型则为erm基因的稳定表达,对红霉素及林可霉素均耐药[12]。另一类为由msr介导,编码依赖于ATP的泵出蛋白,将抗生素泵出细胞,保持细胞内抗生素的低浓度水平,可介导细菌对大环内酯类和链阳菌素B同时耐药,而对林可霉素敏感[13]。linA/linA′基因介导细菌产生林可霉素核苷转移酶灭活林可霉素和克林霉素,但体外仅对林可霉素高耐,而对克林霉素可能表现敏感[4]。本试验中,筛查出携带ermB基因的菌株8株,但与之对应仅有3株表现为克林霉素中介,其余为敏感,推测分离所得ermB均为诱导型;筛查出携带msrB基因菌株3株,均表现为红霉素耐药;携带linA/linA′基因11株,其中6株表现对克林霉素耐药、2株中介、3株敏感。存在未检出相应耐药但表现耐药的情况,可对其采用其他耐药基因进行进一步筛查。
3.2 伪中间型葡萄球菌携带的耐药基因谱型 Schwarz[14]等在德国采集伪中间型葡萄球菌的耐药基因谱型为mecA、aacA/aphD、tetK,而杨静[2]针对北京耐甲氧西林伪中间型葡萄球的筛查结果显示,其耐药基因谱型为mecA、ermB、tetK、aacA-aphD。本试验中,23 株伪中间型葡萄球菌中未筛查到mecA基因,主要存在的耐药基因谱型为linA/linA’、aacA-aphD,占17.39%。
[1] Karen H R, Alexander H W. 小动物皮肤病诊疗彩色图谱(第2版)李国清译[M]. 北京:中国农业出版社,2014:196-211.
[2] 杨静. 犬化脓感染病原菌耐药性调查及耐甲氧西林假中间型葡萄球菌流行病学研究[D].北京:中国农业大学硕士学位论文,2011.
[3] Strommenger B, Kettlitz C, Werner G,etal. Multiplex PCR assay for simultaneous detection of nine clinically relevant antibiotic resistance genes inStaphylococcusaureus[J]. Journal of Clinical Microbiology, 2003, 41: 4089-4094.
[4] Lina G, Quaglia A, Reverdy M E,etal. Distribution of genes encoding resistance to macrolides, lincosamides, and streptogramins amongstaphylococci[J]. Antimicrobial Agents and Chemotherapy, 1999, 43: 1062-1066.
[5] Lima D C N E, Dos S K R N, Mondino P J J,etal. Detection of ileS-2 gene encoding mupirocin resistance in methicillin-resistantStaphylococcusaureusby multiplex PCR[J]. Diagnostic Microbiology and Infected Disease, 1999, 34: 77-81.
[6] Ryffel C, Kayser F, Berger B B. Correlation between regulation of mecA transcription and expression of methicillin resistance instaphylococci.[J]. Antimicrob Agents Chemother, 1992, 36:25-31.[7] Fluit A C, Visser M R, Schmitz F J. Molecular detection of antimicrobial resistance[J].Clin Microbiol Rev, 2001, 14 (4): 836-871.
[8] Martineau F, Picard F J, Lansac N,etal.Correlation between the resistance genotype determined by mul-tiplex PCR assays and the antibiotic susceptibility patterns ofStaphylococcusanreusandStaphylococcusepidermidis[J].Antimierob Agents Chemother, 2000, 4(2): 231-238.
[9] Perreten V, Kadlec K, Schwarz S,etal. Clonal spread of methicillin-resistantStaphylococcuspseudintermediusin Europe and North America: an international multicentre study[J]. Journal ofAntimicrobial Chemotherapy, 2010, 65: 1145-1154.
[10] Schwartz B S, Graber C J, Diep B A,etal. Doxycycline, not minocycline, induces its own resistance in multi-drugresistant, community-associated methicillin-resistantStaphylococcusaureusclone[J]. Clinical Infectious Diseases, 2009,48: 1483-1484.
[11] Trzcinski K, Cooper B S, Hryniewicz W,etal. Expression of resistance to tetracyclines in strains of methicillin-resistantStaphylococcusaureus[J]. Journal of Antimicrobial Chemotherapy, 2000, 45: 763-770.
[12] Fiebelkorn K R, Crawford S A, McElmeel M L,eta1. Practical disk difusion method for detection of inducible clindamycin resistance inStaphylococcusaureusand coagulase-negativeStaphylococci[J].J ClinMicrobiol, 2003, 41(10) : 4740-4744.
[13] Leclercq R.Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements and their clinical implications[J].Clin Infect Dis, 2002, 34(4) :482-492.
[14] Schwarz S, Kadlec K, Strommenger B. Methicillin-resistantStaphylococcusaureusandStaphylococcuspseudintermediusdetected in the BfT-Germ Vet monitoring programme 2004-2006 in Germany[J]. Journal of Antimicrobial Chemotherapy, 2008, 61: 282-285.
Antibacterial Sensitive Test and Drug-resistant Genetic Screening forStaphylococcusPseudintermediusfrom the Skins of Police Dogs in Beijing Area
ZHOU Chuan-duo1,2, ZHAO Ran2, JIN Yi-peng1, ZHOU Ya-nan1,LI Xiao-xiao1, LIN De-gui1, ZHANG Di1
(1.College of veterinary medicine,China Agriculture University, Beijing 100193, China;2. Detachment of police dogs techniques ,Beijing Criminal Investigation Department,Beijing 102614, China)
The paper disk diffusion was used for testing the antibacterial sensitivity of 23staphylococcuspseudintermediusstrains from the skins of police dogs in Beijing area, while drug-resistant genetic screening was taken by PCR method. All bacterial strains were sensitive to the drugs of cefoxitin, amikacin, amoxicillin-, clavulanic acid, ceftriaxone and florfenicol, while the highest rate of drug resistant was to penicillin G at 52.17%. Of 23 strains, 3 were detected as negative in drug-, resistant gene. In the drug-, resistant genetic,linA/linA’ was with the highest prevalence as 47.83%. TheaacA-aphDandlinA/linA’ took amount of 17.39% in all drug-, resistant genetic typing.
staphylococcuspseudintermedius, policedog, drug resistance gene, pyodermia
ZHANG Di
2015-11-16
周传铎(1982-),男,兽医师,博士,从事警犬疾病防治工作,E-mail: zthxc@163.com
张迪,E-mail: dzhangdvm@cau.edu.cn
S858.292
A
0529-6005(2016)11-0100-04

