沙门菌常见O抗原和H抗原荧光PCR检测方法评估
曹阳,韩营营,李杰,阚飙,闫梅英
中国疾病预防控制中心 传染病预防控制所,北京 102206
沙门菌常见O抗原和H抗原荧光PCR检测方法评估
曹阳,韩营营,李杰,阚飙,闫梅英
中国疾病预防控制中心 传染病预防控制所,北京 102206
目的:评估沙门菌常见A~F血清群O抗原和H抗原荧光PCR检测方法对不同血清型沙门菌的检测效果。方法:选用不同血清型沙门菌制备模板,运用沙门菌O抗原A~F群及不同H抗原荧光PCR检测试剂盒对这些菌株进行扩增检测,分别计算不同血清型检测结果的灵敏度、特异度、检测下限、假阳性率、假阴性率、Kappa值等指标并进行分析。结果:对7种不同沙门菌O抗原的检测灵敏度为85.71%~100.00%,特异度为66.67%~100.00%;对7种不同沙门菌H抗原的检测,H1,5及Hi-l的灵敏度不高,分别为35.71%及57.14%,但特异度均较高(87.50%~100.00%);经Fisher精确检验,除H1,5阳性检测的P>0.05(P=0.162),其余为P<0.05;C1、C2、D1、E、F血清群及H抗原1,6、1,7、g,s,t、g,m的检测结果与血清凝集结果的一致性较高(Kappa值均大于0.75),而H1,5及Hi-l的检测结果与血清凝集结果的一致性很差(Kappa值分别为0.302及0.492);试剂盒对不同O/H抗原核酸检测扩增效率较好,最低检出限为7~137608拷贝/反应。结论:除H1,5抗原外,该荧光PCR检测试剂盒对沙门菌O/H抗原不同血清型的检测效果较好,优于传统血清凝集方法,可显著提高血清型鉴定时效,有利于疾病或暴发的早期发现。
沙门菌;血清型;O抗原;H抗原;荧光PCR
沙门菌是常见的引起食源性疾病的致病菌。2007年世界卫生组织的统计数据显示,全世界范围内已发现2610种血清型的沙门菌[1]。至2006年,我国也已检出近300种沙门菌血清型[2]。传统的血清型鉴定耗时较长,不利于及时进行疾病暴发时追踪传染源以及分析比较菌株间的差异。目前已有很多关于沙门菌血清型鉴定的方法学研究,如聚合酶链式反应(polymerase chain reaction,PCR)、核酸探针技术、环介导等温扩增(loop-mediated isothermal amplification,LAMP)及基因芯片技术等分子生物学方法,可对沙门菌进行较为快速的鉴定[3-5]。但是,投入使用的商品化的沙门菌血清型检测试剂盒较少,且现有的针对沙门菌血清型检测的研究,一次可以鉴定出的血清型种类有限,多集中于肠炎沙门菌、鼠伤寒沙门菌、猪霍乱沙门菌或伤寒沙门菌及副伤寒沙门菌中1种或2~3种血清型的鉴定[6-7]。天津芯片技术有限责任公司研发的沙门菌O抗原A~F不同血清群及7种常见H抗原不同血清型核酸扩增(PCR-荧光探针法)检测试剂盒(以下简称沙门O/H抗原核酸检测试剂盒)可分别同时检测7种沙门菌O抗原和7种H抗原。该试剂盒采用Taq⁃Man荧光探针技术,利用沙门菌O抗原及H抗原不同血清型特异的荧光探针与靶核酸杂交,通过荧光PCR扩增来实时判断沙门菌属O抗原及H抗原的型别。但该检测试剂盒用于沙门菌血清型的判定效果如何,尚无实验室证据。本研究中,我们利用传统血清凝集鉴定的不同血清型菌株,对该试剂盒的特异性、敏感性进行了评估,为其进一步推广应用及完善提供依据。
1 材料与方法
1.1 菌株选择
根据O抗原A~F群血清型及7种常见H抗原,随机挑选252株不同血清型菌株进行试验,包括肠炎沙门菌、山夫登堡沙门菌、甲型副伤寒沙门菌等34种血清型(表1),每种抗原测试菌株平均为18株,其中含特异性靶抗原的菌株10株、非特异性菌株8株。实验用菌株来自中国疾病预防控制中心传染病所腹泻病室,均采用API 20E试剂条及血清凝集试验进行了确认。沙门菌抗血清购自丹麦国家食品研究所并在有效期内使用。
1.2 引物信息
依据O抗原及H抗原编码基因的可变区设计引物及探针,具体引物及探针信息涉及商业机密,故在此不做详细表述。
1.3 检测方法
1.3.1 模板制备 采用热裂解法。挑取单个纯菌培养的新鲜菌落于100 μL纯水中,制成悬浊液,100℃煮沸10 min,冰浴10 min,12 000 r/min离心5 min,取上清作为反应模板,-20℃保存备用。
1.3.2 荧光PCR 采用沙门菌O抗原A~F(A、B、C1、C2、D1、E、F)不同血清型核酸扩增(PCR-荧光探针法)检测试剂盒及沙门菌H抗原7种(1,5、1,6、1,7、i-l、g,s,t、g,m、f,g)常见不同血清型核酸扩增(PCR-荧光探针法)检测试剂盒(天津芯片有限公司研发且在有效期内使用)进行荧光PCR检测,按照试剂盒说明书进行。具体包括:配制25 μL反应体系,其中模板量为1 μL,酶0.3 μL(厂家提供),反应所需引物及反应缓冲液均由厂家制备成冻干粉,使用时溶于23.7 μL超纯水中。采用CFX96荧光PCR仪(扩增条件:95℃ 2 min;95℃ 15 s,60℃ 30 s,共35个循环)。Ct值<33判为阳性结果,Ct值>35为阴性结果。如果33≤Ct值<35,则复检2次:若Ct值无,判为阴性结果;若其中至少1次Ct值<35,判为阳性结果。
1.3.3 细菌总DNA的提取及检测下限测定 每种O抗原及H抗原选取1株代表菌株,从平板上挑取单克隆,在LB液体中培养6~8 h,至D600nm值约为0.6时收集菌体,用Wizard Genomic DNA Purification Kit(Promega公司)提取细菌总DNA,严格按说明书进行。对提取的总DNA测定浓度后,进行1∶10及1∶3梯度稀释,不同浓度梯度各取1 μL作为荧光PCR检测模板,测定该试剂盒检测下限或敏感度。以模板DNA拷贝数的对数值为横坐标、相应的Ct值为纵坐标,绘制标准曲线方程。
1.4 统计分析
运用SPSS17.0软件包进行统计分析。分别计算试剂盒中7种沙门O抗原及7种沙门H抗原对沙门血清型检测结果的灵敏度、特异度、假阳性率、假阴性率,并用χ2检验、McNemar检验、Fisher精确检验进行率的比较,P<0.05时认为差异具有统计学意义;计算Kappa值以评价与血清凝集结果的一致性,本研究按照一般规则,认为Kappa值大于0.75一致程度较好,小于0.5一致程度较差。
2 结果
2.1 O/H抗原不同血清型核酸扩增效果评估
利用252株沙门菌,以血清凝集结果作为金标准,分别评估沙门O抗原及H抗原检测试剂盒对不同沙门血清型的鉴定效果(表2),其中O抗原共进行136个检测反应(含7个阳性对照及相应的空白对照),H抗原共进行162个检测反应(含7个阳性对照及相应的空白对照)。7种不同沙门菌O抗原检测的灵敏度不同,但均较高,其中C1、C2、E、F的灵敏性均高达100.00%,次之为D1群(90.91%),最低为B群(80.00%)。不同O抗原检测的特异度也不同,最低为A群(66.67%),最高为E群,达100.00%。在7种不同沙门氏菌H抗原的检测中,H1,5的灵敏度最低,仅为35.71%,次之为Hi-l相(灵敏度为57.14%),但H抗原检测的特异度均较高,特异度为87.50%~100.00%(表2)。经Fisher精确检验,除H1,5抗原检测的P>0.05(P=0.162),其余为P<0.05。O抗原C1、C2、D1、E、F群及H1,6、1,7、g,s,t、g,m的检测结果与血清凝集结果的一致性较高(Kappa值均大于0.75),但H1,5及Hi-l的检测结果与血清凝集结果的一致性很差(Kappa值分别为0.302及0.492)。
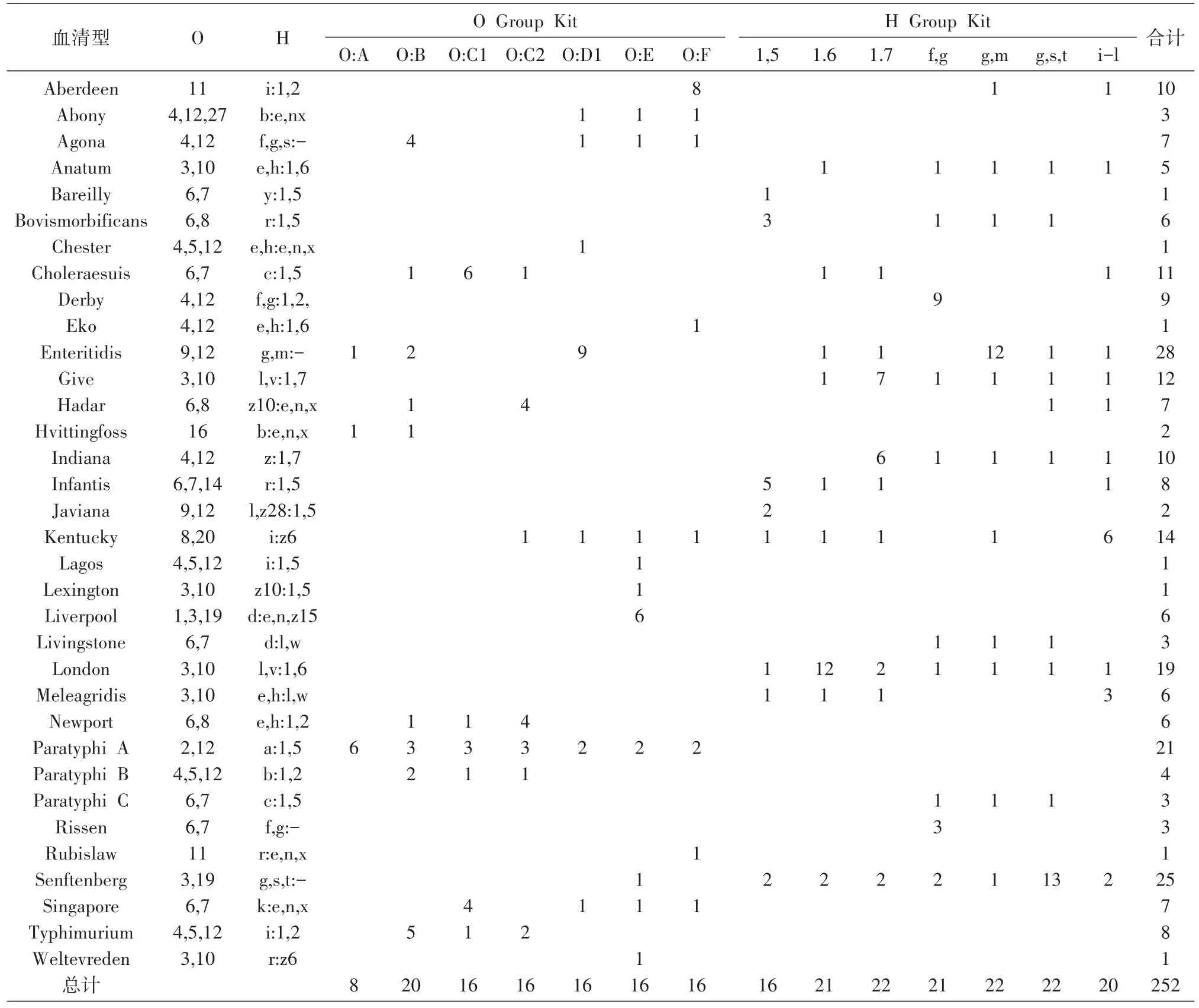
表1 实验用菌株信息
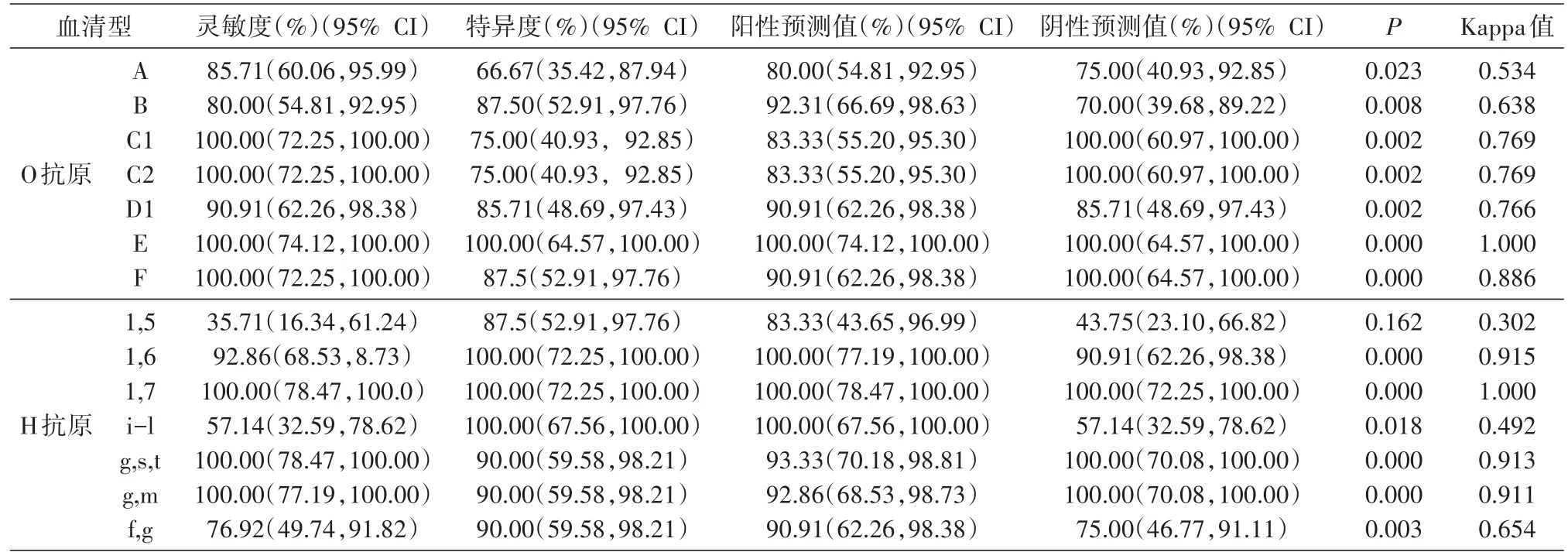
表2 沙门菌O/H抗原不同血清型核酸扩增效果评估
2.2 纯菌样本中O/H抗原核酸扩增检测下限测定
将提取的纯DNA以1∶3梯度稀释5个浓度,以此为模板检测沙门O/H抗原核酸检测试剂盒反应的敏感性。以模板DNA拷贝数的对数值为横坐标、相应的Ct值为纵坐标绘制标准曲线方程(表3)。R2值均大于0.9,说明扩增效率均较高,但针对不同抗原,其扩增效率存在差异。如沙门菌H1,6群血清型(图1)及O:B群血清型(图2)的扩增效果最好,次之为Hg,m、H1,7,Hf,g扩增效率相对最低(图谱未展示)。另外,不同O/H抗原核酸检测最低检出限亦不同(表4)。对沙门菌O:B群血清型检测的敏感性最高,最低检测下限为0.004 fg/μL,约7个拷贝/反应。其次为沙门菌O:C2、D1、E及H:i-l、g,m,检测下限平均约0.05 fg/ μL,约92个拷贝/反应。对沙门菌O:A群及Hf,g群血清型检测的敏感性较差,平均约0.05 ng/μL,约9200个拷贝/反应。

表3 纯菌样本中O/H抗原不同血清型核酸扩增标准曲线方程
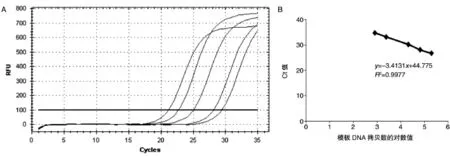
图1 沙门菌H1,6群血清型检测扩增曲线(A)及标准曲线方程(B)
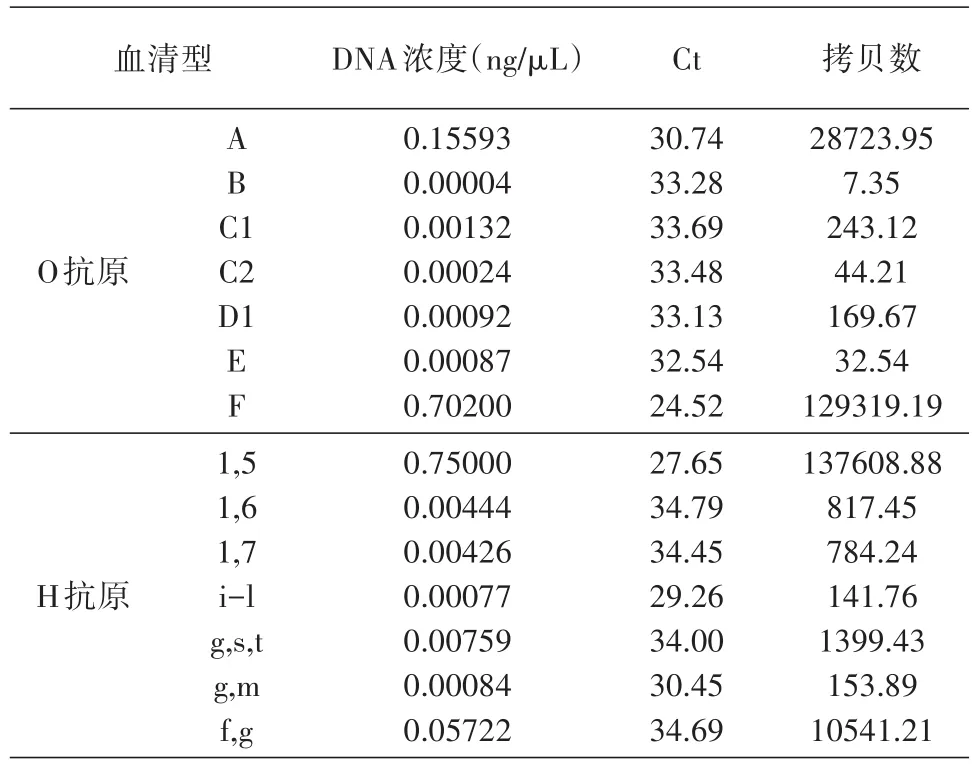
表4 纯菌样本中O/H抗原不同血清型核酸扩增最低检出限
3 讨论
O抗原和H抗原作为沙门菌的主要抗原,用于沙门菌的血清学分型。具有共同O抗原的各血清型沙门菌归为一群,再根据H抗原的差异分为不同的血清型[8]。A~F群血清型,尤其是A、B、C1、C2、D1、E、F群沙门菌为临床常见,涵盖我国前50位沙门菌血清型,其中B群的鼠伤寒、C群的猪霍乱和D群的肠炎沙门菌是引起食物中毒最常见的病原体[9]。在A~F群沙门菌中,H抗原多种多样,但其中7种(1,5、1,6、1,7、i-l、g,s,t、g,m、f,g)占全部已有A~F群沙门菌血清型的53%左右。通过引物及探针筛选,最终建立了检测7种O群(A~F群)抗原及7种H抗原的沙门菌荧光PCR试剂盒,使我们在面对沙门菌感染暴发尤其是食物中毒来源的沙门菌时,运用该试剂盒可以同时判定这些菌株所具有的O抗原及H抗原,大致了解该暴发中的优势血清型,在此基础上,辅助少量、小范围、有针对性的O、H血清因子做玻片凝集即可确定血清型,可大大节省传统血清凝集所需要的时间,有效减少血清凝集结果的不确定性及由于血清质量问题造成的血清型误判。
目前已有基于基因扩增或杂交的沙门菌分子血清分型方法及应用的报道[10-14],如Luminex公司的沙门菌分子血清分型试剂盒可检测常见的前100种血清型[13-14],但价格昂贵(每株菌的检测费用约为300元人民币),需特定的液相芯片平台(仪器昂贵),操作过程相对复杂。结合我国临床及疾病控制系统实验室硬件实际条件,在已知基因及PCR设备易得的基础上,荧光PCR不失为一种首选的理想检测方法。利用TaqMan探针法,以沙门菌O/H抗原核酸为靶标,在国内及国际上建立沙门菌常见抗原或血清型的实时荧光PCR检测方法,相对于采用荧光染料SYBR Green等的方法,避免了引物二聚体和其他非目标DNA扩增并与染料相结合引起非特异信号的现象,提高了实验的特异性、敏感性[15]。
本研究中,沙门菌O/H抗原核酸检测试剂盒对不同抗原的检测灵敏度不一致。对O抗原的检测灵敏度均超过85%,其中C1、C2、E及F达100%。但检出O抗原的特异度较H抗原低,表明其假阳性结果较多,可能与引物设计或操作过程中的细微污染有关[16]。该试剂盒对H抗原的灵敏度稍差,检出1,5项的灵敏度仅35.71%,可能与1, 5是H抗原的非特异项,目前针对该抗原的特异性基因研究较少,本试剂盒所设计的引物特异性可能不够理想等有关,有待改善引物及探针序列,扩大样本量做进一步研究。另外,分子生物学方法在检测准确性方面也存在一定的误差,与其他方法的联用是未来发展方向[17]。

图2 沙门菌O:B群血清型检测扩增曲线(A)及标准曲线方程(B)
沙门菌O/H抗原核酸检测试剂盒对O抗原的敏感性总体强于对H抗原的检测,尤其对B群的O抗原,低于10拷贝/反应即可检出。其他几种抗原检测敏感性尚可,检测下限为102~104拷贝/反应,对A群O抗原及H抗原f,g项的检测敏感性差,检测下限为105拷贝/反应。虽然不及程苏云[18]等所建方法的最低检测限为7.1×10-2拷贝/μL的敏感程度,但考虑该试剂盒检测的主要目的在于定性,一般水煮模板或纯菌提取DNA的浓度远高于该检测下限,故不能单纯以检测敏感性不高而否定该试剂盒的检测效果。
总之,本研究结果表明,国内率先建立的基于抗原编码基因的沙门菌分子血清分型-沙门菌常见O及H抗原荧光PCR检测试剂盒除对H抗原1,5项检测效果不理想外,对其他几种O/H抗原检测结果尚可,与血清凝集鉴定结果的一致性较高,结合其他确证手段,可初步试用于沙门菌纯菌实验室血清分型。
[1]Guibourdenche M,Roggentin P,Mikoleit M,et al.Sup⁃plement 2003-2007(No.47)to the White-Kauffmann-Le Minor scheme[J].Res Microbiol,2010,161(1):26-29.
[2]张燕,朱超.我国沙门氏菌病和菌型分布概况[J].现代预防医学,2002,29(03):400-401.
[3]Alves J,Marques V V,Pereira L F P,et al.Multi⁃plex pcr for the detection of campylobacter,spp.and salmonella,spp.in chicken meat[J].JFood Safety, 2012,32(3):345-350.
[4]Machado A,Almeida C,Carvalho A,et al.Fluores⁃cence in situ,hybridization method using a peptide nucleic acid probe for identification of Lactobacillus, spp.in milk samples[J].Int J Food Microbiol,2013, 162(1):64-70.
[5]万进,张璐,曹兴元.环介导等温扩增技术对牛奶中沙门氏菌快速检测的研究[J].农产品质量与安全,2012, (S1):71-75.
[6]袁慕云,刘二龙,谢力,等.基于TaqMan探针三重荧光PCR检测沙门菌、肠炎沙门菌和鼠伤寒沙门菌[J].中国预防医学杂志,2015,(10):774-780.
[7]Barco L,Lettini A A,Ramon E,et al.A rapid and sensitive method to identify and differentiate Salmonel⁃la enterica serotype Typhimurium and Salmonella en⁃terica serotype 4,[5],12:i:-by combining traditional se⁃rotyping and multiplex polymerase chain reaction.[J]. Foodborne Pathogens Dis,2011,8(6):741-743.
[8]曹际娟.食品微生物学与现代检测技术[M].大连:辽宁师范大学出版社,2006:150-179.
[9]王云华,龙丽坤,蔡先全,等.实时荧光PCR方法检测水产品中沙门菌[J].中国国境卫生检疫杂志,2008,31 (2):125-127.
[10]Guo D,Liu B,Liu F,et al.Development of a DNA microarray for molecular identification of all 46 Salmo⁃nella O serogroups[J].Appl Environ Microbiol,2013,79 (11):3392-3399.
[11]McQuiston J R,Waters R J,Dinsmore B A,et al.Mo⁃lecular determination of H antigens of Salmonella by use of a microsphere-based liquid array[J].J Clin Mi⁃crobiol,2011,49(2):565-573.
[12]Fitzgerald C,Collins M,van Duyne S,et al.Multi⁃plex,bead-based suspension array for molecular deter⁃mination of common Salmonella serogroups[J].J Clin Microbiol,2007,45(10):3323-3334.
[13]Dunbar S A,Ritchie V B,Hoffmeyer M R,et al.Lu⁃minex multiplex bead suspension arrays for the detec⁃tion and serotyping of Salmonella spp[J].Methods Mol Biol,2015,(1225):1-27.
[14]Liang D W,Lu J H,Wu Q,et al.Comparing the ability of luminex xMAP salmonella serotyping assay and traditional serotyping method for serotyping salmo⁃nella isolated from southern Chinese population[J].J Appl Microbiolm 2016,120(6):1668-1676.
[15]Kubista M,Andrade J M,Bengtsson M,et al.The re⁃al-time polymerase chain reaction[J].MolAspects Med,2006,27(2-3):95-125.
[16]黄弦,江晓玲,贺小峰,等.三种副溶血性弧菌分子检测试剂盒的评价[J].热带医学杂志,2011,11(3):288-290.
[17]沈兰,王锐萍,史海涛,等.PCR技术在快速检测沙门氏菌中的应用[J].基因组学与应用生物学,2012,31(1): 90-94.
[18]程苏云,梅玲玲,朱敏,等.沙门菌TanqMan-MGB探针实时荧光PCR检测技术研究[J].中国卫生检验杂志, 2009,(6):1320-1323.
Assessment of Fluorescent PCR Assay for Detecting Gomi⁃nant O/H Serogroups of Salmonella
CAO Yang,HAN Ying-Ying,LI Jie,KAN Biao,YAN Mei-Ying*
National Institute for Communicable Disease Prevention and Control,Chinese Center for Disease Control and Pre⁃vention,Beijing 102206,China
Objective:To evaluate the efficiency of fluorescent PCR assays for detecting main Salmonella sero⁃groups.Methods:Different serotypes of Salmonella were purified and detected by fluorescent PCR assays using dif⁃ferent O&H antigens detection kits.The specificity,sensitivity,lower limit of detection,positive and negative pre⁃dicted values,and Kappa value for different O&H antigens were calculated,and evaluated by the gold standard se⁃rum agglutination test.Results:The results showed that the sensitivity of 7 groups of O antigens ranged from 85.71%to 100.00%and the specificity ranged from 66.67%to 100.00%.The higher specificity was found for the detection of 7 groups of H antigens(87.50%~100.00%).However,the sensitivity of H1,5 and Hi-l were lower with 35.71%and 57.14%,respectively.The H antigen assay exhibited a high consistency with serum agglutination test,except the detection of H1,5 and Hi-l(Kappa=0.302 and 0.492,respectively).The amplification efficiency of different O/H antigens was high,and the lower limit of detection ranged from 7~137608 copies per action.Conclu⁃sion:Except for detecting H1,5,the assay of O&H antigens using fluorescent PCR has a better performance com⁃pared with traditional serotyping method for distinguishing different serogroups of Salmonella,especially at the as⁃pect of time saving,and it will be useful for early detection of Salmonella infection or outbreaks.
Salmonella;serotype;O antigens;H antigens;Taqman PCR
R392.1;Q78
A
1009-0002(2017)02-0084-06
10.3969/j.issn.1009-0002.2017.02.003
2016-10-26
国家科技重大专项(2013ZX10004216);国家重点基础研究发展计划(2013CB127204)
曹阳(1990-),女,硕士研究生
闫梅英,(E-mail)yanmeiying@icdc.cn
*Corresponding anthor,E-mail:yanmeiying@icdc.cn

