人Six1基因促进肺腺癌细胞A549的增殖
陈思禹,李玲,晋帅,洪甜,黄俊,尤文叶,韩笑,崔越,叶棋浓,王钰琦
1.解放军总医院,北京 100853;2.军事医学科学院 生物工程研究所,北京 100850;3.军事医学科学院 附属医院,北京 100071;4.锦州医科大学,辽宁 锦州 121000;5.首都师范大学,北京 100048
人Six1基因促进肺腺癌细胞A549的增殖
陈思禹1,李玲2,晋帅1,洪甜2,黄俊3,尤文叶1,韩笑4,崔越5,叶棋浓2,王钰琦1
1.解放军总医院,北京 100853;2.军事医学科学院 生物工程研究所,北京 100850;3.军事医学科学院 附属医院,北京 100071;4.锦州医科大学,辽宁 锦州 121000;5.首都师范大学,北京 100048
目的:构建带有Flag标签的Six1基因的慢病毒表达载体,并对表达产物Flag-Six1的生物学功能进行初步鉴定。方法:以实验室构建的真核表达载体myc-Six1为模板,根据实验需求合成引物,经PCR扩增,酶切后插入pCDHFlag载体,Western印迹检测其在人293T细胞中的表达;经Western印迹鉴定无误后,与3个包装质粒共转染293T细胞,包装成慢病毒后感染人肺癌细胞A549,经嘌呤霉素筛选2周,收集部分细胞,用Western印迹验证蛋白水平的表达,并通过细胞生长实验检测Six1对A549细胞生长的影响;提取RNA,通过qRT-PCR检测细胞中血管内皮细胞生长因子C(VEGF-C)在mRNA水平的变化。结果:构建的慢病毒表达载体pCDH-Flag-Six1能够在293T细胞中正确表达;包装成慢病毒,感染肺癌细胞A549后可正常表达;生长曲线表明Flag-Six1可促进人肺癌细胞A549的繁殖;qRTPCR结果表明Six1可升高肺癌细胞A549的VEGF-C转录水平。结论:构建了带pCDH-Flag标签的人Six1基因慢病毒表达载体,Flag-Six1能够在肺癌细胞系A549中表达,并能促进细胞增殖,这为进一步研究Six1的生物学功能奠定了重要基础。
人Six1基因;慢病毒表达载体;生物学功能
Six1(sineoculis homeobox homolog 1)是一种转录调控因子,在多种肿瘤中发挥着重要作用[1-4]。Six1是由一个高度保守的同源异型结构域(homeodomain,HD,61个氨基酸残基)和Six结构域(Six domain,SD,110~115个氨基酸残基)组成的复合结构,其编码基因位于人染色体14q23上。该结构与DNA结合的特异性决定了其靶基因的特异性,为脑、耳、眼、肌肉和肾等多种器官发育所必需[5-7]。当Six1调控异常时,不但使胚胎发育和组织器官出现异常形态结构、胚胎死亡,而且在肿瘤发生和转移中发挥关键作用[8]。研究表明,Six1可以通过升高血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)的水平来促进肿瘤淋巴管的形成及淋巴转移[9]。目前,对Six1的研究越来越多,尤其是在肺癌中,Six1的表达促进了癌周及癌内的淋巴管形成、淋巴入侵以及肺癌细胞的远端转移[10]。我们拟构建Six1基因的慢病毒表达载体,并验证其升高VEGF-C水平的功能,为进一步探讨Six1与肺癌的关系奠定基础。
1 材料和方法
1.1 材料
pCDH-Flag载体为本室保存,经NotⅠ/BamHⅠ双酶切得到所需载体;人胚肾293T细胞、人肺癌A549细胞均为本室保存;限制性内切酶、PCR试剂、DNA连接酶购自宝生物工程(大连)有限公司;PCR所用引物由北京赛百盛生物技术有限公司合成;转染试剂VigoFect购自威格拉斯生物技术有限公司;细胞培养基DMEM购自上海玉博生物科技有限公司(Gibco);胎牛血清购自浙江天航生物科技有限公司;质粒提取、PCR产物回收,酶切产物回收等试剂盒购自普洛麦格(北京)生物技术有限公司(Promega);质粒测序由北京奥科生物技术有限责任公司完成。
1.2 pCDH-Flag-Six1重组质粒的构建与测序
以myc-Six1(本实验室保存)为模板,根据已知的Six1的编码序列设计5'-CCCAAGCTTATGTC⁃GATGCTGCCGTCGTTTGGC-3'和5'-CCCAAGC TTCGATGTCGATGCTGCCGTCGTTTGGC-3'。目的基因Six1的PCR扩增条件:预变性(95℃/5 min),变性(95℃/30 s),退火(62℃/30 s),延伸(72℃/ 60 s),共34个循环,再延伸(72℃/7 min)。PCR产物经琼脂糖凝胶电泳检测,胶回收目的条带,与载体pCDH-Flag均分别用NotⅠ和BamHⅠ酶切,回收酶切产物,用T4DNA连接酶将载体pCDH-Flag与目的条带于16℃连接5 h以上,连接产物转化感受态大肠杆菌DH5α,涂布含氨苄西林的LB琼脂板上培养,待单克隆形成肉眼可见的菌落时,将单克隆接种于含氨苄西林的液体LB培养基中,37℃、200 r/min培养12 h,所得菌液用于质粒提取,并经双酶切鉴定,酶切阳性克隆进行测序。
1.3 Western印迹验证Flag-Six1的表达
接种293T细胞于6 cm皿中,37℃培养24 h,将酶切阳性的质粒转染293T细胞,转染前1 h换液,此时细胞密度约为80%为宜。根据VigoFect转染试剂剂量要求,6 cm皿VigoFect用量为4 μL,将4 μL VigoFect加入200 μL NaCl中,混匀,静置5 min,此间将10 μg质粒与NaCl混合,用NaCl补足至200 μL,移液器吹吸数次混匀,最后将上述2种溶液混合,静置15 min,同时转染空质粒pCDH-Flag,将混合液加入293T细胞,于37℃、50 mL/L CO2常规培养箱中培养,6~8 h换液;24 h后3000 r/min离心5 min收集细胞,去上清,加等量的细胞裂解液,吹匀,冰上裂解30min,再加入等量的1×SDS上样缓冲液,沸水煮样15 min,12 000 r/min离心2 min,取上清进行聚丙烯酰胺凝胶电泳,电泳结束后,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭1 h,用Flag-HRP和tubulin抗体(1∶1000)室温孵育2 h,TBST洗膜3次,每次5 min,用化学发光法显色5 min,压片显影。
1.4 稳定克隆的筛选及表达水平鉴定
将293T细胞接种于6孔板,转染前1 h换液,此时细胞密度约为80%为宜,将3种包装质粒即0.84 μg PLP1、0.4 μg PLP2及0.56 μg VSVG分别与1 μg构建的重组质粒pCDH-Flag-Six1和对照病毒pCDH-Flag振荡混匀于200 μL不含血清双抗的DMEM中,分别加入10 μL Megatran1.0转染试剂,立即涡旋混匀。室温静置10 min后将上述混合物轻轻滴加到已接种293T细胞的培养基中,3~4 h换液,48~72 h后收集上清,4℃、3000 r/ min离心10 min,弃去细胞碎片,取上清,-80℃保存。将300 μL上述病毒上清滴加至已经准备的密度约为70%的A549细胞中,24 h后更换为含10%胎牛血清的新鲜培养基。感染48 h后,将细胞消化至6 cm或10 cm培养皿中,待长满时将10 μg/mL的嘌呤霉素按1∶1000加入上述培养基中进行筛选,待大部分细胞死亡后更换为新鲜培养基继续培养至形成单个抗性集落,并增加上述嘌呤霉素的含量继续筛选,待细胞数量不再减少时得到稳定的混合克隆。3000 r/min离心5 min收集pCDH-Flag-Six1和对照病毒pCDH-Flag感染后的肺癌A549细胞,去上清,加3倍体积的RI⁃PA,吹匀,冰上裂解30 min,再加入等量的1×SDS上样缓冲液,沸水煮样15 min,12 000 r/min离心2 min,取上清进行聚丙烯酰胺凝胶电泳,电泳结束后,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭1 h,用Flag-HRP和tubulin抗体(1∶1000)室温孵育2 h,TBST洗膜3次,每次5 min,用化学发光法显色5 min,压片显影。
1.5 Six1基因对肺癌细胞A549增殖的影响
用DEME将上述筛选出的稳定混合克隆A549细胞收集入EP管,10 μL测密度,计算体积,配制成每孔3000细胞的培养基100 μL,共10份,分置于96孔板,每日2孔,于温箱中保存。待细胞贴壁后吸走原96孔板内上清液,加入Cell Counting Kit 8试剂100 μL,于保温箱内放置1 h后,测定D450nm值。
1.6 总RNA的提取
接种A549细胞于6 cm皿中,用上述方法转染pCDH-Flag空载体与重组质粒,培养24 h后收集细胞,3000 r/min离心5 min;用1 mL 1×PBS洗1次,加入1 mL TRIzol,用移液器吹打均匀,室温静置5 min裂解细胞;加入200 μL氯仿,吹匀,室温静置3 min;4℃、12 000 r/min离心15 min,取上清至新EP管中,加入等体积异丙醇,混匀,于-80℃放置10 min;取出后于4℃、12 000 r/min离心10 min;取上清,加入用DEPC水稀释的75%乙醇溶液1 mL,上下颠倒数次,10 000 r/min离心5 min;弃上清,加入无水乙醇1 mL,混匀,10 000 r/min离心5 min;取上清,自然风干,加入40 μL DEPC水溶解RNA;测浓度,-20℃保存。
1.7 qRT-PCR检测
采用提取的RNA进行反转录。反转录体系包括模板(即上步所得RNA)总量2 μg、oligo(dT)1 μL,用DEPC水补足至15.9 μL。短暂离心后,于70℃金属浴中解链5 min,立即冰浴;分别加入酶反应体系(M-MLV 5×缓冲液5 μL,10 mmol/ L dNTPs 2.5 μL,RNase抑制剂0.6 μL,M-MLV 1.0 μL),于42℃金属浴1 h,95℃金属浴5 min,即得到cDNA。将得到的cDNA稀释至500 μL,即可用于qRT-PCR;所得结果按2-ΔΔCt公式计算出基因的相对表达量。
2 结果
2.1 pCDH-Flag-Six1重组质粒的构建与鉴定
以本室原有的myc-Six1为模板扩增Six1基因,得到约855 bp的目的片段(图1),与人Six1基因的大小相符。回收此PCR产物,经NotⅠ和BamHⅠ双酶切,与载体pCDH-Flag(经同样双酶切)于16℃连接5 h以上,连接产物转化感受态大肠杆菌DH5α,于氨苄西林LB琼脂培养基中培养后挑取单克隆,37℃培养2 h,进行菌液PCR(以myc-Six1为阳性对照,去离子水为阴性对照),在855 bp左右有特异条带,初步说明此克隆为阳性克隆(图2)。选取阳性克隆,提取质粒并经双酶切,酶切产物与空载体经琼脂糖凝胶电泳,阳性克隆出现2000 bp以上和约855 bp的2条带,空载体则仅有较大带型(图3)。进而将酶切阳性的克隆进行测序,结果表明插入片段的DNA序列与人Six1基因的编码序列是一致的(数据略)。
2.2 Western印迹检测Flag-Six1在293T细胞中的表达
为了验证pCDH-Flag-Six1能否在细胞中正确表达,我们将构建的pCDH-Flag-Six1质粒和pCDH-Flag空载体分别转染293T细胞,24 h后收集细胞蛋白,进行Western印迹检测。结果显示,转染pCDH-Flag-Six1质粒后在相对分子质量35× 103~40×103间检出条带,而转染空载体后未在此处检出条带(图4)。说明构建的pCDH-Flag-Six1能在293T细胞中正确表达。

图1 PCR扩增人Six1的编码序列

图2 菌液PCR

图3 重组质粒pCDH-Flag-Six1的NotⅠ/BamHⅠ双酶切电泳图谱
2.3 Western印迹检测Flag-Six1在A549细胞中的表达
为了验证pCDH-Flag-Six1能否通过感染在肺癌A549细胞中表达,分别收集由pCDH-Flag-Six1和pCDH-Flag包装成的病毒感染的肺癌A549细胞蛋白进行Western印迹,检测Six1蛋白的表达情况。结果表明,实验组与对照组的tubulin表达没有明显差异,而pCDH-Flag-Six1感染组的蛋白表达水平明显升高(图5)。说明构建的pCDHFlag-Six1可感染A549细胞并表达。
2.4 pCDH-Flag-Six1在mRNA水平升高VEGF-C
为验证pCDH-Flag-Six1慢病毒表达载体的功能,分别收集上述感染的肺癌A549细胞,提取总RNA,反转录后进行 qRT-PCR。结果表明,pCDH-Flag-Six1可明显升高VEGF-C的mRNA水平(图6),与文献报道一致[11],进一步证明pCDH-Flag-Six1表达载体构建成功,可用于后期研究。

图4 Western印迹检测pCDH-Flag-Six1在293T细胞中的表达

图5 Western印迹检测pCDH-Flag-Six1在A549细胞中的表达
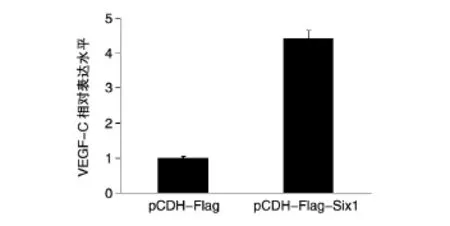
图6 qRT-PCR检测pCDH-Flag-Six1对VEGF-C的影响
2.5 pCDH-Flag-Six1转染A549细胞生长曲线变化
为进一步验证pCDH-Flag-Six1慢病毒表达载体的功能,分别收集上述感染的肺癌A549细胞,铺于96孔板,待细胞贴壁后,连续5 d于同一时间用Cell Counting Kit 8测定D450nm值,绘制生长曲线。结果表明,Six1基因可促进A549细胞的增殖(图7)。

图7 生长曲线验证Six1基因的作用
3 讨论
转录调控因子Six1是同源盒基因的一种,它在细胞增殖、分化、凋亡、形态、黏附和迁移等生命活动中起关键作用[12]。早有研究显示,Six1不仅参与胚胎细胞的发育和器官分化,调控细胞周期进程,还可调节癌细胞启动和转移,在肿瘤发生、发展中发挥重要作用。事实上,已有研究表明Six1基因的异常表达与肺癌的增殖和迁移密切相关[13],因而成为肿瘤学领域的研究热点。
近年来,肺癌已成为我国发病率最高的恶性肿瘤,死亡率居高不下。找出肺癌的发病机理,已迫在眉睫。有研究发现,早期肺癌常发生淋巴结转移现象,肺癌分期和临床治疗方案选择的关键是根据有无淋巴结转移以及淋巴结受累的程度,这也是临床评估肺癌患者病情及预后的重要指标[14]。因此,研究肺癌淋巴结转移机制,对于治疗肺癌具有重要意义。研究表明,VEGF-C能够调节肿瘤血管的生成,促进肿瘤细胞进入淋巴管并通过淋巴系统转移至全身。VEGF-C是VEGF家族的新成员,在本研究中发现Six1基因能够引起VEGF-C的转录,这对淋巴管生成及淋巴转移也是必需的。
本实验构建了慢病毒表达载体pCDH-Flag-Six1,通过qRT-PCR证明了Six1能在mRNA水平升高VEGF-C,并且验证了它可以促进肺癌细胞系A549的增殖,这为进一步研究Six1基因的功能,及其与VEGF-C、肺癌发生和转移等的关系奠定了理论基础。
[1]刘超.BEZ235体外抑制肝癌HepG2细胞的分子机制以及Sixl蛋白过表达与肝癌生物学特点的关系[D].延吉:延边大学,2013.
[2]Behbakht K,Qamar L,Aldridge C S,et al.Six1 over⁃expressionin ovarian carcinoma causes resistance to TRAIL-mediated apoptosisand is associated with poor⁃survival[J].Cancer Res,2007,67(7):3036-3042.
[3]Ng K T,Man K,Sun C K,et al.Clinicopathological significanceof homeoprotein Six1 in hepatocellular car⁃cinoma[J].Br J Cancer,2006,95(8):1050-1055.
[4]Wan F,Miao X,Quraishi I,et al.Gene expression changes duringHPV-mediated carcinogenesis:a compar⁃ison between an invitro cell model and cervical cancer [J].Int J Cancer,2008,123(1):32-40.
[5]Ozaki H,Nakamura K,Funahashi J,et al.Sixl con⁃trols patterning of the mouse oticvesicle[J].Develop⁃ment,2004,131(3):551-562.
[6]Zou D,Silvius D,Fritzsch B,et al.Sixl are essential for early steps of sensory neurogenesis in mammalian cranial placodes[J].Development,2004,131(22):5561-5572.
[7]Konishi Y,Ikeda K,Iwakura Y,et al.Sixl and Six4 promote survival of sensory neurons during early tri⁃geminal gangliogenesis[J].Brain Res,2006,1116(1):93-102.
[8]Li C M,Guo M,Borczuk A,et al.Gene expression in Wilms'tumor mimics the earliest committed stage in the metanephric mesenchymal-epithelial transition [J].Am J Pathol,2002,160(6):2181-2190.
[9]Wang C A,Jedlicka P,Patrick A N,et al.SIX1 in⁃duces lymphangiogenesis and metastasis via upregula⁃tion of VEGF-C in mouse models of breast cancer[J]. Clin Invest,2012,122(5):1895-1906.
[10]李淑月,徐小洁,韩聚强,等.人Six1基因慢病毒表达载体的构建及其生物学功能研究[J].生物技术通讯, 2014,25(1):17-20.
[11]常超,王平,李琳,等.非小细胞肺癌VEGF-C、VEGFD、VEGFR-3表达与淋巴管生成和淋巴转移关系的研究[J].南京医科大学学报(自然科学版),2009,29(8):1077-1084.
[12]Pearson J C,Lemons D,McGinnis W.Modulating Hox gene functions during animal body patterning[J].Nat Rev Genet,2005,6(12):893-904.
[13]Xia Y,Zhu Y,Ma T.miR-204 functions as a tumor suppressor by regulating SIX1 in NSCLC[J].FEBS Lett,2014,588(20):3703-3712.
[14]Liu J,Liu C,Qiu L.Overexpression of both plateletderived growth factor-BB and vascular endothelial growth factor-C and its association with lymphangio⁃genesis in primary human non-small cell lung cancer [J].Diagn Pathol,2014,9:128.
Human Six1 Gene Promotes the Proliferation of Lung Can⁃cer Cell A549 Lines
CHEN Si-Yu1,LI Ling2,JIN Shuai1,HONG Tian2,HUANG Jun3, YOU Wen-Ye1,HAN Xiao4,CUI Yue5,YE Qi-Nong2*,WANG Yu-Qi1*
1.PLA General Hospital,Beijing 100089;2.Beijing Institute of Biotechnology,Beijing 100850;3.Affiliated Hospi⁃tal of Academy of Military Medical Sciences,Beijing 100071;4.Jinzhou Medical University,Jinzhou 121000;5. Capital Normal University,Beijing 100048;China
Objective:To construct the lentiviral vector of human Six1 labeled with CDH-Flag and preliminary detect the biological function of the expression product CDH-Flag-Six1.Methods:Human Six1 gene was obtained from myc-Six1 plasmid by PCR and cloned into pCDH-Flag vector.In the human kidney 293T cells,the expres⁃sion of the constructed pCDH-Flag-Six1 was identified by Western blotting.The recombinant plasmid pCDH-Flag-Six1 was co-transfected with three package plasmids into 293T cells,and then the supernatant containing lentivi⁃rus infected lung cancer A549 cell lines.After two weeks of puromycin screening,stable A549 cell lines were har⁃vested and subjected to Western blotting,growth curve experiment and qRT-PCR to identify Six1 expression,exam⁃ine growth condition,and mRNA level of VEGF-C respectively.Results:The growth curve showed Six1 overex⁃pressing A549 cell lines accelerated proliferation.The qRT-PCR showed human Six1 gene could up-regulate the VEGF-C mRNA expression in lung cancer A549 cells.Conclusion:The lentiviral vector of pCDH-Flag-Six1 has been constructed and the CDH-Flag-Six1 protein promotes the proliferation and regulates VEGF-C expression, which has laid foundation for the further study on the function of Six1.
human Six1 gene;lentiviral vector;biological function
Q78;Q25
A
1009-0002(2017)02-0096-05
10.3969/j.issn.1009-0002.2017.02.005
2016-11-10
国家自然科学基金(81472589)
陈思禹(1991-),男,硕士研究生;李玲(1991-),女,博士研究生;二者同为第一作者
王钰琦,(E-mail)wyq301@qq.com;叶棋浓,(E-mail)yeqn66@yahoo.com
*Co-corresponding anthors,WANG Yu-Qi,E-mail:wyq301@qq.com;YE Qi-Nong,E-mail:yeqn66@yahoo.com

