原发性肝癌组织中Snail、Claudin-3蛋白的表达变化及意义
鲁斌,俞广进,程敏
(1安徽医科大学附属巢湖医院,合肥 238000;2安徽医科大学第一附属医院)
我国是原发性肝癌高发的国家,每年新发病例约40万人,约占全球新确诊病例的一半左右,死亡人数超过30万,病死率高居第二位[1]。即使患者接受了外科手术、其他抗肿瘤手段结合的综合治疗方案,仍无法有效防止复发,直径5 cm以下的原发性肝癌患者术后3年的复发率超过50%[2]。上皮细胞-间充质转化(EMT)是指特定情况下上皮细胞转化为具有间质表型细胞的生物学过程,一般认为能使上皮细胞来源的恶性肿瘤细胞获得并增强迁移和侵袭能力[3]。锌指转录因子(Snail)、紧密连接蛋白(Claudin)-3是EMT相关的两种基因,在肝癌中的研究报道较少。2013年1月~2018年3月,我们观察了原发性肝癌组织中Snail、Claudin-3蛋白的表达,并探讨其意义。
1 资料与方法
1.1 临床资料 选取2013年1月~2016年6月安徽医科大学附属巢湖医院肝胆外科、安徽医科大学第一附属医院肝胆胰一病区行肝叶切除、肝段切除术的原发性肝细胞癌患者85例,男71例、女14例,年龄<65岁41例,65岁以上44例。均经病理科确诊为原发性肝癌,其中肿瘤直径<5 cm 70例,≥5 cm 15例;TNM分期Ⅰ期4例,Ⅱ期51例,Ⅲ期30例;肿瘤微血管侵袭58例;肝硬化31例。纳入标准:①经病理科确诊为原发性肝癌;②患者病历、随访资料完整,组织蜡块标本保存完好;③未合并其他恶性肿瘤;③未合并其他影响免疫组化结果的严重疾病。手术中于肿瘤病灶中心切取肝癌组织,另切取相应距离肿瘤边缘5 cm以上非肿瘤组织中癌旁组织作为对照。本研究经医学伦理委员会批准,患者及家属知情同意并签署知情同意书。
1.2 不同肝组织中Snail、Claudin-3蛋白表达检测 采用免疫组化法。将石蜡标本以4 μm间隔连续切片,常规脱蜡、水化。以3%H2O2浸泡孵育15 min,PBS冲洗3×3 min。在枸橼酸缓冲液中,于高温高压修复抗原约90 s,冷却后,PBS冲洗3×3 min。滴加5%牛血清白蛋白封闭液,室温放置20 min。滴加一抗(鼠抗人Snail单克隆抗体、鼠抗人Claudin-3单克隆抗体,均购自美国Santa Cruz公司),4 ℃孵育过夜,PBS冲洗3×3 min。滴加二抗(羊抗鼠IgG抗体,赛默飞世尔科技公司),室温孵育30 min,PBS冲洗3×3 min。滴加链霉亲和素-生物素复合物,室温反应20 min,PBS冲洗3×3 min。DAB显色,苏木素复染。梯度乙醇脱水,常规装片、封片。
Snail蛋白染色主要定位于细胞膜,亦可见于胞质,Claudin-3蛋白染色定位于细胞质。取400倍光学高倍镜(×400)下4个视野,每个视野至少含有100个细胞。染色结果判定分为两步:①染色强度计分:无染色计0分,淡黄色计1分,黄色至黄棕色计2分,褐色计3分;②染色数目计分:染色细胞<5%计0分,5%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。各视野染色评分为强度计分×数目计分,最终结果取各视野评分的算术平均数,≤2分为表达阴性,>2分则为表达阳性。
1.3 随访 以患者术后出院为观察起点,应用电话、电子通讯等手段,对患者及家属进行随访。随访截止于2018年3月,随访时间9~66(30.76±14.77)个月,中位随访时间为28个月。
1.4 统计学方法 采用SPSS22.0统计软件。计量资料组间比较采用t检验,计数资料组间比较采用χ2检验,相关性检验采用Spearman等级检验。患者预后评估应用Kaplan-Meier生存曲线法。P<0.05为差异有统计学意义。
2 结果
2.1 不同肝组织中Snail、Claudin-3蛋白表达比较 肝癌、癌旁组织中Snail蛋白阳性表达率分别为69.41%(59/85)、36.47%(31/85),Claudin-3蛋白阳性表达率分别为47.06%(40/85)、78.82%(40/85),二者比较,差异均有统计学意义(χ2分别为18.511、18.385,P均=0.000)。
2.2 肝癌组织中Snail、Claudin-3蛋白表达与患者临床病理特征的关系 肝癌组织中Snail、Claudin-3蛋白表达与患者TNM分期、微血管侵袭相关(P均<0.05),与患者年龄、性别、肿瘤大小、肝硬化无关(P均>0.05)。
2.3 肝癌组织中Snail与Claudin-3蛋白表达的关系 肝癌组织中Snail、Claudin-3蛋白表达均阴性3例,均阳性17例,Snail表达阳性、Claudin-3表达阴性42例,Snail表达阴性、Claudin-3表达阳性23例,Spearman等级检验结果显示,肝癌组织中Snail与Claudin-3蛋白表达呈负相关(r=-0.551,P=0.000)。
2.4 肝癌组织中Snail蛋白表达与患者预后的关系 肝癌组织中Snail表达阴性与阳性者Kaplan-Meier生存曲线见图1。肝癌组织中Snail蛋白表达阴性者术后生存率为42.31%(11/26),术后生存时间为(40.75±3.44)个月;肝癌组织中Snail蛋白表达阳性者术后生存率为20.34%(12/59),术后生存时间为(31.12±2.19)个月,肝癌组织中Snail蛋白表达阴性者术后生存率高于、生存时间长于表达阳性者(t=15.556,P=0.000;χ2=4.413,P=0.036)。
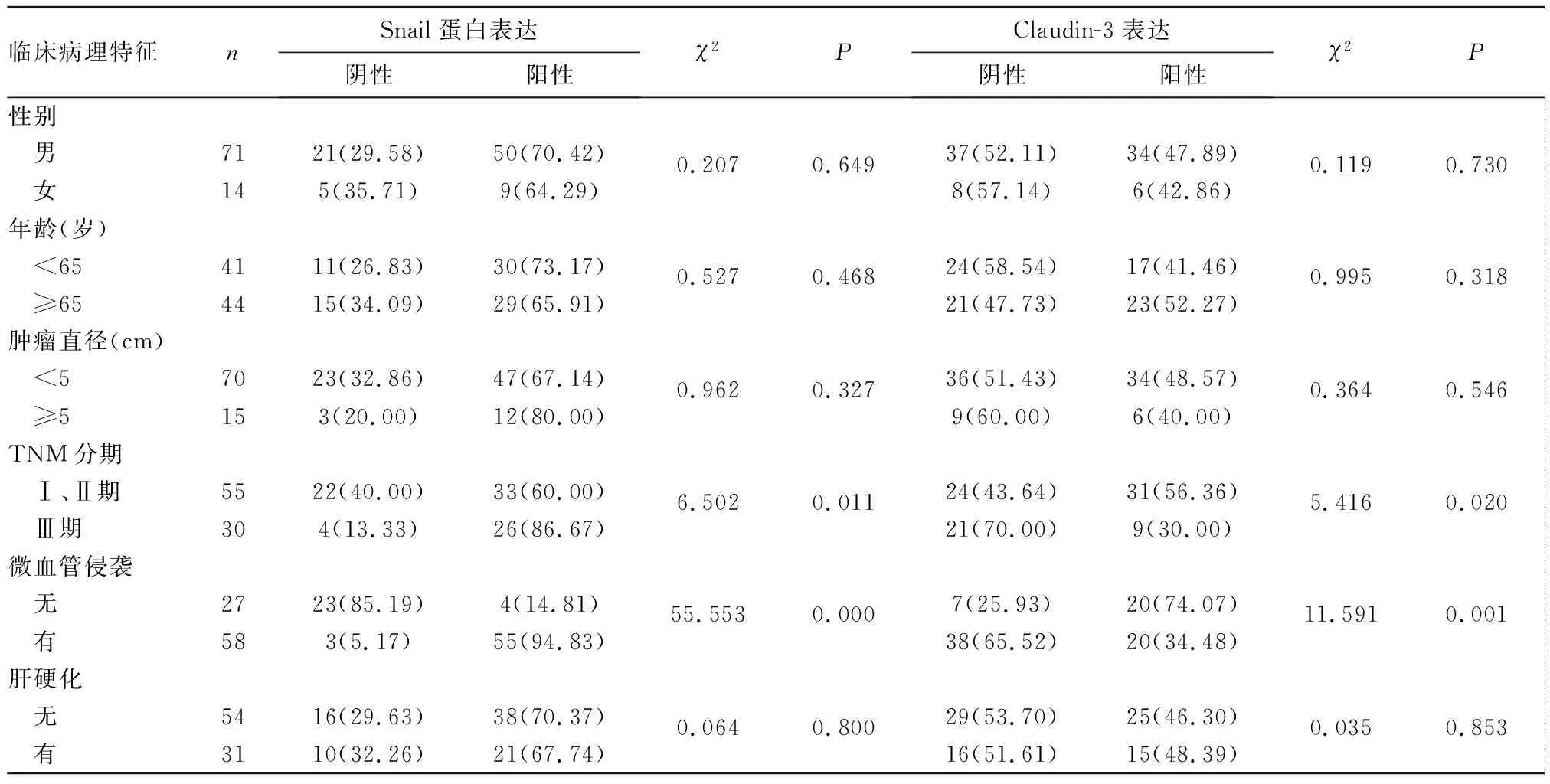
表1 肝癌组织中Snail、Claudin-3蛋白表达与患者临床病理特征的关系[例(%)]
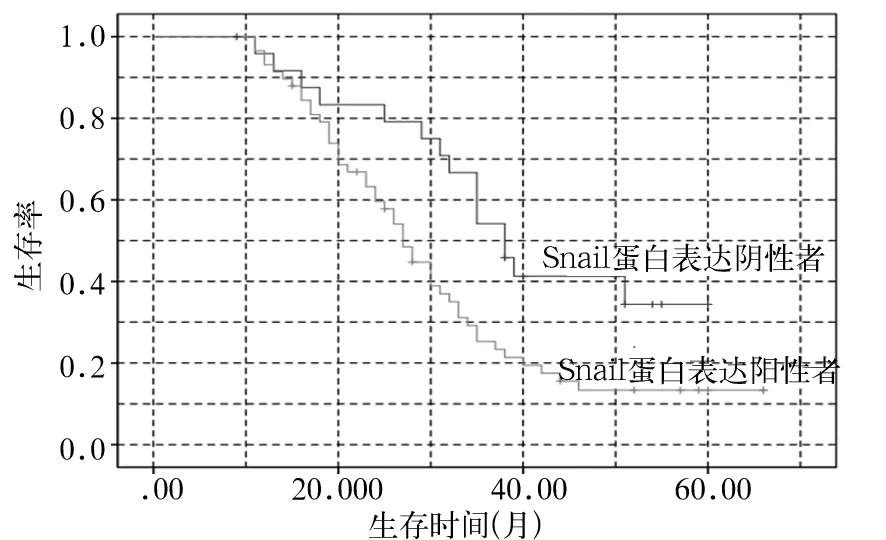
图1 肝癌组织中Snail表达阴性与阳性者Kaplan-Meier生存曲线
2.5 肝癌组织中Claudin-3蛋白表达与患者预后的关系 肝癌组织中Claudin-3表达阴性与阳性者Kaplan-Meier生存曲线见图2。肝癌组织中Claudin-3蛋白表达阴性者术后生存率为17.78%(8/45),术后生存时间(30.11±2.58)个月;肝癌组织中Claudin-3蛋白表达阳性者术后生存率为37.50%(15/40),术后生存时间(40.10±3.02)个月, 肝癌组织中Claudin-3蛋白表达阴性者术后生存率低于、生存时间短于表达阳性者(t=16.446,P=0.000;χ2=4.173,P=0.041)。
3 讨论
肝脏是人体功能最复杂的器官,生理病理进程丰富,因此原发于肝脏的疾病影响因素多,机制复杂。细胞微环境指细胞及其周围组织所组成的内环境,有别于存在动态平衡的正常微环境,肿瘤微环境则是随着肿瘤病情的进展,肿瘤细胞不断打破平衡并发生恶性循环[4]。其中,影响较大的即肿瘤细胞EMT进程。EMT可表现为细胞间连接松动、胞内骨架蛋白结构变化、细胞极性丧失,是细胞获得迁移能力的重要起始生物学过程[5]。生理状态下如胚胎发育过程中亦会有EMT发生,但EMT更常见于肿瘤转移进程。肿瘤细胞发生EMT后,伴随基质金属蛋白酶分泌增加,微环境基质加速降解,肿瘤细胞得以进入脉管系统,从而能转移并种植于其他脏器以形成转移瘤[5]。因此EMT对于促进肿瘤细胞的侵袭力至关重要。
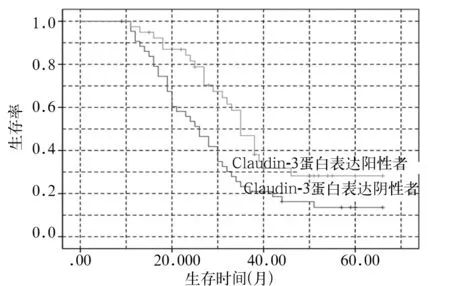
图2 肝癌组织中Claudin-3表达阴性与阳性者Kaplan-Meier生存曲线
Snail属于转录抑制因子,定位于人染色体20q13.13,能与E-钙黏蛋白(E-cadherin)启动子区域结合,竞争性抑制Smad相互作用蛋白1(SIP1),从而抑制E-cadherin、封闭蛋白(Occludin)及Claudin等蛋白表达,同时上调肝脏成纤维细胞特异蛋白(FSP1)、Rho蛋白、波形蛋白(Vimentin)等表达,影响细胞与细胞外基质的黏附,引起细胞骨架重组,最终诱导EMT发生[6]。近年研究表明,Snail蛋白在常见恶性肿瘤如卵巢癌[7]、结直肠癌[8]及罕见恶性肿瘤如胰腺神经内分泌肿瘤[9]中均呈异常高表达,且均发挥促进肿瘤细胞迁移、增强肿瘤细胞侵袭力的作用。沉默Snail基因则能抑制肿瘤细胞EMT,进而抑制肿瘤细胞的增殖与侵袭[10]。本研究发现,Snail蛋白在原发性肝癌组织中表达较非肿瘤癌旁组织中上调,差异有统计学意义,且与临床分期、微血管侵袭密切相关,提示Snail能促进肿瘤的迁移与侵袭。
目前已发现24种Claudin蛋白家族成员,其相对分子质量为22~27 kD,均是细胞间紧密连接的主要跨膜结构蛋白。Claudin蛋白直径作用于紧密连接膜相关蛋白的鸟苷酸激酶(GUK)同工酶、外周膜蛋白ZOs及富PDZ的蛋白1(MUPP-1),且对菌环蛋白及肌动蛋白丝结合蛋白6(AF-6)亦有间接作用,从而调控信号转导,以参与细胞屏障的选择性渗透并维持栅栏功能[11]。Che等[12]发现,非小细胞肺癌组织中Claudin-3蛋白表达下降,且Claudin-3蛋白低表达与患者较差的预后、肿瘤细胞EMT增加密切相关;Kolokytha等[13]研究发现,腺管状乳腺癌组织中Claudin-3蛋白表达阳性患者组术后无复发的生存期较对照组显著延长,提示Claudin-3蛋白参与抑制乳腺癌的转移与侵袭。本研究发现,Claudin-3蛋白在原发性肝癌组织中的阳性表达率较非肿瘤癌旁组织中低,差异有统计学意义,且与临床病理分期、微血管侵袭密切相关,因此Claudin-3蛋白表达改变与原发性肝癌产生相关,且能抑制肿瘤细胞的迁移与侵袭。
李娟等[14]临床研究显示,非小细胞肺癌组织中Snail与Claudin-3蛋白表达呈显著负相关。而本研究结果显示,原发性肝癌组织中Snail与Claudin-3蛋白表达呈显著负相关,推测原发性肝癌组织中Snail、Claudin-3蛋白间的作用机制很可能与非小细胞肺癌中类似,但仍需进一步实验证实。
本研究随访结果显示,原发性肝癌组织中Snail蛋白表达阳性者术后生存时间短于、生存率低于表达阴性者,Claudin-3蛋白表达阴性者术后生存时间短于、生存率低于表达阳性者,因此对于免疫组化结果如上述的患者,应高度重视复诊与随访,适当加强治疗手段的强度,以延长患者术后生存时间,提高患者术后生存率。
综上所述,原发性肝癌组织中Snail蛋白呈异常高表达,Claudin-3蛋白呈异常低表达,且与患者临床表现、预后密切相关,原发性肝癌组织中Snail蛋白与Claudin-3蛋白表达呈负相关;二者表达改变可能与肝癌发生与恶性进展有关,临床有望作为原发性肝癌的肿瘤标记物。

