重庆地区金黄色葡萄球菌临床株的分子型别与耐药性检测
林 君,曹 利
(1.重庆市第七人民医院检验科,重庆 400054;2.陆军军医大学西南医院,重庆 400038)
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是一种重要的人兽共患病原菌,常引起人皮肤软组织感染、肺炎、心内膜炎、败血症,动物乳房炎等疾病,死亡率高[1]。金葡菌的播散主要以特定的克隆群传播为主。检测和明确特定区域的金葡菌主要流行克隆及其菌株的耐药水平,对切断其传播途径,终止耐药金葡菌感染具有重要的现实意义。
按菌株耐药性的差异,金葡菌通常分为耐甲氧西林金葡菌(MRSA)和甲氧西林敏感金葡菌(MSSA),这两者的主要区别在于前者染色体中携带一葡萄球菌盒式染色体(SCCmec),其中的耐药基因mecA可编码对甲氧西林等β-内酰胺类抗菌药物耐药的决定簇PBP2a,介导MRSA的耐药性[1-2]。多种分子分型技术,如多位点序列分析(MLST)、葡萄球菌A蛋白(spa)基因分型以及附属基因调节子(agr)分型等已被广泛应用于MRSA的进化和流行病学研究[3]。研究证实,ST5、ST239和ST8是世界范围内流行的主要MRSA克隆群[4]。在我国,MRSA分离率虽因地区不同而有较大差异,总体上约占金葡菌感染的60%左右,ST239、ST5和ST59也是我国MRSA优势流行克隆[4];MSSA在我国占金葡菌感染的40%左右,但目前对MSSA的研究报道较少。相对于MRSA而言,通常认为MSSA不存在优势克隆,而表现出更高的遗传多样性及更高的毒力因子表达[5],并且与菌血症、心内膜炎以及败血症关联更密切[6]。在MRSA和MSSA的菌株进化分析中发现,MSSA获得SCCmec遗传元件是MRSA的重要来源,MSSA可作为MRSA毒力因子的资源库。葡萄球菌杀白细胞毒素(pvl)是金葡菌重要的毒力因子,在金葡菌感染中性粒细胞、巨噬细胞和单核细胞等过程中发挥重要作用[7]。流行病学研究证实,ST8、ST59、ST121、ST398是主要的携带pvl基因的克隆[8]。
分子分型是金葡菌分子型别确定的重要方法,笔者采用多种金葡菌分子分型方法,结合pvl毒力基因检测和耐药谱分析,对2013年6月至2014年12月从重庆西南医院分离的110株金葡菌进行了分子型别检测研究,一方面从一定程度上揭示了重庆地区金葡菌的流行特征和耐药状态,另一方面也为我国其他地区金葡菌感染和流行的检测分析提供了参考。
1 材料与方法
1.1材料
1.1.1菌株来源 110株金葡菌分离自重庆西南医院,主要源自2013年6月至2014年12月期间110位住院患者的痰液、脓液、血液、穿刺液、分泌物等标本。
1.1.2仪器与试剂 PCR仪、垂直电泳仪、凝胶成像仪为Bio-Rad设备,Bio-Fosum微生物鉴定药敏分析仪为上海复星佰珞公司产品;TSB、BHI培养基为OXOID产品。
1.1.3引物 金葡菌分子分型及pvl毒力基因检测引物均参照文献设计[9-14],由华大基因合成。具体引物序列见表1。
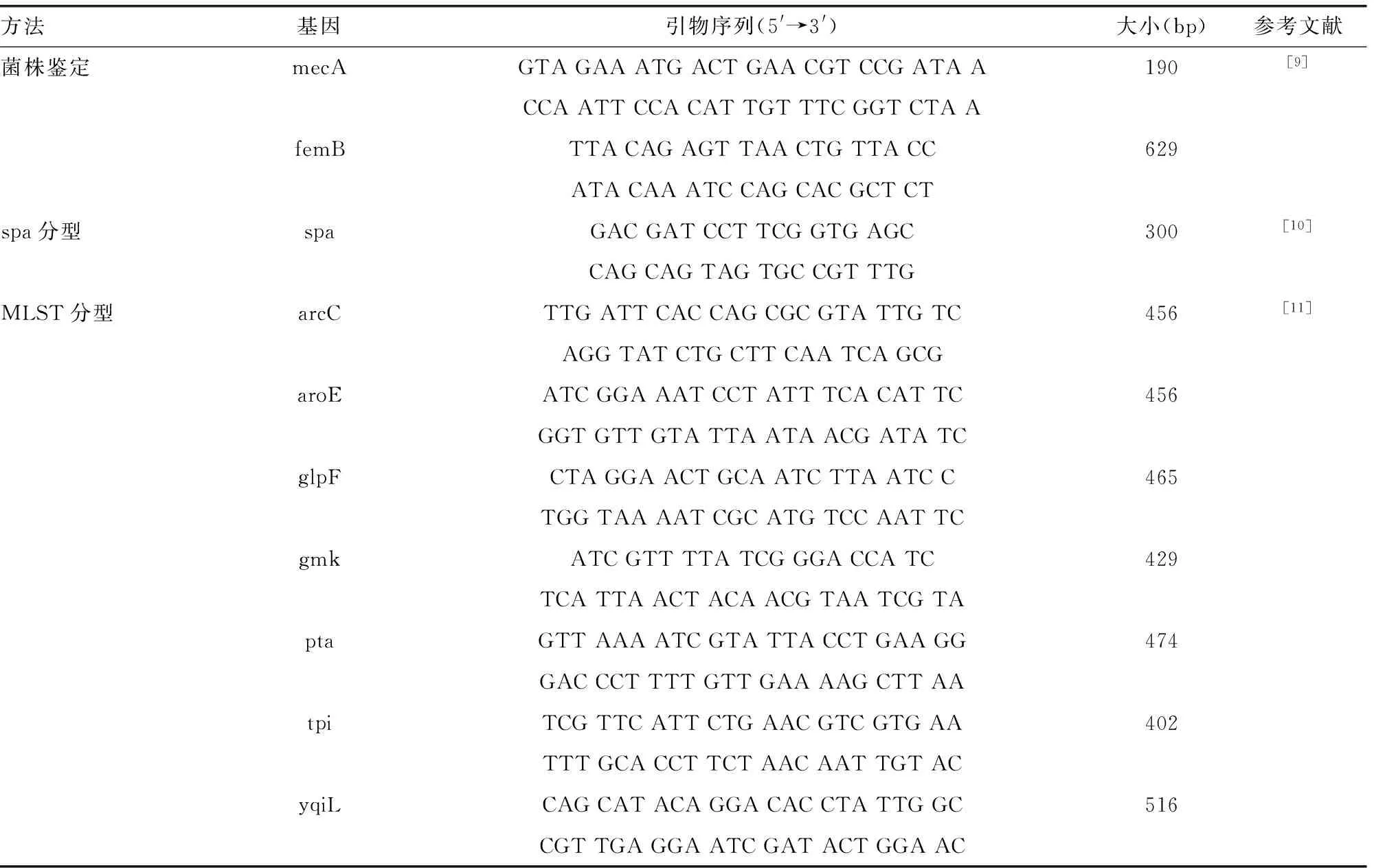
表1 分子分型及毒力基因检测所用引物序列及扩增大小

续表1 分子分型及毒力基因检测所用引物序列及扩增大小
1.2方法
1.2.1细菌培养、基因组提取及菌株鉴定 细菌的分离培养按《全国临床检验操作规程》进行,基因组提取参照文献[9]所述方法进行。金葡菌及MRSA、MSSA的鉴定通过PCR方法分别检测金葡菌分离菌株的mecA与femB基因[9]。若femB基因为阳性,mecA基因为阴性判断为MSSA菌;mecA与femB基因皆阳性者,判为MRSA菌。
1.2.2spa分型 用特异性引物通过PCR扩增出金葡菌spa基因的X区[10],对PCR产物进行测序分析,将获得的序列提交spa基因分型数据库(http://www.ridom.de/spaserver),参照已公布的重复序列,根据重复序列出现的次数和排列方式确定型别[26]。
1.2.3MLST分型 分别扩增金葡菌7个管家基因(arcc、aroe、glp、gmk、pta、tpi、yqil)序列,产物进行DNA测序,所获序列提交MLST数据库(http://saureus.mlst.net/)进行分析得出其MLST型别,即序列型(ST)[11]。
1.2.4MRSA菌株的SCCmec分型 根据文献[12]所述方法,通过PCR方法进行金葡菌Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ型的SCCmec分型。
1.2.5MSSA菌株的agr分型 参照文献[13]所述方法,通过多重PCR扩增MSSA菌株基因组,PCR产物进行电泳,441、575、323、和659 bp大小的条带分别代表agr Ⅰ型、Ⅱ型、Ⅲ型、和Ⅳ型。
1.2.6pvl毒力基因及耐药基因检测 通过PCR方法,用特异性引物扩增所有金葡菌的pvl基因[14],判断菌株的毒力基因携带情况。
1.2.7药敏试验 用Bio-Fosum微生物鉴定药敏分析仪(上海复星佰珞公司) 对菌株的耐药情况进行测定,按照美国临床实验室标准化协会(CLSI) 2015年出版的琼脂稀释法药敏试验解释标准判断菌株对抗菌药物的耐药状态[15],以耐药(R)、敏感(S)表示。
1.2.8多重耐药菌的判定 按照文献[16],某株金葡菌如果对至少3类抗菌药物耐药(每类抗菌药物中至少有一种代表药物耐药),则定义该菌株为多重耐药(MDR)菌株。
2 结 果
2.1MRSA与MSSA鉴定 110株临床金葡菌经PCR扩增mecA和femB基因检出MRSA菌株59株,占53.6%,MSSA菌株51株,占46.4%。
2.2分子分型
2.2.1spa分型 对PCR扩增产物的测序结果进行分析,110株金葡菌株可分为38种spa基因型(表2)。其中59株MRSA分为11种spa基因型,优势型别为t037(28.8%,17/59),t437(27.1%,16/59),t138(16.9%,10/59)和t030(11.9%,7/59);51株MSSA分为27种spa基因型,主要型别有t7146(13.7%,7/51),t3297(7.8%,4/51)和t189(5.9%,3/51)。另外有9株MSSA菌未能分型,可能为新的spa型别。
2.2.2MLST分型 110株金葡菌可分为26种ST型(表2)。在59株MRSA中,优势型别为ST239(57.6%,34/59)和ST59(28.8%,17/59),另外发现1株不能分型,可能为新的ST型;51株MSSA分为18种ST型,主要型别有ST7(19.6%,10/51),ST15(11.8%,6/51),ST25(7.8%,4/51),ST1188(7.8%,4/51),ST398(7.8%,4/51),ST5(5.9%,3/51)、ST464 (5.9%,3/51)和ST943(5.9%,3/51)。
2.2.3MRSA菌株的SCCmec分型 经多重PCR扩增,59株MRSA菌株检出SCCmec Ⅲ型34株(57.6%),SCCmec Ⅰ型12株(20.3%),SCCmec Ⅳ型7株(11.9%),SCCmec Ⅴ型6株(10.2%),结果见表2。
2.2.4MSSA菌株的agr分型 将51株MSSA菌株进行agr分型,检测出agr Ⅰ型35株,占68.6%,agr Ⅱ型9株(17.7%),agr Ⅲ型4株(7.8%),agr Ⅳ型3株(5.9%)。见表2。
2.2.5pvl基因检测 59株MRSA菌株中,pvl毒力基因检出率为23.7%(14/59),14株pvl阳性菌株中有8株为ST239型,另6株为ST59型;51株MSSA菌株中有4株为pvl阳性(7.8%),分别为ST1、ST88、ST398和ST938型(表2)。
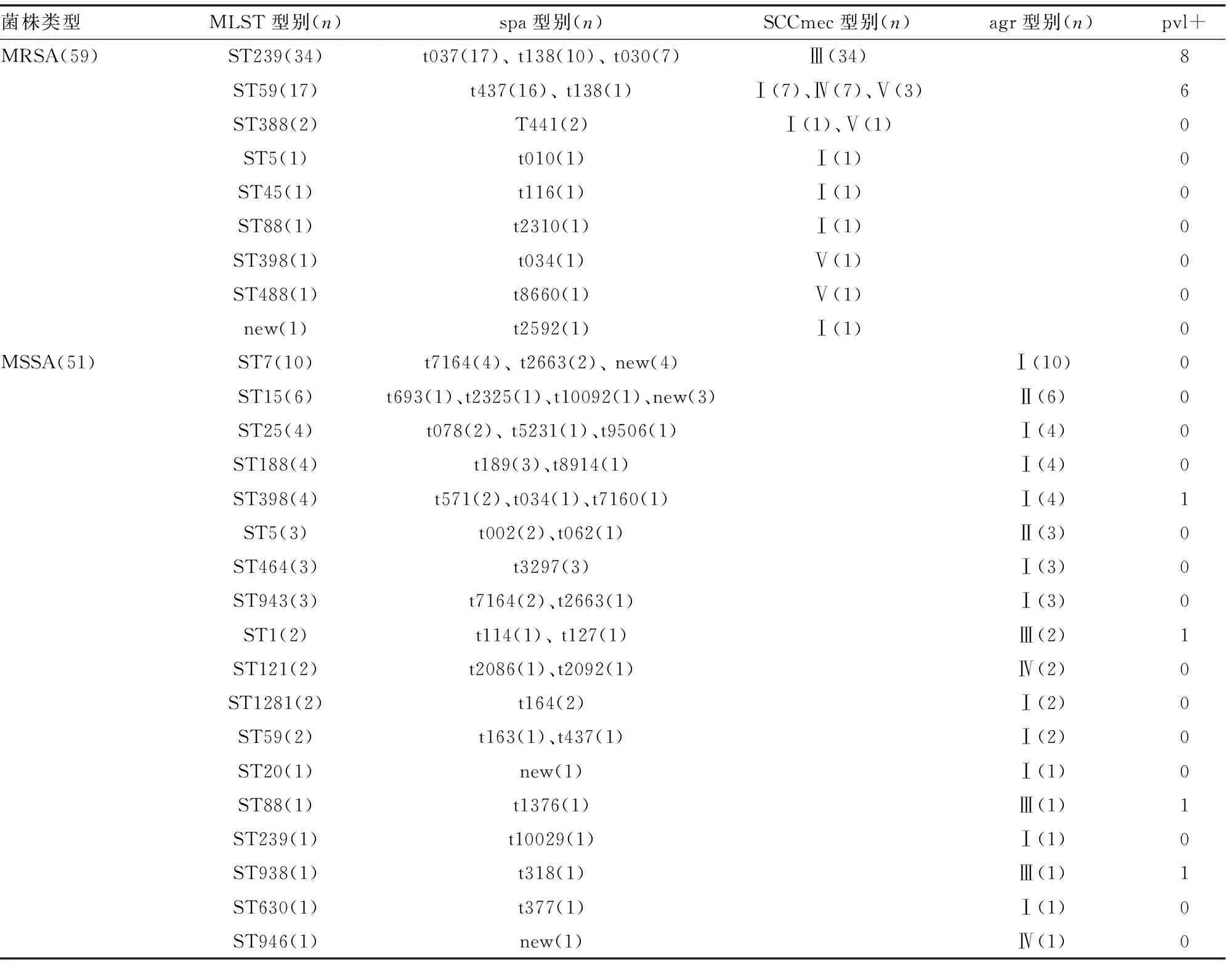
表2 110株金葡菌的分子特征(括号内为菌株数)
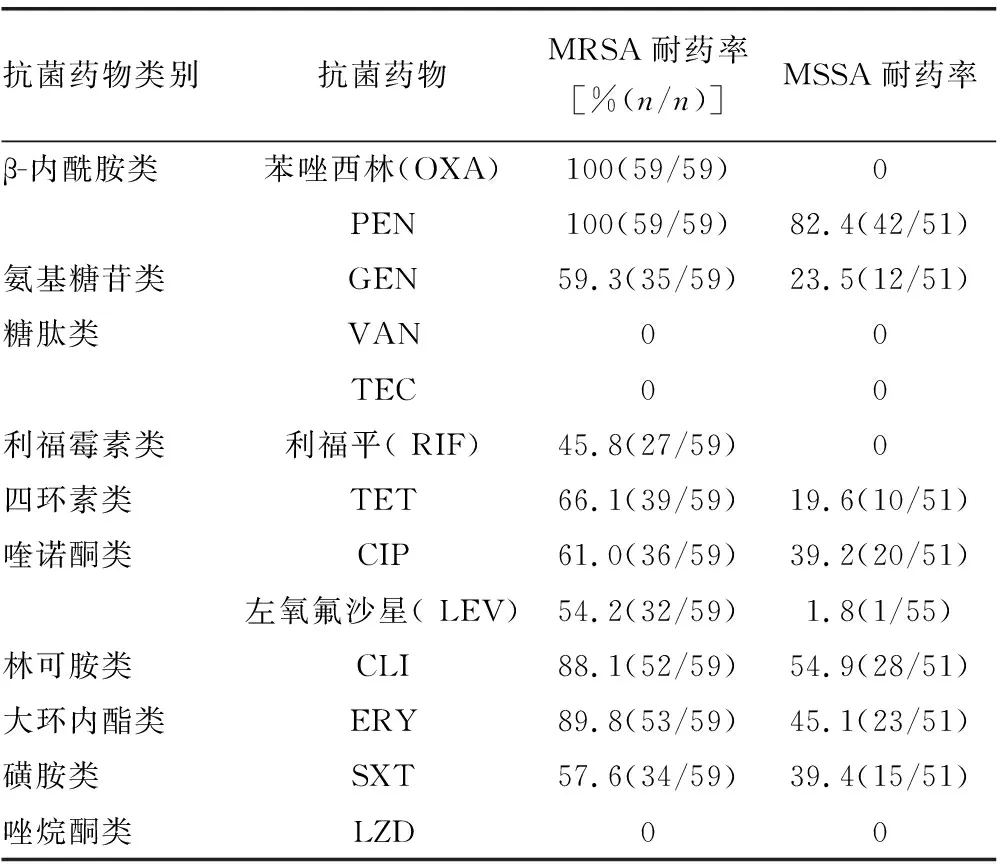
表3 金葡菌临床分离株抗菌药物药敏试验结果
2.3药敏试验分析 110株金葡菌对13种抗菌药物的药敏试验结果见表3。MRSA对糖肽类抗菌药物[万古霉素(VAN)、替考拉宁(TEC)]和唑烷酮类抗菌药物[利奈唑胺(LZD)]全部敏感,但是对其余被检抗菌药物的耐药率则较高。相对于MRSA菌株而言,MSSA菌株对大多数抗菌药物敏感,但对青霉素(PEN)、红霉素(ERY)、克林霉素(CLI)、环丙沙星(CIP)、复方新诺明(SXT)、庆大霉素(GEN)和四环素(TET)等均表现出一定的耐药性。
2.4MDR菌株的耐药谱及分子特点 所有的MRSA菌株均为MDR菌株,而51株MSSA菌株中有24株为MDR菌株。34株ST239 MRSA菌株有共同的耐药谱PEN/CIP/GEN/RIF/TET/LEV。24株MSSA多重耐药菌株中,有12株对3类抗菌药物耐药,其耐药谱见表4;有50%的MSSA菌株对3种以上的抗菌药物耐药,其中1株对6类抗菌药物耐药(PEN/ERY/CLI/SXT/CIP/TET),表明敏感菌MSSA中的多重耐药性也不容忽视。
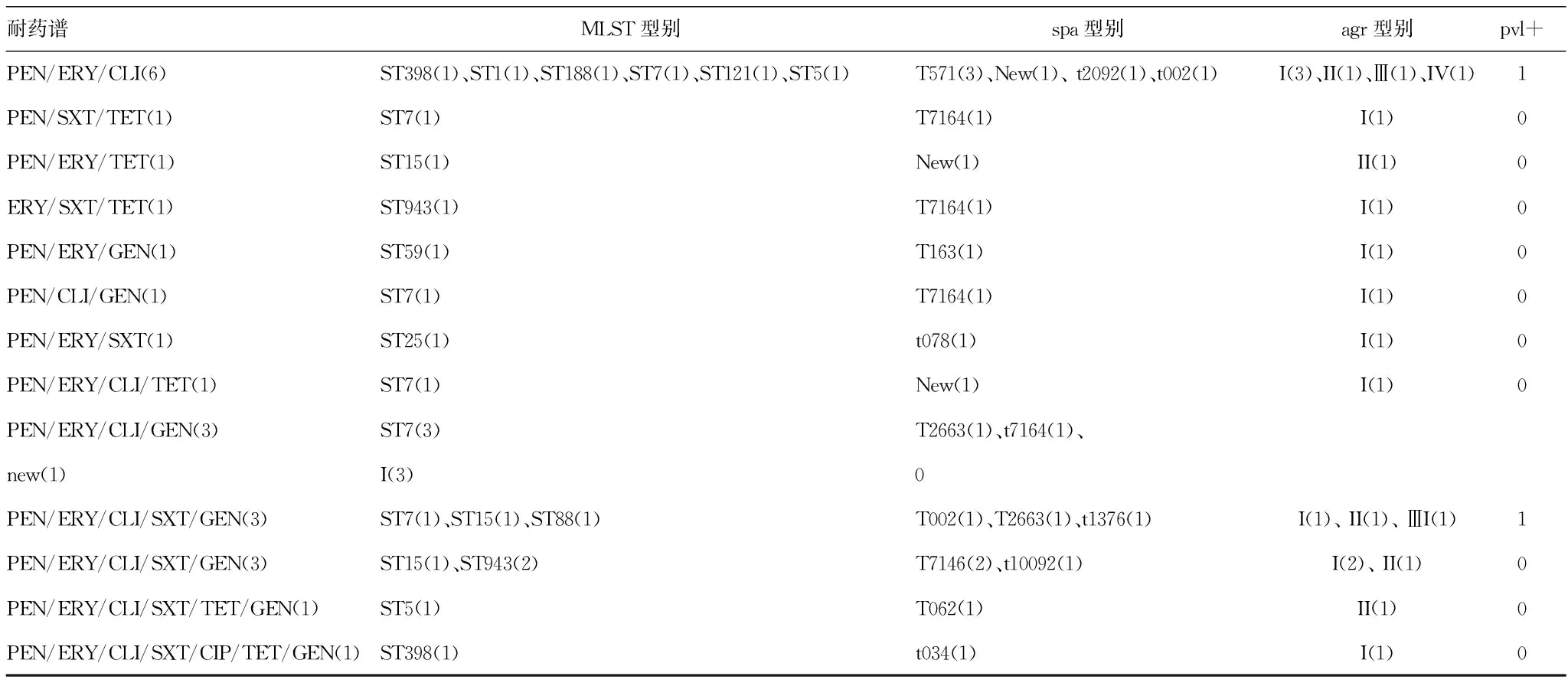
表4 MSSA多重耐药菌株株耐药谱及其分子特点
3 讨 论
自20世纪80年代以来,MRSA因具有较强的定植能力和外界环境适应能力,在全球范围内迅速传播,成为医院和社区获得性感染的重要病原菌。在我国,临床金葡菌中的MRSA检出率从1980年的20%迅速升高到2008年的约60%[17],引起了我国医务工作者的高度关注。流行病学研究表明,ST239-MRSA-Ⅲ和ST5-MRSA-Ⅱ是我国MRSA优势流行型别[4]。本研究中,来自重庆地区的MRSA检出率为53.6%(59/110),接近全国平均水平,该地区的MRSA优势流行型别为ST239-MRSA-Ⅲ (57.6%,34/59)和ST59-MRSA-Ⅰ/Ⅳ/Ⅴ(28.8%,17/59),这一结果与以往报道的对重庆MRSA的分析结果相一致[4,18]。ST239是亚洲国家的主要流行克隆[19],有研究证实,ST239-MRSA-Ⅲ-t037,是我国北京地区2000年之前的主要克隆,之后逐渐被ST239-MRSA-Ⅲ-t030取代[20],本研究中ST239-MRSA-Ⅲ-t037仍然是最优势克隆(50.0%,17/34),而ST239-MRSA-Ⅲ-t030占20.6%(7/34),表明ST239-MRSA-Ⅲ-t037型菌株在重庆地区有更强的适应能力和传播能力。药敏试验结果表明,MRSA菌株全部为多重耐药菌。
和MRSA相比,MSSA菌株通常拥有更高的遗传多样性[21],在我国的研究报道中,主要的MSSA型别因地区不同而差异较大[20,22]。本研究中鉴定的51株MSSA菌可分为18种ST型别和27种spa型,相对于MRSA菌株(8种ST型别,11种spa型)而言,MSSA具有更多的克隆多态性。ST7、ST15、ST25、ST88、ST188、ST398、ST5、ST464和ST943是该地区主要的MLST型别。ST121是在全球广泛分布的社区获得性克隆群,因其高毒力而引起研究者关注[23]。我国对于ST121金葡菌的报道较少,在本研究中,有2株MSSA菌株检测为ST121型(3.9%,2/51),此2株菌虽未携带pvl毒力基因,但其高毒力特征值得深入研究。
在欧美地区,临床分离的MSSA对除青霉素之外的大多数常用抗菌药物敏感[21,24],因此MSSA的耐药情况在国外并未引起关注。在我国的报道中,已发现MSSA除对PEN耐药外,还对ERY、CLI等存在不同程度的耐药[25]。在本研究的51株MSSA菌株中检出了高比例的多重耐药菌株(47.1%,24/51),这些MDR菌有不同的耐药谱,但多数对PEN、ERY和CLI耐药(75.0%,18/24)。在这些MDR型MSSA中,有3株对五类抗菌药物耐药,另外有1株菌株对6类抗菌药物耐药,提示MSSA的耐药性在重庆地区不容乐观,值得临床高度关注。
4 结 论
本研究在一定程度上揭示了重庆地区MRSA和MSSA的种群分子特征及耐药谱,其中MRSA以ST239-MRSA-Ⅲ占绝对优势;而MSSA分子型别则呈现出多样性。ST121等高毒力、多重耐药菌株的检出,提示在我国金葡菌感染的防控中,除关注MRSA外,MSSA以其较高的毒力以及越来越严峻的耐药形势同样需要给予高度关注。

