基于高通量测序探讨印楝素对薄壳山核桃林地土壤微生物的影响
尹华阳,郭婉琳,董广平,方建民,刘洪剑,李晓娟
(安徽省林业科学研究院,合肥230031)
薄壳山核桃(Carya illinoensis),又名美国山核桃、长山核桃,为胡桃科山核桃属的落叶乔木,原产于美国和墨西哥北部,是一种品质优良的高档干果和油料树种[1-2],亦为优良的材用和园林绿化树种,具有极高的经济价值和观赏价值。我国于19 世纪末开始引种栽培薄壳山核桃,目前主要集中在江苏、浙江、云南、陕西、安徽、江西和湖南等地[3]。随着种植面积的逐步扩大,各种虫害(如天牛、咖啡豹蠹蛾、桃蛀螟、山核桃透翅蛾、蚜虫、叶甲等)频繁发生,对薄壳山核桃产业产生了严重的威胁。
目前,对薄壳山核桃虫害的防治方法主要有人工捕杀和药物防治两种[4-5]。前者成本较高且防治效果受人主观因素影响较大;后者虽效果明显,但化学农药的过度使用不仅对人类健康造成危害,而且对环境尤其是土壤也产生了严重的影响。
印楝素(azadirachtin)作为一种新型的植物源农药,具有广谱、低毒,不易产生抗药性和环境相容性好等优点[6],对天牛有较好的防治作用。目前,对印楝素的研究主要为对昆虫的毒理作用以及对人和动物的安全性评价等方面[7-8],而印楝素对土壤微生物的研究鲜有报道。本文以高通量测序技术为基础,对印楝素处理的薄壳山核桃林土壤微生物进行研究,将有利于多方面评价印楝素杀虫剂,同时期望能有效指导印楝素及含印楝素的杀虫剂开发和推广应用。
1 材料与方法
1.1 试验地概况
试验地位于安徽省滁州市沙河镇国家林草局山核桃工程技术研究中心基地薄壳山核桃林地,薄壳山核桃林株行距为3 m×4 m,树龄为3 年;土壤为黄棕壤,土层深厚、质地黏重,pH 值在6.0 左右。
1.2 试验设计
试验在有效杀虫浓度范围内设3 个处理,分别是:对照组(CK),不施药;300 倍稀释组(A300),采用1%印楝素(北京琳海植保科技股份有限公司)300 倍稀释液1 000 mL 对薄壳山核桃进行灌根处理;600倍稀释组(A600),采用1%印楝素600 倍稀释液1 000 mL 对薄壳山核桃进行灌根处理。在试验地内选取树况相似的薄壳山核桃进行处理,每个处理组各处理3 株,共计9 株,各株间距均大于5 m。
各组处理完成30 d 后采集土壤样品,以树干基部为圆心半径20 cm 处挖坑取土。每株取3 个不同深度的土壤,土壤深度分别为距表面10~15 cm、30~35 cm、50~55 cm,每组设3 次重复,共取得27 份土壤样品,置于已消毒的自封袋中,干冰保存带回实验室,实验室-80 ℃冰箱保存。
1.3 土壤微生物DNA 提取、测序及处理
从样品中提取基因组DNA 后,用带有barcode 的特异引物分别扩增细菌16S rDNA 的V3+V4 区(引物序列为KYO2F:GATGAAGAACGYAGYRAA;ITS4R:TCCTCCGCTTATTGATATGC)以及真菌ITS rDNA 的ITS2 区(引物序列为 341F: CCTACGGGNGGCWGCAG;806R;GGACTACHVGGGTATCTAAT)。
扩增体系为:50 μL 反应体系中包含5 μL 的10×KOD Buffer,5 μL 的2.5 mM dNTPs,1.5 μL 引 物(5μM),1 μL 的KOD 聚合酶和100 ng 模版DNA。扩增条件为:95 ℃预变性2 min,98 ℃变性10 s,62℃退火30 s,68 ℃延伸30 s,共27 个循环,最后68℃延伸10 min。PCR 扩增产物切胶回收,用QuantiFluorTM 荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,Hiseq2500 PE250 上机测序。
测序后得到的初始数据有一些质量不高,容易干扰分析结果,因此需要进行数据预处理。去除N比例过高的序列:去除reads 中N 碱基占比超过10%的序列;去除低质量序列:去除质量值高于20的碱基数占碱基总数的百分比小于40%的reads。根据reads 之间的重叠关系,使用FLASH 将成对双端reads 拼接为一条序列,得到原始Tags 数据(Raw Tags)。拼接得到的RawTags。需要经过更严格的过滤处理后[9],得到高质量的Tags 数据(Clean Tags)。参照Qiime(V1.9.1)[10]的Tags 质量控制流程,进行Tags 截取:将Raw Tags 从连续低质量值(默认质量阈值为<=3)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断;Tags 长度过滤:Tags 经过截取后得到的Tags 数据集,进一步过滤掉其中连续高质量碱基长度小于Tags 长度75%的Tags。经过以上处理后得到的Tags 序列与数据库(UCHIME Algorithm)进行比对[11]检测嵌合体序列,去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)。
1.4 物种注释与丰度计算
为了研究样品的物种的组成多样性信息,用Uparse(usearch v9.2.64) 软件对所有样品的全部Effective Tags 序列聚类。默认提供以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units)结果,并计算出每个OTU 在各个样品中的Tags 绝对丰度和相对信息。在构建OTUs 的过程中选取代表性序列(OTUs 中丰度最高的那条Tag 序列),用RDP Classifier(version 2.2)与物种注释的数据库进行物种注释,得到采集土壤样品中微生物物种丰度。
1.5 多样性计算
基于OTU 的丰度结果,使用Qiime 软件计算各个土壤样品的α 多样性,包括:chao1 值、ACE 值、Shannon 以及Simpson 指数等,用于指示土壤样本的物种丰富度和均匀度等信息。
根据所有样品的OTU 序列,使用软件Muscle(v3.8.31)进行多序列比对,然后使用软件TreeBeST(v1.9.2)构建OTU 之间的系统发育树。
2 结果与分析
2.1 薄壳山核桃土壤样品中细菌及真菌的测序结果
对土壤样品测序下机数据得到的序列进行筛选,最终27 个样品16S rDNA 高变区测序共测得有效序列数2 804 288 个,OTUs 数130 662 条;ITS rDNA 高变区测序共测得有效序列数2 208 825 个,OTUs 数9 163 条。每个样品的有效序列数均大于70 000 个,满足后续的物种丰度和多样性指数分析要求。
2.2 薄壳山核桃土壤样品细菌16S rDNA V3+V4区测序结果
2.2.1 不同施药处理薄壳山核桃土壤样品细菌种类热图比较
在科的水平对样品细菌聚类后,对样品中OTUs包含的序列的丰度绘制热图(见图1),热图中每列代表一个样本,每行代表一个分类水平,颜色从红到蓝表示丰度从高到低,由此可以清楚从颜色梯度的不同观察到数据的差异,从而发现不同处理样本间发生的变化。从图中可以看出土壤深度为距表面10~15 cm各样品中,A300 组和CK 组相比无较大变化,A600组的链霉菌科(Streptomycetaceae)、芽胞杆菌科(Bacillaceae)、芽单胞菌科(Gemmatimonadaceae)、伯克氏菌科(Burkholderiaceae)、鞘脂单胞菌科(Sphingomonadaceae)等菌类的丰度有所降低;土壤深度为距表面30~35 cm 各样品中,与CK 组相比,A300组和A600 组的链霉菌科、芽单胞菌科、鞘脂单胞菌科等菌类的丰度有所降低,A600 组的假单胞菌科(Pseudomonadaceae)、根瘤菌科(Rhizobiaceae)的菌类丰度有所升高;土壤深度为距表面50~55 cm 各样品中,A300 组的鞘脂单胞菌科、硫还原菌科(Desulfurellaceae)的菌类丰度与CK 组相比有一定程度的降低,A600 组和CK 组相比变化不明显。
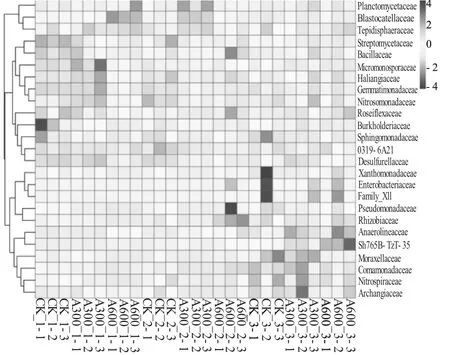
图1 不同施药处理下不同深度土壤样品细菌种类
对所有土壤样品测得的OTUs 所对应的生物分类信息进行统计分析表明,130 662 条OTUs 分属于10 个门,分别是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、芽单胞菌门(Gemmatimonadetes)、匿杆菌门(Latescibacteria)、厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)。其中变形菌门和酸杆菌门这两个菌门在样本中所占比例达10%以上,这说明不同处理薄壳山核桃土壤样品中的优势菌门为这两类。
2.2.2 不同施药处理薄壳山核桃土壤样品细菌α 多样性指数分析
α 多样性是指特定生境或者生态系统内的多样性情况,它可以指示生境被物种隔离的程度,通常利用物种丰富度(种类情况)与物种均匀度(分布情况)两个重要参数来计算。Chao1 指数主要关心样本的物种丰富度信息;observed_species 指数表示能检测到的OTU 种类情况;Shannon 指数主要综合体现物种的丰富度和均匀度。为了直观分析各组之间α 多样性指数差异,我们绘制了各个α 多样性指数箱线图(见图2)。
由图2 可以看出,不同施药处理薄壳山核桃浅层 土 壤(10~15 cm) 样 品 的 Chao1 指 数、observed_species 指数和Shannon 指数差异不大;中层土壤(30~35 cm)CK 组、A300 组和A600 组样品的3 个α 多样性指数有逐渐下降的趋势;深层土壤(50~55 cm)样品中CK 组和A600 组的指数差异不明显,而A300 组的指数明显低于另外两组。这表明印楝素对薄壳山核桃林土壤细菌多样性和丰度造成了一定影响。其中对浅层土壤细菌影响较小;对中层土壤细菌600 倍稀释的印楝素药液影响相较300倍稀释更大;而深层土壤细菌受300 倍稀释的印楝素药液影响明显,600 倍稀释药液几乎无影响。

图2 不同施药处理土壤样品细菌α 多样性指数
2.3 薄壳山核桃土壤样品真菌ITS rDNA ITS2 区测序结果
本研究对不同土层深度不同施药处理的薄壳山核桃土壤样品真菌ITS rDNA ITS2 区进行了扩增及测序,但对于不同施药处理的深层土壤(50~55 cm)样品扩增效果均不理想,可能由于深层土壤积水造成的真菌丰度较低导致。因此仅针对不同施药处理薄壳山核桃浅层土壤(10~15 cm)样品和中层土壤(30~35 cm)样品进行后续分析。
2.3.1 不同施药处理薄壳山核桃土壤样品真菌种类热图比较
在科的水平对样品真菌聚类后,对样品中OTUs 包含的序列的丰度绘制热图(见图3)。
由图3 可以看出,土壤深度距表面10~15 cm 各样品中,A300 组和 A600 组的革菌科(Thelephoraceae)、丝盖伞科(Inocybaceae)和发菌科(Trichocomaceae)的菌类丰度相较于CK 组有所降低,A600 组的球盖菇科(Strophariaceae)的菌类丰度相较于其余两组有明显升高。土壤深度距表面30~35 cm 各样品中,A300 组和A600 组的丝盖伞科和发菌科的菌类丰度相较于CK 组有较明显的降低,A300 组的孢菌科(Pleosporaceae) 和扁孔腔菌科(Lophiostomataceae) 的菌类丰度较另两组偏低,A600 组的间座壳科(Diaporthaceae)、毛壳菌科(Chaetomiaceae)和红菇科(Russulaceae)的菌类丰度有一定程度的升高。
对土壤样品测得的OTUs 所对应的生物分类信息进行统计分析,绘制物种分布堆叠图(见图4)。
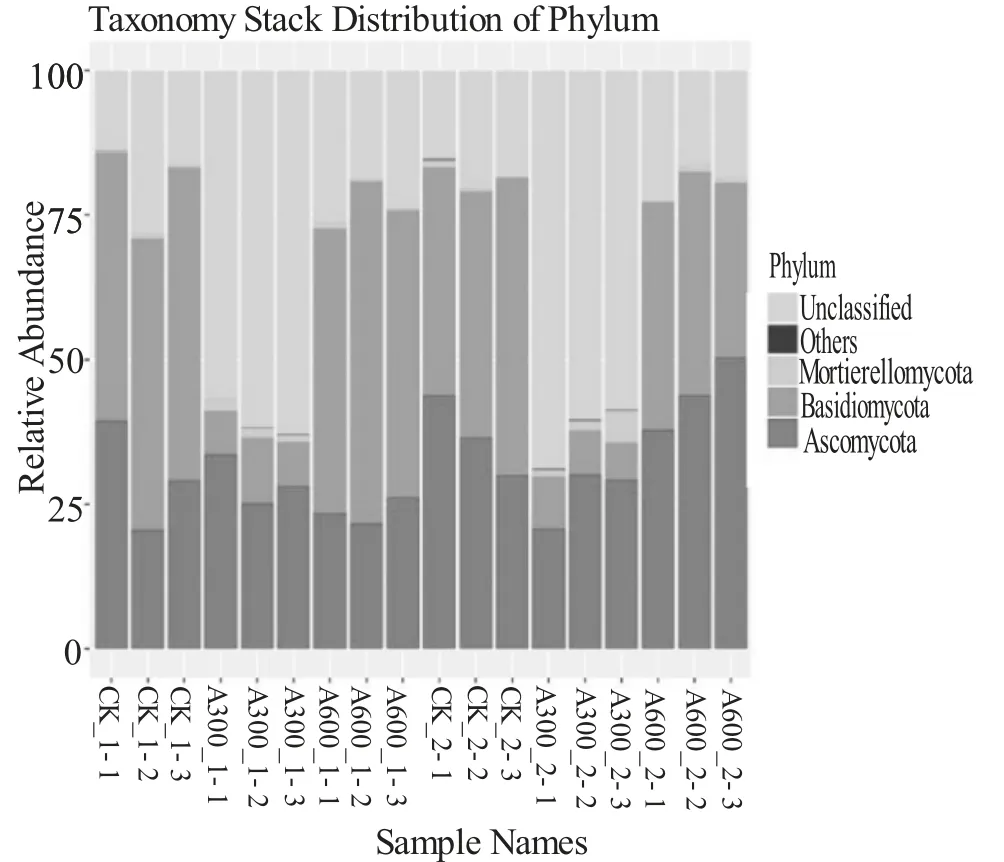
图4 不同施药处理下不同深度土壤样品真菌分布
由图4 可以看出,9 163 条OTUs 分属于3 个门: 子 囊 菌 门 (Ascomycota)、 担 子 菌 门(Basidiomycota)和被孢霉门(Mortierellomycota),其中子囊菌门和担子菌门为山核桃林地土壤中最优势菌门。还可以看出,施300 倍稀释印楝素药液的浅层土壤(10~15 cm)样品和中层土壤(30~35 cm)样品担子菌门真菌所占比例下降明显,未归类真菌比例增高。
2.3.2 不同施药处理薄壳山核桃土壤样品真菌α多样性指数分析
对不同施药处理薄壳山核桃土壤样品真菌α多样性指数绘制指数箱线图,直观分析各组之间α多样性指数差异(见图5)。
由图5 可以看出,不同施药处理薄壳山核桃浅层土壤(10~15 cm) 样品真菌的Chao1 指数、observed_species 指数和Shannon 指数均为CK 组>A300 组>A600 组;中层土壤(30~35 cm)样品真菌的Chao1 指数和observed_species 指数为CK 组>A300 组>A600 组,但A300 组的Shannon 指数要明显低于另外两组,说明施300 倍稀释印楝素药液的中层土壤(30~35 cm)中真菌的丰度和均匀度明显降低。总体趋势上看,中层土壤真菌α 多样性指数受施药影响更明显。
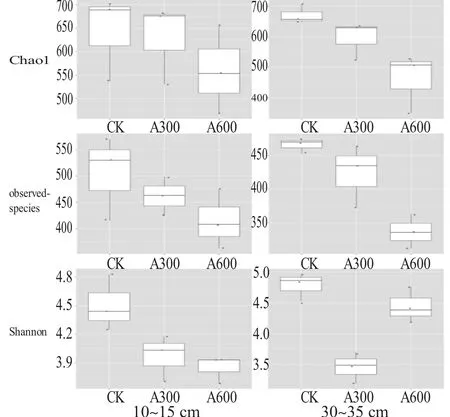
图5 不同施药处理土壤样品真菌α 多样性指数
3 讨论
本文基于高通量测序技术比较分析了不同浓度印楝素对不同土层深度薄壳山核桃林地土壤微生物多样性的影响。采集的所有样本均分离出薄壳山核桃林样地土壤中常见的变形菌门、酸杆菌门、浮霉菌、放线菌门等细菌,以及子囊菌门和担子菌门等真菌。通过16S 高通量测序分析发现,薄壳山核桃深层土壤(50~55 cm)中细菌种类、丰度及均匀度受300 倍稀释印楝素影响明显,其中鞘脂单胞菌科、硫还原菌科的菌类丰度下降较多;施600 倍稀释印楝素的浅层土壤(10~15 cm)中链霉菌科、芽胞杆菌科、芽单胞菌科等菌类的丰度有所降低,但α多样性指数各组间差距不大;中层土壤(30~35 cm)中两个施药组的链霉菌科、芽单胞菌科、鞘脂单胞菌科的菌类丰度有所降低,600 倍稀释印楝素处理组的各α 多样性指数略低于300 倍稀释处理组。这表明施用印楝素对薄壳山核桃林土壤细菌多样性和丰度造成了一定影响,高浓度的印楝素对深层土壤的影响更高。
该薄壳山核桃林地深层土壤(50~55 cm)真菌丰度较低,未能成功扩增,因此仅针对不同施药处理薄壳山核桃浅层土壤(10~15 cm)样品和中层土壤(30~35 cm)进行了ITS 高通量测序分析。研究发现,所有土壤样品中可识别真菌主要分属于子囊菌门、担子菌门和被孢霉门,其中子囊菌门和担子菌门为山核桃林地土壤中最优势菌门,施300 倍稀释印楝素药液样品的担子菌门真菌所占比例下降明显,而未归类真菌比例增高。两种不同土壤深度样品中,施药组的丝盖伞科和发菌科的菌类丰度均有所降低,施300 倍稀释印楝素的中层土壤(30~35 cm)中孢菌科和扁孔腔菌科的菌类丰度偏低,600 倍稀释印楝素处理组的球盖菇科、间座壳科、毛壳菌科和红菇科的菌类丰度在不同土层中出现一定程度的升高。施用印楝素对土壤样品真菌α 多样性指数影响较大,从趋势上看,中层土壤真菌α 多样性指数受施药影响更明显。
试验结果表明,印楝素对薄壳山核桃林地土壤微生物产生了一定影响,其中高浓度的印楝素对土壤中担子菌门真菌以及深层土壤微生物的影响较为显著,十分不利于土壤微生物的多样性,继而影响植物的生长发育。因此,在生产实践中需要研究药液中印楝素适宜的浓度进行害虫防治,降低对土壤微生物的影响,才能有利于薄壳山核桃林的长远发展。本试验仅对施用印楝素30 d 的薄壳山核桃林土壤真菌、细菌进行测序研究,对于印楝素对土壤微生物的长远影响以及相同杀虫效果下印楝素与化学农药对土壤微生物影响的对比,还需要进一步研究。

