系统性红斑狼疮合并巨细胞病毒感染的临床特征及危险因素
谭雨亭,侍效春,刘晓清,曾小峰,周宝桐
中国医学科学院 北京协和医学院 北京协和医院 1感染内科 2免疫内科,北京100730
合并感染是风湿免疫病患者预后不良的主要危险因素之一[1-2]。受疾病本身免疫功能障碍及应用糖皮质激素或免疫抑制剂的影响,风湿免疫病患者出现包括巨细胞病毒 (cytomegalovirus,CMV)在内的机会性感染风险增加[3]。CMV可终生潜伏在受感染的宿主中,据估计,全球范围内CMV在成人中的血清阳性率为40%~100%[4]。在免疫抑制患者中,CMV可重新激活,引起肺、肝、胃肠道、骨髓和视网膜等器官组织的损害,甚至引起严重的器官特异性并发症,增加死亡率[5-7]。本研究回顾性地分析系统性红斑狼疮(systemic lupus erythematosus,SLE)合并活动性CMV感染患者的临床特征及危险因素,为临床诊治提供参考。
对象和方法
对象选取2017年7月1日至2019年4月1日北京协和医院免疫内科出院诊断为SLE的患者。入组标准:(1)SLE诊断明确,符合2009年美国风湿病学会SLE分类诊断标准[8];(2)有CMV DNA或pp65抗原检测结果。排除标准:(1)合并恶性肿瘤;(2)人类免疫缺陷病毒感染患者;(3)妊娠妇女;(4)重叠综合征;(5)其他疾病如炎性肠病、原发性肾病综合征等正在应用激素及免疫抑制剂治疗的患者;(6)病史资料不全。
方法回顾性收集符合上述条件患者的病史资料,包括性别、年龄、入院前病程、SLE受累脏器、入院时SLE疾病活动指数 (SLE disease activity index,SLEDAI)-2000[9]、CMV DNA或pp65抗原检测前30 d内激素及免疫抑制剂使用情况、CMV感染及治疗情况、合并感染情况、在院时结局以及CMV DNA或pp65抗原检测前2周内的实验室检查指标 [包括血常规、肝肾功能、白蛋白 (albumin,ALB)、补体 C3或C4、CD4+T细胞计数[10]等],分析CMV感染的危险因素。
定义(1)CMV感染:CMV DNA检测阳性和/或pp65抗原检测阳性或病理学活组织检测到典型的CMV包涵体,有或没有临床症状。通过实时荧光定量聚合酶链反应技术进行CMV DNA载量检测,CMV DNA检测阳性定义为病毒载量≥500拷贝/ml。通过单克隆抗体间接免疫荧光法检测CMV pp65抗原阳性的外周血白细胞,pp65抗原检测阳性定义为CMV pp65抗原阳性的外周血白细胞计数≥1个/2×105白细胞。 (2)亚临床CMV感染:外周血CMV DNA检测阳性或pp65抗原检测阳性,无临床症状。(3)CMV病:有CMV感染的证据并伴有CMV相关临床症状,包括病毒综合征(发热、白细胞减少、血小板减少)或出现CMV组织侵袭性疾病。(4)新发SLE:确诊SLE时间小于3个月。
统计学处理采用SPSS 21.0统计学软件,计量资料用中位数 (范围)表示,分类变量用比例表示。符合正态分布的连续变量的组间比较采用成组t检验,反之采用Wilcoxon秩和检验。计数资料的组间比较采用χ2检验或Kruskal-Wallis秩和检验。采用多因素Logistic回归模型通过向后 “Logistic回归”方法对危险因素进行分析。P<0.05为差异有统计学意义。
结 果
一般资料通过病历回顾,2017年7月1日至2019年4月1日北京协和医院免疫内科出院诊断为SLE的患者共387例。156例患者被排除,其中93例未行CMV DNA及pp65抗原检测;19例为未确诊SLE;6例为妊娠妇女;4例合并恶性肿瘤;30例激素使用时间或剂量不详;4例诊断重叠综合征。231例符合条件的患者被纳入研究。其中,207例 (89.6%)为女性、24例 (10.4%)为男性。年龄12~70岁,中位年龄为31岁。114例 (49.0%)为新发SLE患者。SLE受累脏器方面:血液系统受累最常见 (56.7%),其次为肾脏 (53.2%)、 神经精神系统 (22.9%)、 肺部 (18.6%)、浆膜炎 (18.2%)等。SLE治疗方面:216例 (93.5%)患者在CMV检验前30 d内应用过激素;139例 (60.2%)在30 d内应用过免疫抑制剂 (主要包括环磷酰胺、吗替麦考酚酯、他克莫司、环抱素)。
SLE合并其他感染情况231例SLE患者中,52例患者 (22.5%)在筛查CMV感染时合并其他感染,其中下呼吸道感染最常见,占57.7%,其次为血流感染 (9.6%)、消化道感染 (9.6%)、其他病毒感染(包括活动性EB病毒感染、甲型流感病毒感染、细小病毒B19感染,占9.6%)、皮肤软组织感染 (7.7%),中枢神经系统感染相对少见,占1.9%。病原学方面:曲霉菌最常见 (13.5%),其次为金黄色葡萄球菌 (9.6%)、大肠埃希菌 (7.7%)、肺炎克雷伯菌 (7.7%)、耶氏肺抱子菌 (7.7%)、EB病毒 (7.7%),20例患者 (38.5%)有感染相关临床表现及影像学表现,病原不明,经相应抗感染治疗后症状及影像学均改善。
SLE合并CMV感染患者特点115例患者诊断为CMV感染。CMV DNA检测阳性者40例 (35.4%);pp65抗原检测阳性者91例 (88.3%)。亚临床CMV感染者78例 (67.8%),CMV病者37例 (32.2%),其中25例患者 (67.6%)有病毒综合征表现 (发热和/或血细胞减少),14例 (37.8%)发生CMV肝炎,2例 (5.4%) 发生CMV肺炎,1例 (2.7%)发生CMV胃炎。115例CMV感染患者中,80例 (69.5%)接受抗病毒治疗,中位疗程为21(4~63)d。经过1个月随访,80例抗病毒治疗患者中,CMV DNA检测转阴率为25/37(67.6%),pp65抗原检测转阴率为13/59(22%);35例未治疗患者中,CMV DNA检测转阴率为1/3(33.3%),pp65抗原检测转阴率为3/32(9.4%)。80例抗病毒治疗患者中,10例 (12.5%)发生抗病毒药物相关不良反应,其中5例出现更昔洛韦相关骨髓抑制;1例出现更昔洛韦相关心悸、乏力;2例出现磷钾酸钠相关肾功能损伤;2例出现磷钾酸钠相关胃肠道反应。115例CMV感染患者中,112例 (98.3%)出院时好转,3例患者死亡。2例死于严重感染、1例死于SLE本身。
SLE患者发生CMV感染危险因素单因素分析显示SLE受累脏器数目 (P=0.015)、合并其他感染(P=0.004)、 糖皮质激素冲击治疗 (P=0.001)、30 d内糖皮质激素累积剂量 (P=0.001)、30 d内糖皮质激素平均剂量 (P<0.001)、 静脉环磷酰胺 (P=0.003)、糖皮质激素冲击联合免疫抑制剂治疗 (P=0.001)、入院时SLEDAI-2000 (P=0.018)、ALB≤30 g/L(P<0.001)与发生CMV感染有关,差异有统计学意义 (表1)。多因素分析显示合并其他感染 (OR=8.003,95%CI=2.108~30.383,P=0.002)、糖皮质激素冲击联合免疫抑制剂治疗 (OR=10.336,95%CI=2.107~50.711,P=0.004)、 ALB≤30 g/L(OR=3.367, 95%CI=1.157~9.796,P=0.026)为发生CMV感染的独立危险因素 (表2)。
SLE合并CMV感染患者发生CMV病危险因素115例SLE合并CMV感染患者中,78例 (67.8%)为亚临床CMV感染,37例 (32.2%)诊断为CMV病。单因素分析结果显示,入院前病程 (P=0.008)、新发SLE(P=0.017)与SLE合并CMV感染患者发生CMV病有关。进一步行多因素Logistic回归分析提示入院前病程 (OR=1.01,95%CI=0.99~1.02)、 新发 SLE(OR=0.65, 95%CI=0.22~1.91)、 CMV pp65抗原阳性的外周血白细胞计数 (OR=0.99,95%CI=0.96~1.01)与是否发生CMV病无相关性。
讨 论
SLE是发生活动性CMV感染的高危风湿免疫病病种[11-12]。先前研究表明,CMV在触发SLE及SLE病情活动过程中亦发挥潜在作用[13-14]。CMV感染在SLE患者中临床表现多样,从病毒综合征如发热、血细胞减少到侵袭肺、胃肠道、肝脏、眼部等终末器官,可模拟SLE活动的临床表现,从而影响临床医生对疾病的判断,给治疗带来较大困难[15-16],严重影响患者预后。因此,早期识别CMV感染高危人群,及时筛查和治疗CMV感染,意义重大。
有研究报道高龄、较低的T淋巴细胞计数、较大剂量的糖皮质激素、联合使用免疫抑制剂、存在其他感染是风湿免疫病患者发生CMV感染的危险因素[12,17-18]。本研究显示了部分类似的结果,合并其他感染、30 d内激素冲击联合免疫抑制剂治疗、ALB≤30 g/L为发生CMV感染的独立危险因素。结果的不一致性可能与研究人群免疫病种类、对激素及免疫抑制剂应用时间的限定以及对CMV感染定义不同有关。

表1 231例SLE患者CMV感染危险因素的单因素分析Table 1 Univariate analysis of risk factors of CMV infection in 231 patients with SLE
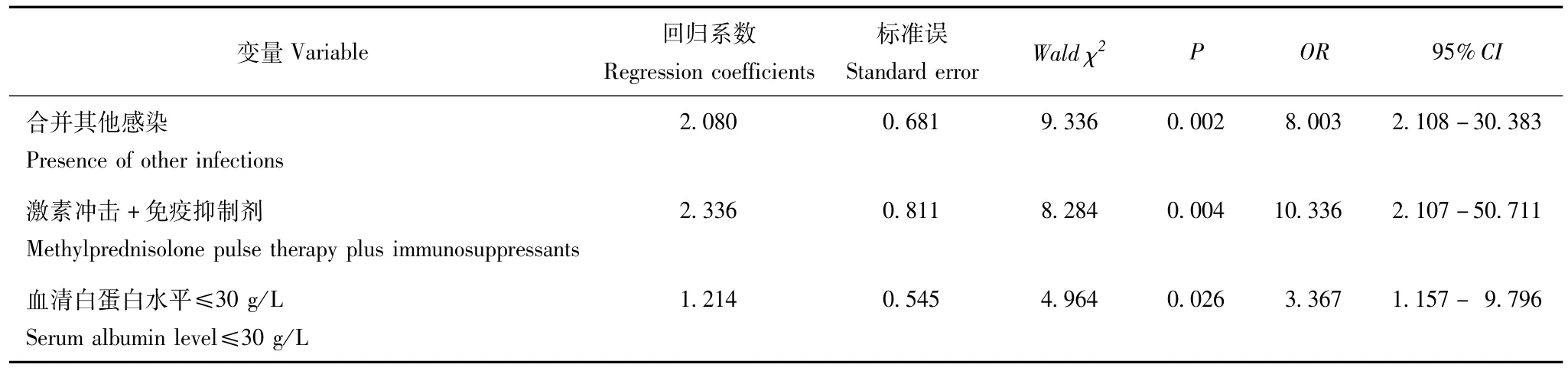
表2 231例SLE患者CMV感染危险因素的多因素分析Table 2 Multivariate analysis of risk factors of CMV infection in 231 patients with SLE
糖皮质激素及免疫抑制剂增加各种感染风险早已被充分认识。本研究低白蛋白水平是CMV感染的危险因素之一,Borthakur等[19]研究报道低血清白蛋白与抗cd52抗体治疗的白血病患者CMV再激活有关,低血清白蛋白可能反映了一种低营养状态或免疫状态。此外,本研究CMV感染组合并其他感染的比例明显高于非CMV感染组 (30.4%比14.6%,P=0.004),提示SLE合并活动性CMV感染者可能更易合并其他感染,一种可能原因是患者由于免疫病本身和免疫抑制治疗而免疫功能低下,容易出现各种感染;另一种原因是CMV再激活本身可导致免疫抑制,增加细菌、真菌感染的易感性[20]。在临床上对于SLE合并活动性CMV感染的患者需注意筛查有无其他病原体感染可能。
CMV病常与免疫病复发或活动的临床表现重叠,如何鉴别风湿免疫病患者CMV检测阳性是无症状感染还是CMV病是临床的难题。Kaneshita等[21]分析了80例风湿免疫病合并CMV感染患者发生CMV病的特点,临床表现中血细胞减少最常见,其次为肝炎、肺炎和胃肠道疾病,并发现pp65抗原阳性细胞计数>5.6个/105多形核白细胞是风湿免疫病患者发生CMV病的独立危险因素。与上述研究结果类似,本研究CMV病临床表现以血细胞减少最常见,其次为肝炎、发热、肺炎和胃炎,提示对于出现血细胞减少、肝功能异常和/或发热的SLE患者,除需考虑与原发病相关或与用药相关外,还需警惕合并CMV感染可能。但对哪些无症状CMV感染者会发展为CMV病,尚无明确答复。
对于有CMV感染导致的器官并发症患者,应积极给予抗病毒治疗,本研究经过1个月随访,抗病毒治疗组CMV DNA转阴率高于未治疗组 (67.6%比33.3%),抗病毒治疗组CMV pp65转阴率高于未治疗组 (22.0%比9.4%)。但10%以上的患者在抗病毒治疗后出现药物相关不良反应,包括骨髓抑制、肾功能损伤和胃肠道反应。且本研究部分SLE合并CMV感染患者未经抗病毒治疗监测CMV DNA载量或CMV pp65抗原会自发阴转,因此对于CMV DNA载量或CMV抗原计数偏低、无临床症状的CMV感染患者是否积极抗病毒治疗尚有疑问。在实体器官移植受者中对无症状CMV感染抢先治疗可降低CMV病的发生率和死亡率[22-23],对于SLE合并无症状CMV感染是否及早启动抗病毒治疗,以避免发展为CMV病有待进一步研究。
本研究有一定局限性,本研究为回顾性研究,部分确诊CMV感染的患者因为病历资料不全未纳入研究,因此对于研究对象的选择存在一定偏倚,一些可能与CMV感染有关的因素如淋巴细胞亚群等数据由于部分缺失未能进一步分析。
综上,本研究显示合并其他感染、近期激素冲击联合免疫抑制剂治疗、血清ALB≤30 g/L是SLE人群发生CMV感染的独立危险因素。当SLE患者有合并其他感染、近期激素冲击联合免疫抑制剂治疗、血清ALB≤30 g/L时,应加强对CMV感染的筛查,早期发现CMV感染有利于对患者整体病情的评估。

