SPK1基因转染脂肪间充质干细胞对实验性自身免疫性脑脊髓炎小鼠的治疗效果及对辅助性T细胞17/调节性T细胞平衡的影响
周 涛,许超平,肖 颖,张 倩,李 力
武汉科技大学附属武汉市普仁医院风湿免疫科,武汉430081
多发性硬化症 (multiple sclerosis,MS) 是一种由免疫介导的中枢神经系统慢性、炎症性脱髓鞘疾病,其病理学特征是多灶性炎症、脱髓鞘和神经元损伤[1]。实验性自身免疫性脑脊髓炎 (experimental autoimmune encephalomyelitis,EAE)与人类MS具有高度相似的病理和临床表现,为MS的最佳动物模型[2]。既往大量研究表明,MS或EAE的自身免疫反应主要由CD4+T细胞和T辅助细胞 (T helper cell,Th)1/2的失衡引起[3]。而最近的研究表明,Th17/调节性T(regulatory T,Treg)失衡是MS/EAE神经功能障碍机制中更重要的因素[4]。Th17细胞是介导炎症反应的CD4+T细胞亚群,其分泌介导炎症反应的独特促炎细胞因子会攻击髓鞘和轴突,继而导致MS/EAE发生;而Treg细胞是一种介导免疫耐受的负免疫调节细胞,上述病理过程可能受到Treg细胞的抑制,故Th17/Treg细胞平衡对MS/EAE的发生具有重要影响[5]。目前用于MS的治疗药物包括皮质类固醇和免疫抑制剂,但长期应用易导致某些严重不良反应,如抑郁症、感染、心脏毒性、恶心和贫血等[6-7]。因此MS治疗迫切需要具有高效率但不良反应小的新疗法。随着生物技术和细胞学的发展,细胞免疫疗法在临床应用中越来越受到关注。间充质干细胞 (mesenchymal stem cells,MSCs) 具有自我更新能力和多能性,对炎症和免疫反应具有调节作用,其可从脐带、骨髓以及脂肪等多种组织中获取,其中脂肪来源的MSCs(adipose derived MSCs,ADMSC) 的获取相对更容易。鞘氨醇激酶1(sphingosine kinase 1,SPK1)可催化产生鞘氨醇-1-磷酸 (sphingosine-1-phospate,S1P),大量研究表明,S1P信号传导协调许多重要的病理生理过程,包括细胞增殖、迁移和免疫调节[8]。基于此,本研究尝试用SPK1基因转染ADMSC,观察其对EAE小鼠的治疗效果及对Th17/Treg细胞平衡的影响。
材料和方法
主要试剂与抗体 表达绿色荧光蛋白基因 (adenovirus expressing green fluorescent protein, Ad-GFP) 的腺病毒由美国贝克曼医疗器械公司提供。携带SPK1基因的重组腺病毒 (adenovirus-sphingosine kinase 1,Ad-SPK1)在武汉科技大学生物实验室自行构建,最佳感染复数(multiplicity of infection,MOI) 为200。 脂肪组织取自本院风湿免疫科,所有捐赠者均已签署知情同意书,研究相关实验课题经本院伦理委员会批准;动物实验方案经本院动物伦理委员会批准,实验中尽量减少动物数量并尽量降低动物痛苦。完全弗氏佐剂 (complete Freund's adjuvant,CFA)和百日咳毒素购自 Sigma Chemical Co.(Saint Louis,MO, USA); 髓鞘少突胶质细胞糖蛋白35-55(myelin oligodendrocyte glycoprotein35-55,MOG35-55)由上海比奥实业发展有限公司合成,纯度大于95%;结核分枝杆菌H37RA购自Difco(Detroit,MI,USA); 酶联免疫吸附测定 (enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自 eBiosciences(San Diego,CA,USA);小鼠抗白细胞介素(interleukin,IL)-17A、小鼠抗 CD4抗原呈递细胞(antigen presenting cell,APC)、小鼠抗CD25异硫氰酸荧光素 (fluorescein isothiocyanate,FITC)、小鼠抗藻红蛋白叉头框蛋白p3(forkhead box protein p3 phycoerythrin,Foxp3 PE)、Foxp3染色缓冲液购自BD PharMingen(San Diego,CA,USA);兔抗小鼠IL-17A和兔抗小鼠Foxp3分别购自Abcam(Cambridge,UK)和Cell Signaling Technology(Boston,USA);兔多克隆抗β-微管蛋白购自Epitomics(Burlingame,USA);蛋白质印迹法 (Western blot)试剂盒购自Applygen Technologies Inc.(中国北京)。流式细胞仪购自Beckman Coulter Commercial Enterprise(China) Co., Ltd。
分离人ADMSC与ADMSC-SPK1制剂 采用负压柱塞技术从3名接受吸脂术的健康志愿者抽取腹部皮下脂肪组织各约50 ml,根据胶原酶消化方案分离和培养 ADMSC[9]。用 Ad-GFP以200 MOI转染 ADMSC,48 h后采用荧光显微镜和流式细胞术观察或检测GFP在细胞中的表达。用Ad-SPK1以200 MOI转染ADMSC,分别于24、48、72 h回收细胞培养上清液,采用ELISA法测定上清液中免疫反应性SPK1的浓度。Western blot:BCA法定量SPK1蛋白浓度,依据样品蛋白的浓度设定合适的上样量 (细胞样品10~20μg,组织样品20~40μg),5体积样品加1体积上样缓冲液,沸水煮样10 min,冷却至室温后离心,进行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转至聚偏二氟乙烯 (polyvinylidene fluoride,PVDF)膜,用含5%脱脂牛奶的含吐温-20的磷酸盐缓冲液封闭1 h,加一抗4℃孵育过夜,洗涤缓冲液清洗PVDF膜5次,6 min/次,将膜进一步与各自的辣根过氧化物酶偶联的第二抗体一起室温摇床孵育2 h,洗涤缓冲液清洗PVDF膜5次,6 min/次。采用灵敏化学发光检测试剂盒进行蛋白条带显影,ImageQuant TL 2005软件进行图像分析。
小鼠EAE诱导 SPF级健康雌性C57BL/6小鼠(6~8周龄,体重16~20 g)购自北京维通利华实验动物技术有限公司,共44只,实验前自适应喂养7 d。将具有EAE特征的小鼠用作人MS的动物模型。EAE诱导:将小鼠麻醉后,于侧腹部采用200μg经4 mg/ml CFA乳化制备的MOG35-55-CFA(2 mg/ml)进行免疫,其中第0天和第7天的CFA按1:1比例添加结核分枝杆菌H37Ra。另外,分别于第0天和第1天经腹膜内注射200 ng百日咳毒素。免疫后每天监测EAE临床症状,并按如下量表进行神经功能缺损评分 (0~5分):0分:无临床症状;1分:尾巴松弛,步态蹒跚;2分:共济失调伴局部肢体麻痹;2.5分:单侧后肢瘫痪;3分:单侧后肢瘫痪,另一侧后肢部分麻痹;3.5分:双后肢瘫痪;4分:双后肢瘫痪并累及前肢;5分:濒死或死亡。
分组治疗将44只小鼠随机分配到4个治疗组。(1) 正常对照 (normal control, NC) 组 (11只): 采用等体积生理盐水取代MOG35-55-CFA和百日咳毒素模拟免疫,后续注射等容量生理盐水模拟治疗;(2)模型组 (EAE组,11只):诱导EAE后注射等容量生理盐水模拟治疗;(3)ADMSC组 (11只):EAE免疫后,分别于第7、14、21、28免疫后天数 (days post immunization,dpi) 经侧尾静脉注射 ADMSC(5.5×106/ml)100μl; (4) ADMSC-SPK1组 (11只): EAE免疫后,经腹膜内注射ADMSC-SPK1 (5.5×106/ml) 100μl。 至40 dpi时,NC组与ADMSC-SPK1组小鼠未发生死亡,EAE组死亡3只,ADMSC组死亡1只。将EAE组剩余8只及其他组各随机选择8只用于实验观察。
脑与脊髓的病理学观察 于40 dpi时处死小鼠,解剖脑组织和脊髓,采用4%甲醛固定,石蜡包埋切片,HE染色以评估炎性细胞浸润。炎性细胞浸润评分标准:0分:没有炎性细胞;1分:少数散在的炎性细胞;2分:炎性细胞聚集浸润在血管的周围;3分:广泛的血管套形成并延伸入邻近实质区域,或实质区域浸润而无明显的血管套形成。取小鼠脑和脊髓腰膨大处组织用环氧丙烷处理,渗透并包埋在液体树脂中,Leica EM超薄切片机切片,在透射电子显微镜 (日立H-7650,日本)下观察超结构和脱髓鞘变化,在每组的大脑 (白质)和脊髓中选择10个高倍 (×10 000)视野进行分析。脱髓鞘评分标准:0分:无髓鞘脱失;1分:1个小的脱髓鞘病灶;2分:2~3个脱髓鞘小病灶;3分:1~2个大的脱髓鞘病灶;4分:广泛髓鞘脱失且脱髓鞘面积大于白质总面积的20%。每只小鼠的炎性细胞浸润评分与脱髓鞘评分取脑与脊髓的平均值。
小鼠脑组织Th17/Treg相关炎症指标检测将每只小鼠的脑称重并用冷生理盐水均浆,3000 r/min(转子半径10 cm)离心20 min,收获上清液,采用ELISA及相关标准曲线测定细胞因子IL-17A、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α) 和 IL-6 的浓度, 实验严格按照制造商提供的说明书进行。
脑和脊髓组织中IL-17A和Foxp3蛋白表达检测根据所用试剂制造商规定的程序进行蛋白质提取和定量。取20μg蛋白样品进行10%聚丙烯酰胺凝胶电泳,电转移至PVDF膜上,加抗IL-17A抗体 (1:1000)与抗Foxp3抗体 (1:2000), 内参选用 β-微管蛋白 (1:50 000),在封闭溶液中于4℃孵育过夜。将一抗孵育后的膜取出用缓冲液洗膜3次,10 min/次,辣根过氧化物酶标记的羊抗兔二抗IgG(1:3000)室温孵育1 h,用缓冲液洗膜3次,10 min/次,洗膜后用免疫印记化学发光试剂显色,数字化多功能图像增强化学发光系统曝片,采用Image-Pro Plus软件的图像分析确定条带的积分光密度。
流式细胞术分析小鼠脾脏免疫细胞取适量小鼠脾脏组织样本,放置到400目细胞筛网中 (筛网放于100 mm细胞培养皿中),磷酸缓冲盐溶液 (phosphate buffer saline,PBS)浸没,用10 ml注射器芯捣碎研磨,将研磨液收集于15 ml离心管中,4℃1500 r/min(转子半径10 cm)离心5 min,弃上清。PBS洗1次,再加3 ml PBS重悬细胞并混匀,细胞计数,取1×107个细胞,各两份 (分别用于Th17与Treg细胞含量分析),4℃1500 r/min(转子半径10 cm)离心5 min,弃上清。
Th17细胞标记和检测:使用含GolgiPlug TM(BD Pharmingen,San Jose,CA,USA) 的固定/透化缓冲液避光孵育,用小鼠抗CD4荧光素FITC抗体染色细胞,加入PE缀合的抗干扰素-γ(interferon-γ,IFN-γ) 和荧光标记链霉亲和素缀合的抗IL-17室温孵育30 min,完成后加入2 ml PBS,4℃1500 r/min(转子半径10 cm)离心5 min,弃上清,加入500μl PBS重悬细胞,移入流式管上机检测。
Treg细胞标记和检测:采用Pharmingen染色缓冲液染色细胞,加入PE缀合的抗Foxp3和APC缀合的抗CD25,4℃避光孵育30 min,完成后加1 ml透化缓冲液洗涤细胞,加入500μl PBS重悬细胞,移入流式管上机检测。
统计学处理采用IBM SPSS Statistics 19软件和Prism6.0软件 (GraphPad Software, San Diego, CA, USA)进行统计学分析,将数据进行正态性检验,如符合正态分布,数据以均数±标准差表示,细胞或动物实验结果的组间比较采用单因素方差分析 (ANOVA),组内定量资料间的两两比较用Bonferrioni法;如不符合正态性分布,数据以M(P25,P75)表示,组间比较采用Kruskal-Wallis秩和检验,组内定量资料间采用Bonferroni法检验。P<0.05为差异有统计学意义。
结 果
SPK1对ADMSC的转染效率荧光显微镜与流式细胞术显示,Ad-GFP转染ADMSC后超过90%的细胞表达GFP(图1A、1B);ELISA测定结果显示,Ad-SPK1转染ADMSC后高效表达SPK1蛋白,SPK1在细胞培养上清液中24 h积累至约70 ng/ml(t=13.242,P=0.024),48 h达到峰值约130 ng/ml(t=20.544, P=0.005),72 h略下降至约125 ng/ml(t=20.013, P=0.006),ADMSC组与转染Ad-GFP组的SPK1基本稳定维持在约15 ng/ml(图1C);Western blot法检测SPK1表达的结果与ELISA法检测结果具有良好一致性 (图1D)。
小鼠神经功能评估自13 dpi开始,部分小鼠陆续出现EAE症状,如尾巴松弛、步态蹒跚,神经功能缺损评分自16~24 dpi急剧升高,部分小鼠出现瘫痪甚至死亡;自22 dpi开始,EAE组评分显著高于ADMSC组(t22dpi=7.53, P=0.013; t23dpi=7.83, P=0.031;t24dpi=8.55, P=0.008; t25dpi=11.53, P=0.018;t26dpi=13.64, P=0.022; t27dpi=10.54, P=0.021;t28dpi=12.06, P=0.014; t29dpi=11.95, P=0.004;t30dpi=10.38, P=0.011; t31dpi=14.06, P=0.013;t32dpi=7.95, P=0.031; t33dpi=11.06, P=0.006;t34dpi=11.76, P=0.037; t35dpi=10.66, P=0.022;t36dpi=10.04, P=0.001; t37dpi=11.14, P=0.016;t38dpi=11.21, P=0.021; t39dpi=10.89, P=0.006;t40dpi=10.32, P=0.022) 和ADMSC-SPK1组 (t22dpi=10.02, P=0.000; t23dpi=11.83, P=0.010; t24dpi=13.74, P=0.006; t25dpi=25.97, P=0.024; t26dpi=28.05, P=0.030; t27dpi=23.66, P=0.013; t28dpi=21.06, P=0.008; t29dpi=19.77, P=0.009; t30dpi=21.86, P=0.031; t31dpi=18.47, P=0.014; t32dpi=19.04, P=0.006; t33dpi=20.65, P=0.016; t34dpi=17.66, P=0.008; t35dpi=17.464, P=0.007; t36dpi=15.20, P=0.000; t37dpi=16.05, P=0.026; t38dpi=16.73, P=0.017; t39dpi=16.93, P=0.009; t40dpi=16.04,P=0.016),自19 dpi开始,ADMSC组评分显著高于ADMSC-SPK1组 (t19dpi=5.56,P=0.014;t20dpi=6.86, P=0.003; t21dpi=7.04, P=0.034; t22dpi=7.88, P=0.012; t23dpi=7.57, P=0.005; t24dpi=7.95, P=0.008; t25dpi=8.54, P=0.011; t26dpi=7.44, P=0.016; t27dpi=12.33, P=0.020; t28dpi=10.76, P=0.002; t29dpi=15.65, P=0.006; t30dpi=10.03, P=0.016; t31dpi=8.64, P=0.020; t32dpi=2.54, P=0.014; t33dpi=9.05, P=0.011; t34dpi=9.65, P=0.015; t35dpi=9.06, P=0.019; t36dpi=9.12, P=0.031; t37dpi=9.66, P=0.006; t38dpi=9.43, P=0.006; t39dpi=9.43, P=0.011; t40dpi=9.43, P=0.022) (图2)。
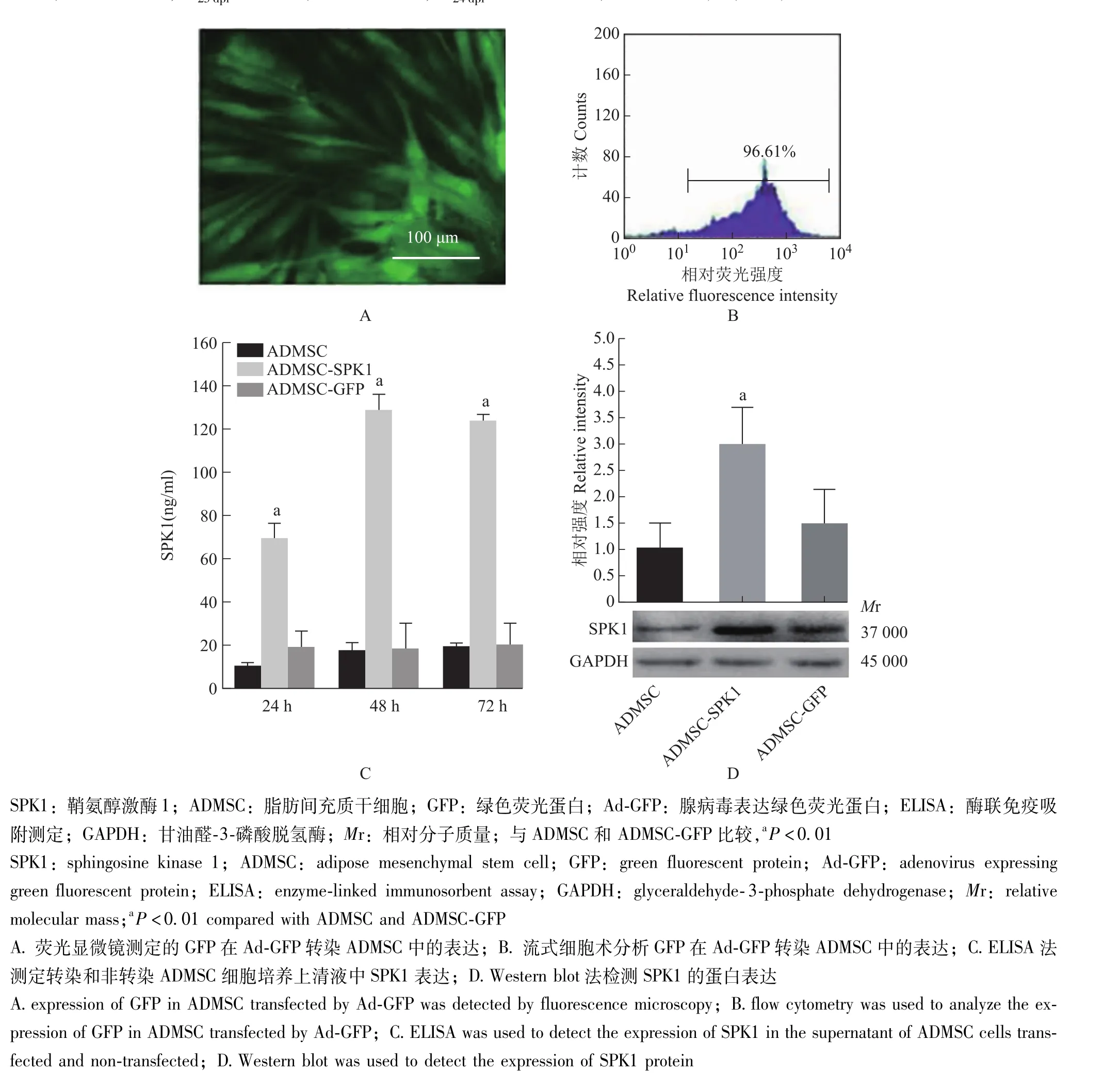
图1 SPK1在体外转导的ADMSC中的表达Fig 1 Expression of SPK1 in ADMSC transduced in vitro
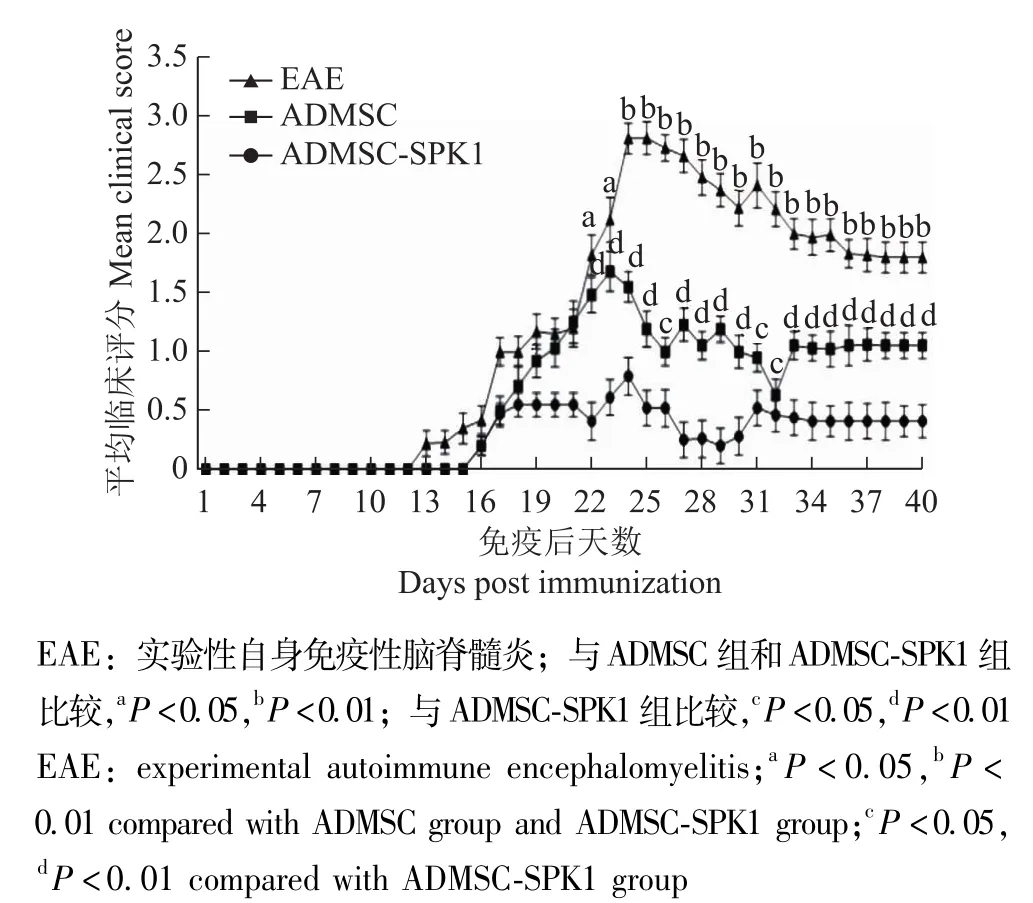
图2 小鼠神经功能缺损评分Fig 2 Neurological deficit scoring in mice
小鼠脑和脊髓的病理改变40 dpi时,小鼠脑和脊髓组织的HE染色结果显示,NC组无明显炎性细胞浸润,EAE组发生严重炎性细胞浸润,在小血管周围已形成 “套管状”结构,ADMSC组和ADMSC-SPK1组炎性细胞浸润显著减轻 (图3A);小鼠脑和脊髓中髓鞘和轴突的超微结构电子显微镜观察结果显示,NC组髓鞘和轴突均正常,EAE组髓鞘脱失严重,相同视野下髓鞘数目明显减少,完整性降低,轴突明显水肿或崩解,ADMSC组与ADMSC-SPK1组脱髓鞘和轴突损伤得到改善 (图3B);EAE组小鼠脑和脊髓炎性细胞浸润评分和脱髓鞘评分均高于NC组 (P=0.000,P=0.005),ADMSC组小鼠脑和脊髓炎性细胞浸润评分和脱髓鞘评分均低于EAE组 (P=0.021,P=0.015),ADMSC-SPK1组小鼠脑和脊髓炎性细胞浸润评分和脱髓鞘评分均低于 ADMSC组 (P=0.024, P=0.013) (表1)。
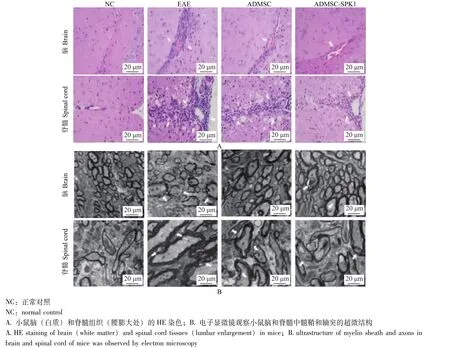
图3 小鼠组织病理学与超微结构病理学分析Fig 3 Histopathological and ultrastructural pathological analysis of mice
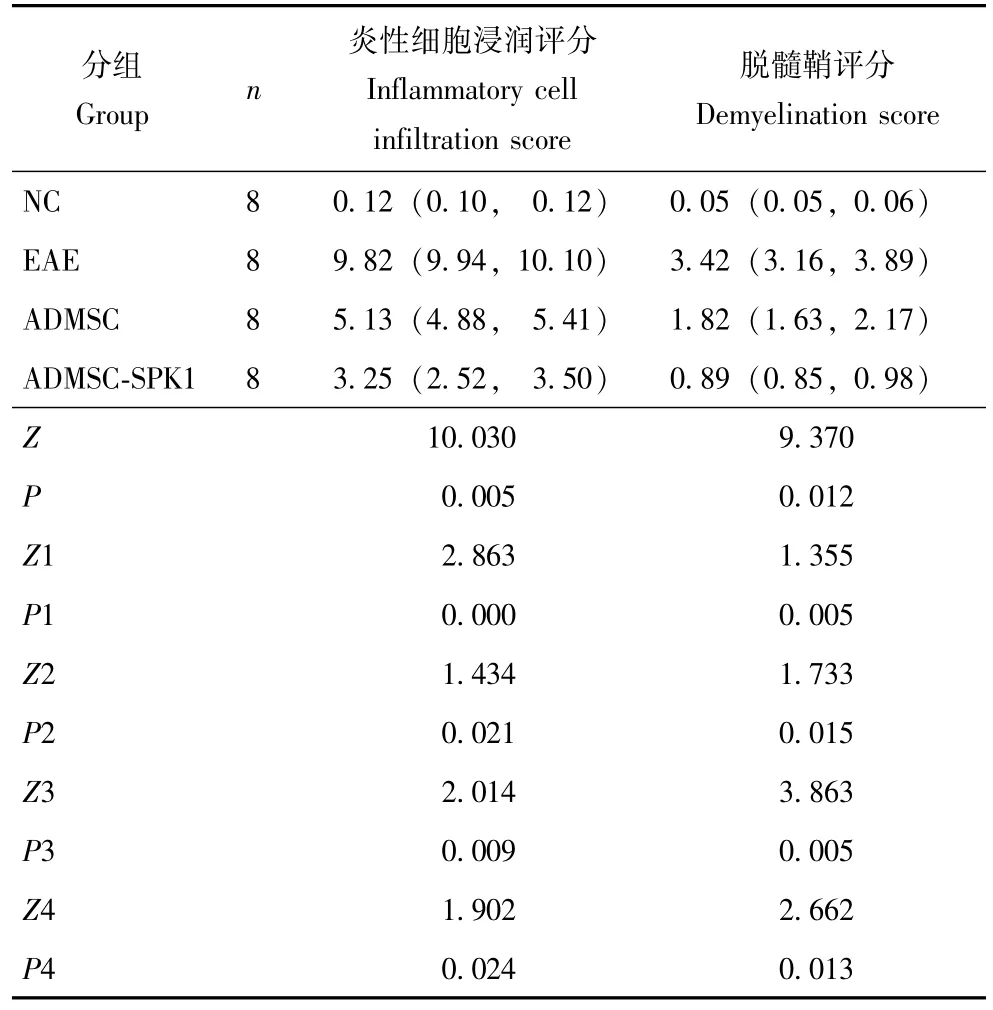
表1 小鼠脑和脊髓炎性细胞浸润和脱髓鞘评分的比较 [M(P25,P75),分]Table 1 Comparison of inflammatory cell infiltration and demyelination score in brain and spinal cordof mice[M (P25, P75), score]
小鼠脑组织Th17/Treg相关炎症指标分析40 dpi时,与EAE组比较,ADMSC组和ADMSC-SPK1组的脑组织IL-17A(Z=1.021,P=0.017;Z=1.193,P=0.009)、 TNF-α (Z=2.540, P=0.004; Z=3.005, P=0.006)、 IL-6 (Z=3.364, P=0.008; Z=3.364,P=0.006)水平均显著降低,与ADMSC组比较,ADMSC-SPK1组的脑组织IL-17A、TNF-α水平显著降低 (Z=1.223, P=0.011; Z=2.364, P=0.010),IL-6水平差异无统计学意义 (Z=1.970,P=0.420)(表2)。
小鼠脑和脊髓组织中IL-17A和Foxp3的表达 40 dpi时,与EAE组比较,小鼠脑和脊髓组织中IL-17A在ADMSC组的表达水平显著降低 (t=10.323,P=0.013;t=7.422,P=0.008),且ADMSC-SPK1组显著低于ADMSC组 (t=14.244, P=0.017; t=16.865, P=0.006);Foxp3在ADMSC组的表达水平显著升高 (t=14.544,P=0.008; t=9.420, P=0.002), 且 ADMSC-SPK1组显著高于ADMSC组 (t=9.654,P=0.005;t=11.535,P=0.009) (图4)。
小鼠脾脏Th17与Treg细胞含量40 dpi时,与EAE组和ADMSC组比较,ADMSC-SPK1组小鼠脾脏中的IL-17+IFN-γ+T细胞比例降低 (t=6.61 P=0.031;t=14.54, P=0.005), CD25+Foxp3+Treg细胞比例升高 (t=3.42, P=0.012; t=17.37, P=0.003)(图5)。
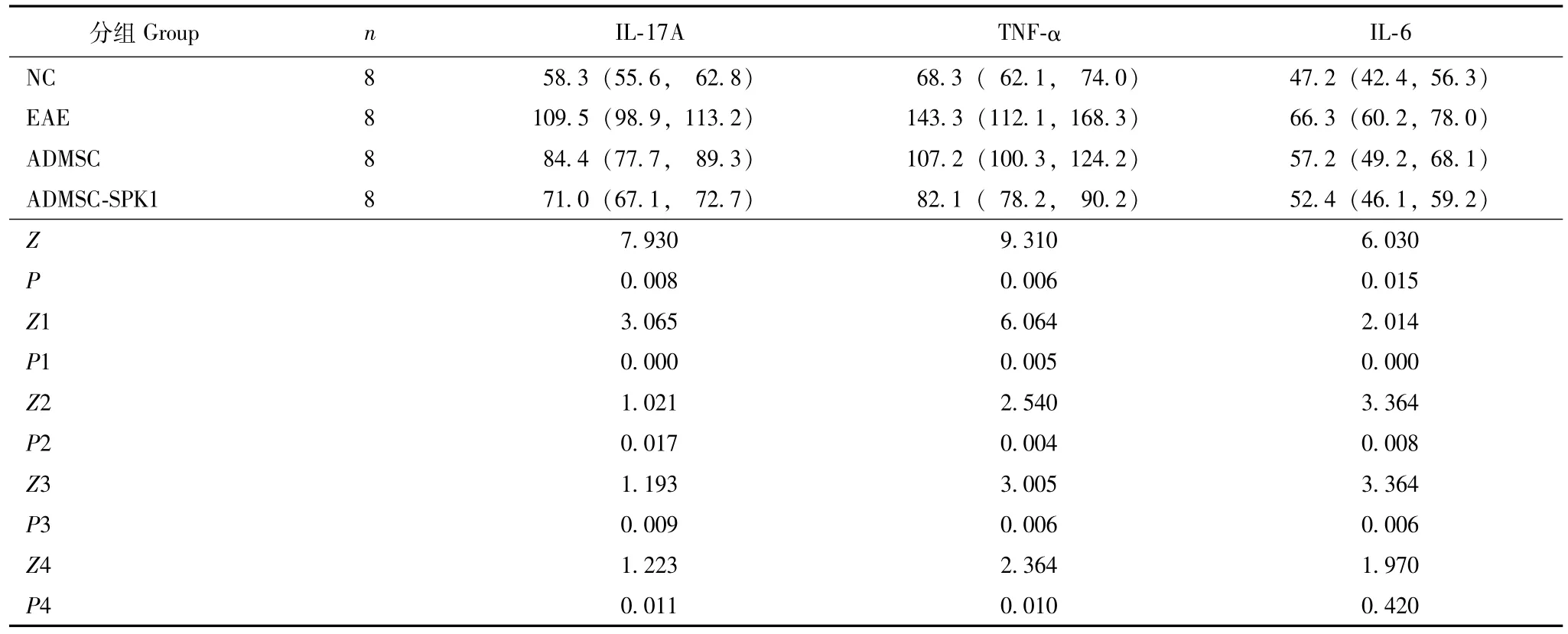
表2 3组小鼠脑组织辅助性T细胞17/调节性T细胞相关炎症指标水平比较 [M(P25,P75),ng/L]Table 2 Comparison of T helper cell 17/regulatory T cells-related inflammatory markers in brain tissue of three groups of mice[M (P25, P75), ng/L]
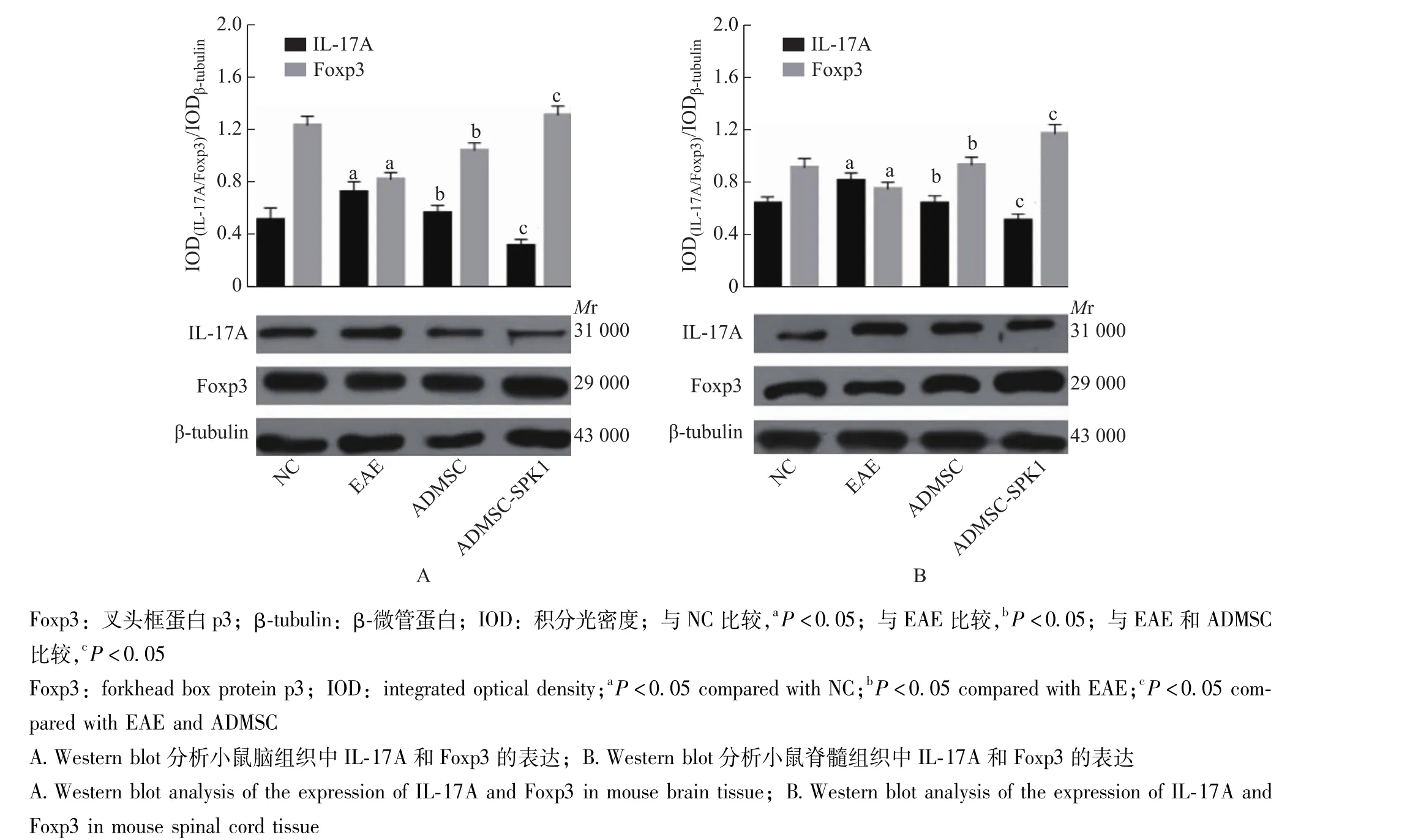
图4 Western blot分析小鼠脑和脊髓组织中IL-17A和Foxp3的表达Fig 4 Western blot analysis of IL-17A and Foxp3 expression in brain and spinal cord of mice
讨 论
近年来,MS的治疗相关研究已聚焦干细胞移植上,包括造血干细胞[10]、骨髓基质细胞[11]、神经前体细胞[12]和人羊膜间充质干细胞等[13-14]。骨髓间充质干细胞的效率和安全性已在MS的临床治疗中得到证实[15]。而早在2001年,Zuk等[16]的研究就已表明,从人脂肪组织分离和培养获得的梭形细胞是多能干细胞,即ADMSC,可能与骨髓间充质干细胞具有几乎等效的作用。此外,ADMSC还具有免疫原性低的特点,不会导致出现异种移植或同种异体移植排斥[17]。另有研究显示,未经基因修饰的脐带间充质干细胞治疗疗效不及同样未经基因修饰的ADMSC[18]。以上结论为本研究选择ADMSC作为Ad-SPK1腺病毒转染载体的重要原因。另外,SPK1也与MS有关[19]。SPK1/S1P受体信号通路参与许多细胞类型的炎症反应调节。反应性星形胶质细胞参与MS中神经炎症的发展和维持。MS病变中巨噬细胞上S1P受体亚型3(sphingosine-1-phospate 3,S1P3)和SPK1表达上调反应性星形胶质细胞和SPK1的表达。用促炎症刺激脂多糖 (lipopolysaccharide,LPS)处理原代星形胶质细胞的培养物后,S1P3和SPK1的mRNA和蛋白质表达增加。通过SPK活性测定证实LPS诱导的SPK激活,并且可由SPK抑制剂阻断。当星形胶质细胞被LPS激活时,SPK1/S1P3信号轴被上调,这种信号途径可能在星形胶质细胞活化的建立和维持中发挥作用。本研究的细胞分离及培养实验显示,Ad-GFP转染ADMSC后超过90%的细胞表达GFP,且Ad-SPK1转染ADMSC后高效表达SPK1蛋白,提示Ad-SPK1对ADMSC具有高转染效率。以上为采用ADMSC-SPK1制剂治疗EAE提供了基础保障。
本研究结果显示,经MOG35-55诱导的EAE在病理学上表现为神经功能缺损评分显著升高,脑与脊髓组织发生大量炎性细胞浸润,并发生与脱髓鞘相关的神经缺陷,这与既往报道一致[20]。与EAE组比较,ADMSC组和ADMSC-SPK1组神经功能、炎症浸润与脱髓鞘均获得改善,其中ADMSC-SPK1组效果更显著,表明ADMSC对EAE小鼠具有神经保护作用,且ADMSC-SPK1在结合了ADMSC和SPK1的双重生物效应后的效果更好。
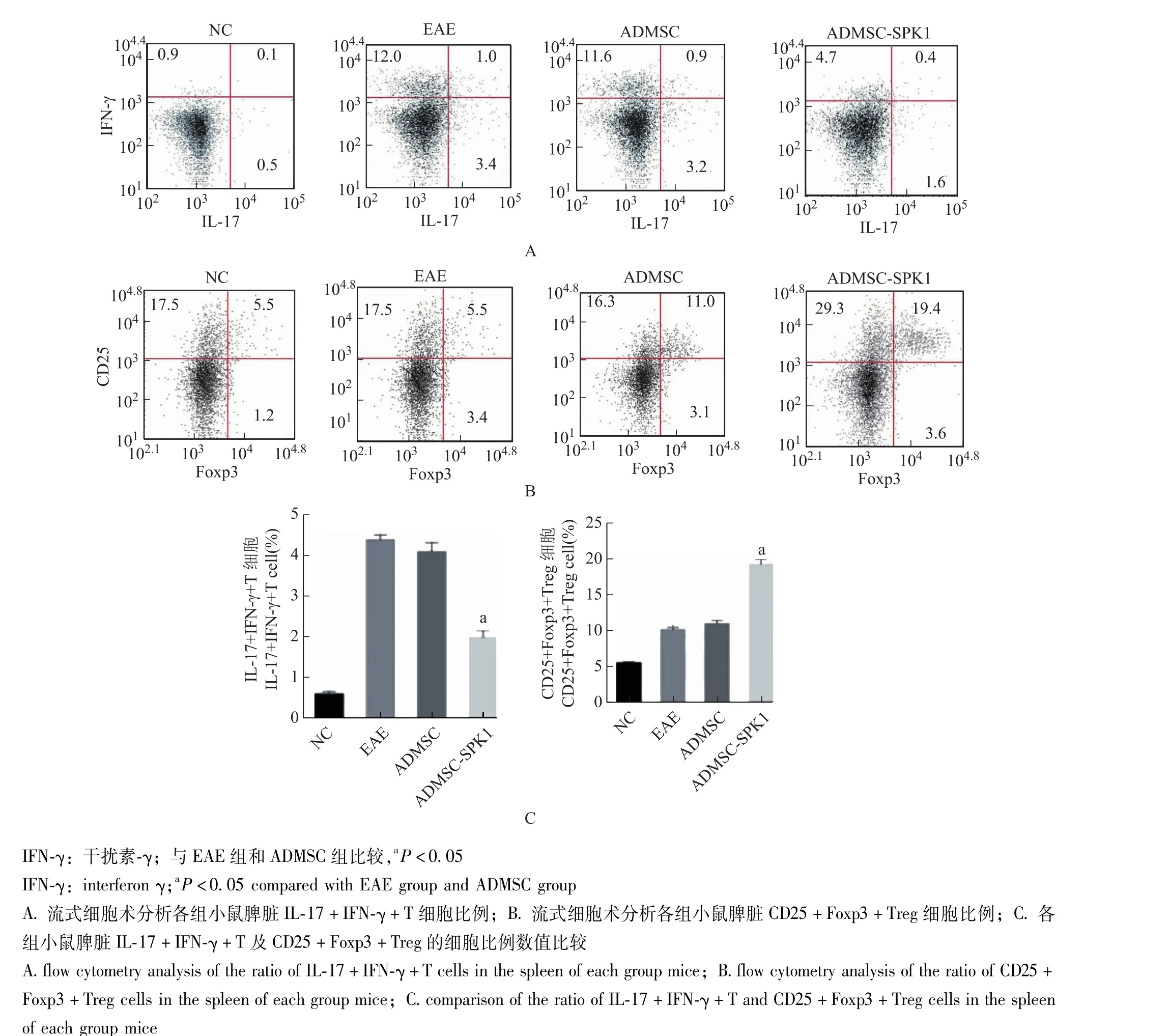
图5 流式细胞术分析小鼠脾脏IL-17+IFN-γ+T及CD25+Foxp3+Treg的细胞比例Fig 5 Flow cytometry of IL-17+IFN-γ+T and CD25+Foxp3+Treg cells in mouse spleen
在MS/EAE发病过程中,Treg细胞在维持免疫耐受和调节效应T细胞介导的自身免疫反应中发挥重要作用[21-22]。Th17亚群细胞是介导MS/EAE中免疫应答和脱髓鞘的主要效应细胞;另一方面,CD4+CD25+Foxp3+Treg细胞作为自身免疫和组织损伤过程中的保护因子,也是各种治疗方法的靶标[23]。故为了分析ADMSC-SPK1的神经保护机制,本研究进一步考察小鼠不同脏器或组织中的Th17/Treg细胞平衡改变情况。在40 dpi时,Western blot实验结果显示IL-17A和Foxp3在小鼠脑和脊髓组织中的表达具有一致性,均为与EAE组比较,IL-17A在ADMSC组和ADMSC-SPK1组的表达水平显著降低,且ADMSC-SPK1组显著低于ADMSC组,Foxp3在ADMSC组和ADMSC-SPK1组的表达水平显著升高,且ADMSC-SPK1组显著高于ADMSC组;流式细胞术分析结果显示与EAE组和ADMSC组比较,ADMSCSPK1组小鼠脾脏中的IL-17+IFN-γ+T细胞比例降低,CD25+Foxp3+Treg细胞比例升高。以上结果表明,EAE小鼠中出现不平衡的Th17/Treg比率,即Th17/Treg比率升高,而通过ADMSC移植尤其是ADMSC-SPK1移植后可显著降低Th17/Treg比率。
此外,本研究还显示,在小鼠经诱导发生EAE后,其脑组织 Th17/Treg相关炎症指标 IL-17A、TNF-α、IL-6水平显著升高。IL-17A是IL-17家族的主要功能成员,是由Th17细胞产生的促炎细胞因子[24]。TNF-α和IL-6均可能与EAE有关,有研究通过尸检发现MS患者在活动性MS病变部位的TNF-α水平升高,且脑脊液和血清中的TNF-α水平与病变的严重程度相关[25]。关于IL-6,研究显示来自MS患者的B细胞比来自健康供体的B细胞产生更多该细胞因子,且在B细胞耗竭治疗后从患者中分离的B细胞重新显示出正常的IL-6水平[26]。此外,IL-6已被证明对EAE发生发展至关重要[27]。这些炎症细胞因子通过攻击髓鞘和轴突,导致脱髓鞘和轴突损伤并促进MS/EAE发生。故推测ADMSC或ADMSC-SPK1能抑制Th17细胞增殖,从而减少以上炎症细胞因子的释放并降低中枢神经系统损伤。
综上,SPK1转染ADMSC能有效缓解EAE小鼠中枢神经系统炎症浸润和髓鞘脱失,发挥显著的神经保护作用,且该效果优于未经SPK1转染的ADMSC,其机制可能与ADMSC-SPK1能显著降低EAE小鼠Th17/Treg细胞比率并减少相关炎症细胞因子的释放有关。本研究为MS提供了一种更为高效且易行的治疗途径。

