超声引导下射频消融治疗T1bN0M0期甲状腺乳头状癌的短期疗效分析
肖 静,兰 雨,阎 琳,张明博,张 艳,谢 芳,宋 青, 罗渝昆,唐 杰
1南开大学医学院,天津300071
2中国人民解放军总医院第一医学中心超声诊断科,北京100853
甲状腺乳头状癌 (papillary thyroid carcinoma,PTC)是甲状腺癌中最常见的病理类型,占甲状腺癌的85%~90%[1]。过去几十年PTC在全球范围内的发病率呈不断上升趋势,我国每年以20%的速度增长[1]。目前PTC的传统治疗方式为手术,然而手术可引起严重并发症,如持续性喉返神经损伤、甲状旁腺功能减退等,从而影响患者的生活质量[2]。近年热消融技术因其微创、安全有效等优势在甲状腺肿瘤治疗中发挥着越来越大的作用。目前热消融对甲状腺癌的治疗主要局限于甲状腺微小乳头状癌 (papillary thyroid microcarcinoma, PTMC)[3-5], 并且取得了较好的疗效;然而,关于热消融治疗T1bN0M0期PTC中的相关报道罕见。本研究主要探讨超声引导下射频消融 (radiofrequency ablation,RFA) 治疗T1bN0M0期PTC的短期疗效,从而为不适合手术切除患者或拒绝手术患者提供一种备选治疗方案。
对象和方法
对象回顾性分析2014年4月至2019年1月在中国人民解放军总医院行超声引导下RFA治疗的PTC患者,入组标准为:(1)甲状腺实质内单发结节,最大径为1~2 cm;(2)影像学检查无甲状腺被膜外侵犯,无颈部淋巴结及远处转移;(3)消融前经超声引导下穿刺活检证实为PTC; (4)随访时间至少12个月;(5)患者要求消融治疗或因手术麻醉风险高等不适合手术者。排除标准为:(1)患者有严重心肺疾病、凝血功能障碍等;(2)消融前超声引导下穿刺活检证实为侵袭亚型PTC或其他类型肿瘤;(3)消融前超声检查显示颈部淋巴结转移或甲状腺被膜外侵犯;(4)随访时间小于12个月。最终共纳入89例患者,其中男16例、女73例,平均年龄为 (41.6±10.1) 岁 (21~72岁)。 所有患者穿刺及消融前均签署知情同意书。本研究通过中国人民解放军总医院伦理委员会批准 (编号:S2019-211-01)。
消融前评估所有患者消融前均行超声和超声造影检查 (contrast-enhanced ultrasonography,CEUS), 使用仪器如下:西门子512超声诊断仪,探头中心频率为7 MHz;西门子S2000超声诊断仪,探头中心频率为8 MHz;迈瑞Resona 7超声诊断仪,探头频率为5.6~10 MHz。二维超声测量结节大小并计算体积,体积 (ml)计算公式为: 长 (cm)×宽(cm)×高(cm)×0.524。CEUS观察甲状腺结节的增强模式以及甲状腺被膜的连续性。
消融治疗过程使用德国Olympus公司生产的Celon AG型射频消融系统,双极射频针100-T15,电极裸区长度为15 mm。消融过程中应用西门子512超声诊断仪进行超声引导,探头中心频率为7 MHz。
患者取仰卧位,颈部后伸。常规消毒铺巾,1%盐酸利多卡因局部麻醉。如肿瘤与气管、食管、喉返神经等重要结构之间的距离<5 mm时,将生理盐水和1%盐酸利多卡因的混合液注入甲状腺被膜周围以形成至少1 cm的隔离带,从而防止邻近重要结构受到热损伤。超声引导下将18 G射频针置入结节深部,设定输出功率为3 W,启动射频仪,开始消融。如果5~10 s内射频针尖端瞬时未形成高回声带,则提高输出功率。消融过程使用经峡部入路的移动消融法。为了防止肿瘤的残留或复发,采用扩大消融法,即强回声的覆盖范围超过肿瘤边界至少3 mm[6]。消融后即刻行CEUS检查,如有残留,及时补充射频消融;如消融区无增强范围完全超过原病灶范围终止消融。消融后密切观察1~2 h,无声音嘶哑、局部出血等并发症时方可离开。
随访消融术后1、3、6、12个月及随后每半年行超声和CEUS检查。测量消融灶大小,并计算体积及体积缩小率 (volume reduction rate,VRR);VRR(%)=(消融前体积-随访时体积)/消融前体积×100%。CEUS观察消融灶内有无增强评估是否消融完全及有无复发。消融术后3~6个月时对消融灶中心部、消融灶边缘处及消融灶邻近正常甲状腺组织随机行超声引导下粗针穿刺活检 (每部位各1针)以排除复发。随访时还重点观察颈部有无可疑淋巴结,一旦发现行超声引导下穿刺活检明确诊断。所有患者每隔1年行胸部CT检查以排除远处转移。
统计学处理采用SPSS 21.0软件进行统计分析。计量资料采用均数±标准差表示,计数资料用n(%)表示。消融前、后病灶体积变化配对样本比较采用Wilcoxon符号秩和检验。各时间点与 “消融前”体积的比较应用Bonferroni法进行多重检验校正。P<0.05为差异有统计学意义。
结 果
射频消融结果消融过程中平均消融时间为 (295.8±120.5) s(39~760 s), 平均输出功率为 (6.3±1.8)W (3~9 W), 平均总能量为 (1.8±0.8) KJ(0.2~5.5 KJ)。术后即刻CEUS显示所有肿瘤完全消融。
疗效评估平均随访时间为 (18.8±7.3)个月(12~48个月)。 消融前病灶体积为 (0.74±0.38) ml,消融后即刻和1个月体积分别为 (2.52±1.21)ml和(1.11±0.56)ml,与消融前体积相比显著增大 (Z=-8.193, P<0.0001; Z=-5.217, P<0.0001); 消融后3个月体积为 (0.61±0.39)ml,与消融前体积相比显著缩小 (Z=-3.397,P=0.0001);随后消融灶体积不断缩小,消融后6、12、18、24、30个月体积分别为 (0.28 ±0.25) ml、 (0.12 ±0.17) ml、 (0.06 ±0.12) ml、 (0.03 ±0.05) ml、 (0.005 ±0.015) ml,与消融前体积相比差异有统计学意义 (Z=-6.984,P<0.0001; Z=-7.528, P<0.0001; Z=-5.303,P<0.0001; Z=-4.015, P<0.0001; Z=-2.803,P=0.005),经Bonferroni法校正后各随访点差异仍有统计学意义。
消融术后1、3、6、12、18、24、30个月的VRR分别为 (-76.9±129.1)%、 (6.5±75.3)%、 (58.5±43.2)%、 (82.0±28.0)%、 (89.0±20.5)%、 (93.2±12.0)%、(99.2±2.3)%。VRR在术后1个月时为负值,3个月时变为正值,且不断增大。随访期间,共有38个消融灶 (42.7%)消失 (图1)。消融术后3个月1例 (1.1%)患者同侧颈部Ⅳ区发现可疑淋巴结,超声引导下穿刺活检证实为转移;术后6个月对消融灶进行穿刺时2例 (2.2%)患者消融灶周边发现恶性细胞。随后对这3例患者成功地进行了RFA治疗。
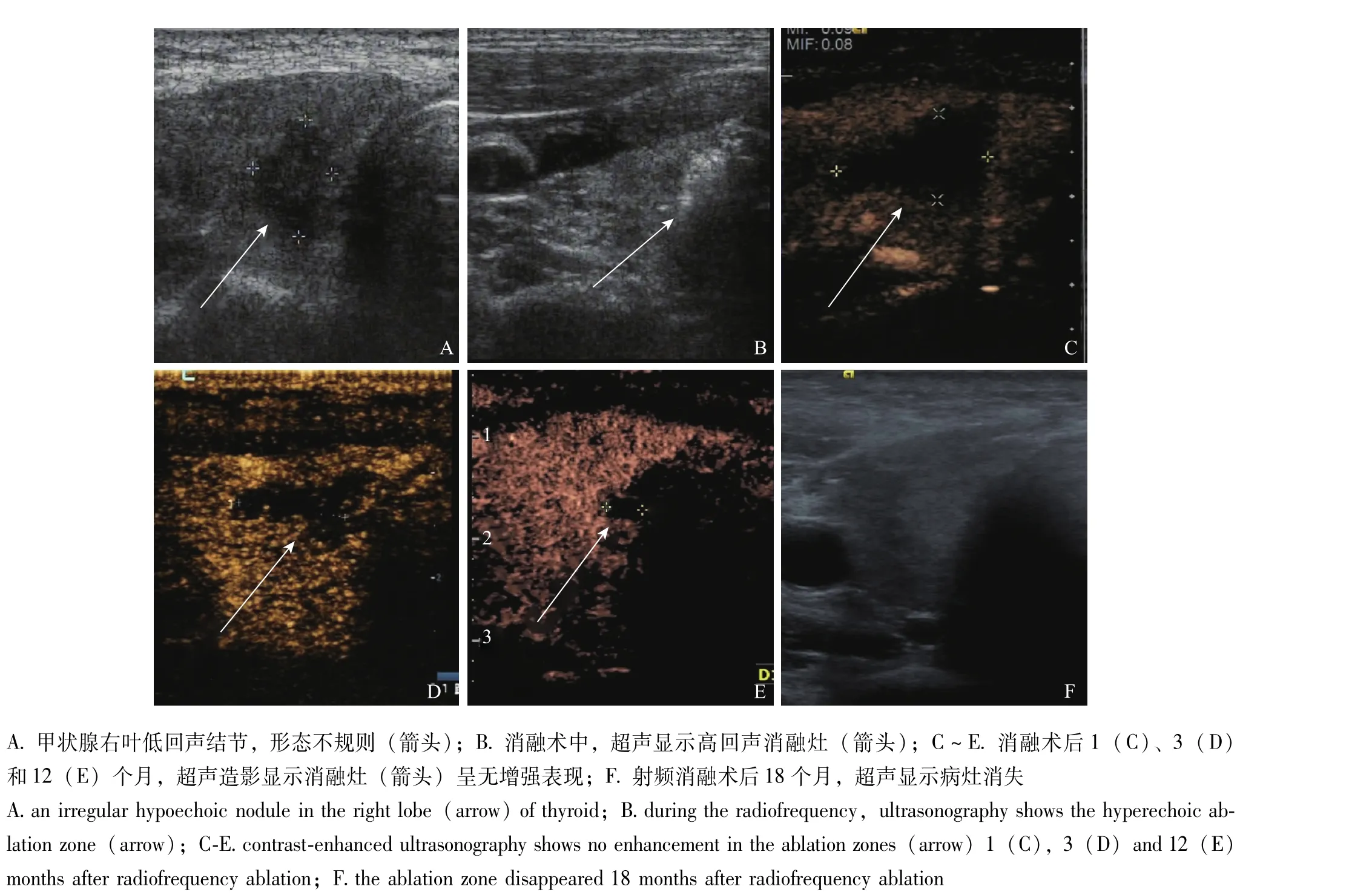
图1 射频消融治疗甲状腺乳头状癌的超声图像Fig 1 Ultrasonography of papillary thyroid cancer before, during, and after radiofrequency ablation
并发症消融过程顺利,未出现喉返神经损伤、甲状旁腺功能减退、肿瘤破裂等严重并发症,无血肿、皮肤烧伤等轻微并发症的发生。消融术后有2例患者诉有疼痛,口服止痛药后缓解。
讨 论
近几十年PTC的发病率不断增加,但其预后较好(10年生存率高达98%),且死亡率保持不变 (约为0.5/10万)[7-8]。因PTC为惰性肿瘤,其治疗方式存在争议。目前PTC的传统治疗方式为外科手术,然而手术过程中有可能损伤喉返神经及甲状旁腺[9],从而降低患者的生活质量。为了减少不必要的手术治疗,日本和美国甲状腺指南建议对低危的PTMC进行主动监测[10-11]。然而,有研究显示主动监测过程中8%的PTMC增大以及3%的PTMC发生颈部淋巴结转移[12],这增加了患者的心理负担。
近年来超声引导下热消融技术因其微创、安全有效等优势得到了甲状腺结节患者的认可,并且有专家共识提议将热消融技术作为甲状腺良性结节的一线治疗方法[13]。多项研究显示超声引导下热消融治疗甲状腺癌是安全有效的[3-5],并且取得了良好的效果,然而其适用范围仅局限于低危PTMC(即T1aN0M0 PTC),不包括T1bN0M0期PTC。一项长期的研究显示T1aN0M0期和T1bN0M0期PTC进展率无差异[14-15],且两者的预后相似[12]。基于此,本研究设想超声引导下RFA治疗T1bN0M0期PTC也有可能取得良好的疗效。
Kim等[16]的研究表明RFA可以安全、有效地治疗低风险的小PTC,而不仅仅局限于PTMC。然而,Kim等[16]的研究对象为不适合手术的老年患者,且只有2例患者为T1b期PTC。本研究主要评估了89例T1bN0M0期PTC患者RFA治疗后的短期疗效。RFA治疗后12个月时,消融灶的VRR为82.0%,与PTMC(96%)[3]相比偏低,其主要原因可能为T1b期PTC的消融灶范围明显大于PTMC,机体需要更长时间进行吸收。至末次随访时,42.7%的消融灶消失,而VRR高达99.2%。研究显示RFA治疗甲状腺疾病的总并发症发生率为3.5%,严重并发症发生率为1.6%[17],而本研究仅有2例 (2.2%)患者诉有疼痛,未出现严重并发症。研究表明T1b期PTC患者甲状腺全切术后淋巴结转移和复发率分别为7%和3.8%[18],而本研究消融术后患者淋巴结转移和复发率低于甲状腺全切术后患者,分别为1.1% (1/89) 和2.2% (2/89)。2例复发患者均为青年女性,其原发病灶大小为1.4 cm和1.7 cm,BRAFV600E基因均突变,消融前超声显示病灶边界不清,形态欠规则,内可见多发点状强回声,CEUS呈高增强和不均匀等增强,首次消融时总能量分别为0.2和2.0 KJ,病灶分别在二次消融后12个月和8个月消失。
除了回顾性研究固有的局限性外,本研究还存在以下局限性。与甲状腺全切相比,超声引导下RFA会漏掉隐匿性肿瘤和微小转移灶。本研究样本量偏小、随访时间短、随访后期失访人数过多,因此,超声引导下RFA治疗T1bN0M0期PTC的疗效还需要大样本多中心的前瞻性研究进一步验证。
综上,本研究结果表明超声引导下RFA对T1bN0M0期PTC的治疗安全有效。对于不适合手术或拒绝手术的T1bN0M0患者,可作为外科手术的一种替代方法。

