肺炎克雷伯菌所致奶牛肺炎的病原分析及治疗
贾 丽,李 可,梁艳艳,侯铭源,田梦悦,杨 明,林倩颖,张 婷,马玉忠 (河北农业大学 动物医学院,河北 保定 071001)
肺炎是严重危害奶牛生产的一种常见呼吸道疾病[1]。肺炎克雷伯菌是奶牛肺炎的主要致病菌之一[2]。由于抗生素的大量使用,细菌耐药性逐渐增加,导致使用抗生素防治奶牛肺炎的难度逐渐加大[3]。为了有效地预防和控制本病的流行,本试验采集石家庄地区患肺炎奶牛的鼻腔分泌物,分离病原菌,进行致病性试验、药敏试验、多重耐药及进化树分析,并对患病奶牛进行治疗,为该地区肺炎克雷伯菌所致奶牛肺炎的防治提供依据。
1 材料与方法
1.1 主要试剂普通琼脂、伊红美蓝琼脂(EMB)、LB肉汤培养基购自北京澳博星生物技术公司;革兰染液购自潍坊汉唐生物公司;药敏片购自杭州滨和微生物公司;2×Taq PCR MasterMix (KT201)和DL2000 DNA Marker (MD114)购自北京天根公司;恩诺沙星注射液购自上海中牧康公司;麻杏石甘散购自杭州科宝生物公司。
1.2 病料来源石家庄地区规模化奶牛场的病牛,2岁左右,表现为呼吸急促、咳嗽、流鼻涕、精神沉郁、食欲不振、体温升高等症状,肺部听诊可听到明显的湿性罗音。采集病牛鼻拭子,并结合如下试验进一步确诊。
1.3 疑似菌株的获取将样品初步处理后,接种于普通琼脂平板上,37℃ 培养12~18 h,挑取疑似菌落进行多次纯化,直至出现优势菌落。挑取疑似肺炎克雷伯菌菌落,在EMB培养基上进行鉴别培养。在LB肉汤中增菌,放入甘油中保菌。
1.4 革兰染色镜检、生化鉴定及细菌DNA的提取挑取上述疑似菌落,进行革兰染色,镜检。参照文献[4]的鉴定方法对疑似菌株进行生化试验。参照文献[5]进行DNA的提取。
1.5 16S rDNA PCR基因扩增以上述提取的DNA为模板,使用16S rDNA通用引物27F (5′-A-GAGTTTGATCCTGGCTCAG-3′)与1429R(5′-G-GTTACCTTGTTACGACTT-3′) 进行PCR分子鉴定。50 μL体系:2 ×Taq PCR Mix 25 μL,上、下游引物各2 μL,DNA 4 μL,ddH2O 17 μL。反应程序:95℃ 5 min;95℃ 30 s,57℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min。用1%琼脂糖凝胶电泳检测其目的条带,将PCR扩增阳性产物送往上海生工公司进行测序,将测序结果与GenBank中已知序列进行比对,确定菌种信息。
1.6 分离菌株小鼠致病性试验SPF级BALB/c小鼠,体质量(20 ± 2) g,由河北医科大学实验动物中心提供。将小鼠随机分成试验组和对照组。调整菌液浓度至1×108CFU/mL,试验组每只小鼠腹腔注射菌液0.3 mL,对照组注射等量无菌生理盐水,观察记录小鼠的临床症状和病死情况。剖检病死小鼠,观察器官病变,并采集心脏、肝脏、脾脏、肺脏、肾脏进行细菌的分离鉴定。
1.7 药敏试验按照NCCLS(2017年)推荐的K-B纸片法对分离的病原菌进行药敏试验。依照CLSI[6]的标准判定药物敏感性。
1.8 系统发育分析选取NCBI上的K.Pneumoniaesubsp.PneumoniaeDSM 30104、K.PneumoniaeR-70,使用MEGA 7.0制作系统发育树。
1.9 治疗试验随机将肺炎奶牛分为4组(A~D组)。A组为敏感抗生素治疗组,B组为中药治疗组,C组为敏感抗生素+中药治疗组,D组为患病不治疗组;另选健康奶牛设为E组,作为对照组。所有奶牛在治疗期间正常饲喂,自由饮水,观察用药后奶牛的恢复情况。
2 结果
2.1 细菌的分离与培养从84份样品中发现32株疑似肺炎克雷伯菌。菌株在普通琼脂培养基上呈圆形、扁平、乳白色的中等菌落(图1A),在EMB上为圆形、粉红色、有闪光、黏稠的大菌落(图1B)。革兰染色阴性(图1C),可见两端钝圆、单个或成对排列的短粗杆菌。

A.普通琼脂平板上菌落形态;B.伊红美蓝琼脂平板上菌落形态;C.分离菌的形态 (×1 000)图1 分离菌的形态和培养特性观察
2.2 生化鉴定32株疑似菌均能发酵各种糖类,产气产酸,不产生H2S,VP试验呈阳性,能分解尿素,MR、吲哚试验为阴性,能利用柠檬酸盐,与《伯杰细菌鉴定手册》中肺炎克雷伯菌的生化特性基本吻合,故均疑似为肺炎克雷伯菌,分离率为38.1%(32/84)。
2.3 分离菌株16S rDNA PCR鉴定将分离菌株进行PCR扩增和凝胶电泳,获得的目的条带在1 500 bp 左右(图2)。经BLAST在线比对:32株分离株与肺炎克雷伯菌的同源性高于99%,确定为肺炎克雷伯菌。
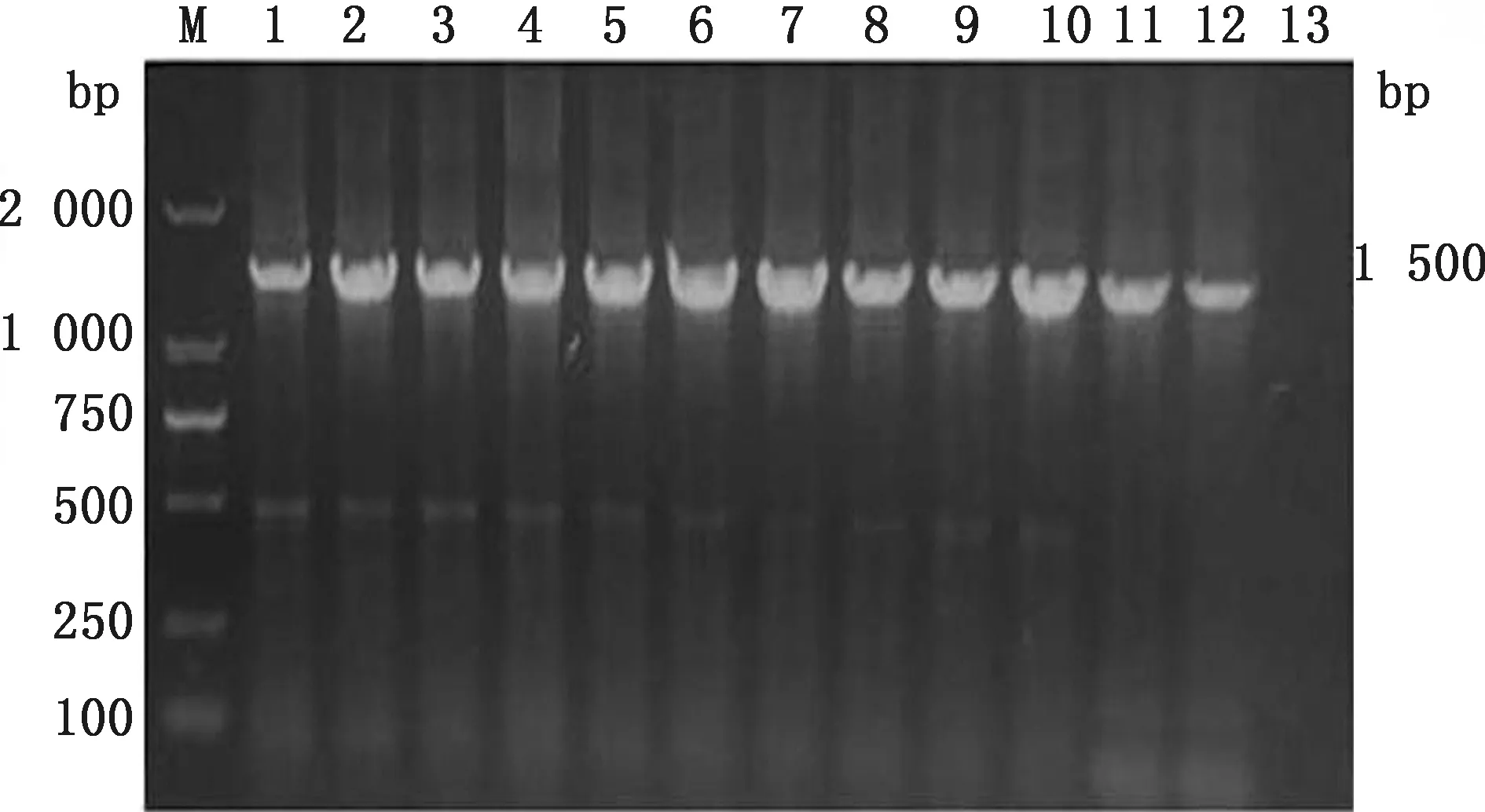
M.DL2000 DNA Marker;1~12.菌株;13.阴性对照图2 部分分离株16S rDNA PCR检测
2.4 小鼠致病性试验165只BALB/c小鼠,随机分成33组,每组5只。第1~32组为试验组,第33组为对照组。各试验组小鼠接种肺炎克雷伯菌后,出现精神沉郁、结膜苍白、流泪、抽搐等症状(图3)。3 d内,28个试验组的小鼠全部死亡,致死率为87.5%(28/32)。其余4组,2~5 d表现为精神沉郁、食欲减退,部分出现死亡现象。剖检死亡小鼠(图4~5),可见肠壁变薄,肠腔内充气,肠黏膜出血,肺脏严重充血、淤血、水肿、纤维化,其他实质内脏器官充血、淤血;对照组剖检正常(图6)。取小鼠心脏、肝脏、肺脏、脾脏、肾脏等组织进行涂片染色镜检,可见革兰阴性短杆菌。挑取病变组织接种于伊红美蓝培养基上,37℃培养18 h,可见典型的肺炎克雷伯菌菌落生长。

图3 小鼠攻毒后临床症状

图4 攻毒组小鼠剖检变化
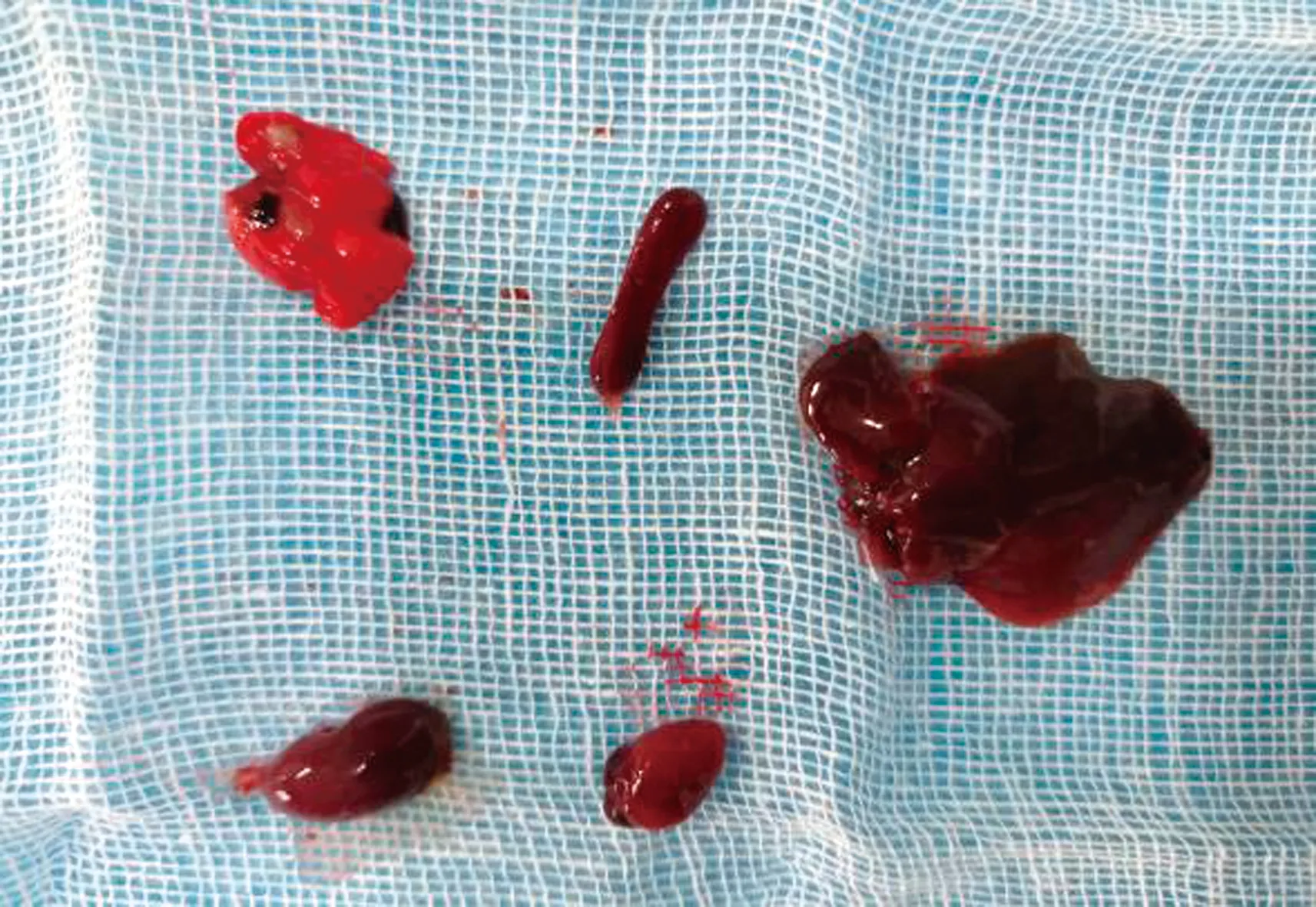
图5 攻毒后实质器官病变

图6 对照组的实质器官
2.5 药敏试验32株肺炎克雷伯菌对恩诺沙星的敏感率最高(96.875%,31/32),对多黏菌素B、阿米卡星的敏感率分别为93.750%(30/32),90.625%(29/32);对氨苄西林的耐药率最高(100.0%),对多西环素、复方新诺明、头孢唑啉的耐药率分别为87.500% (28/32),84.375% (27/32),87.500% (28/32) (表1)。
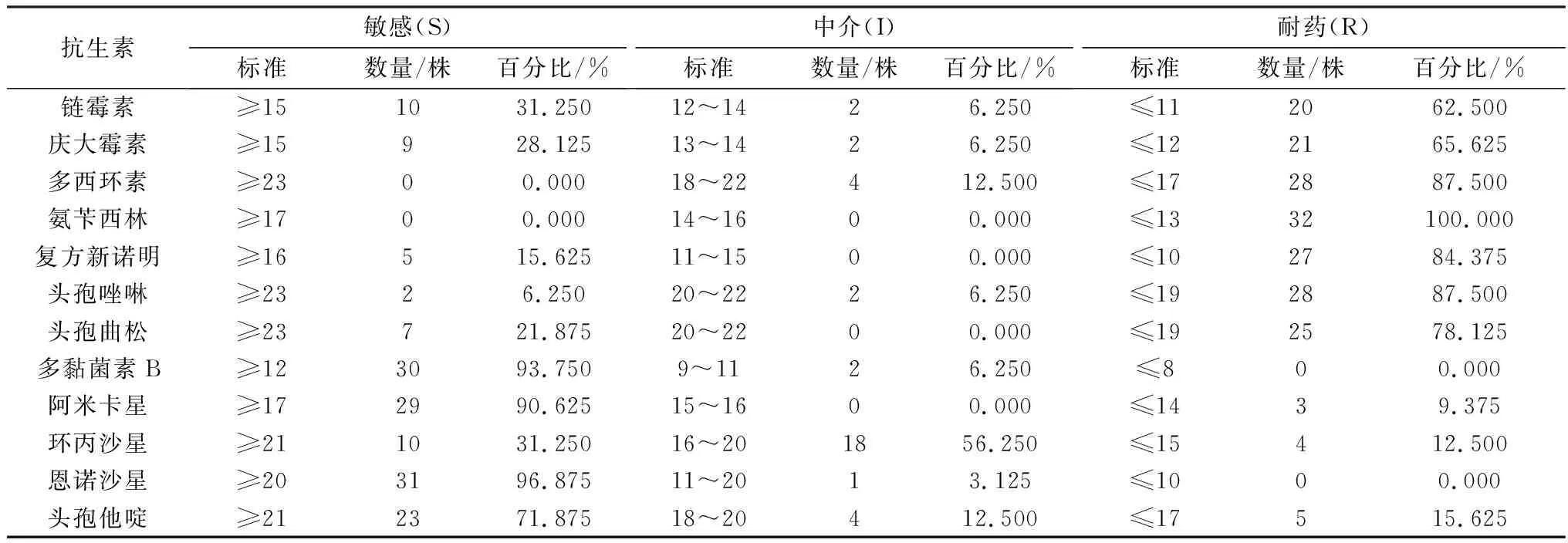
表1 32株肺炎克雷伯菌的药敏试验
由表2可知,32株分离菌中耐7种药物的最多,占分离菌株的34.3%。
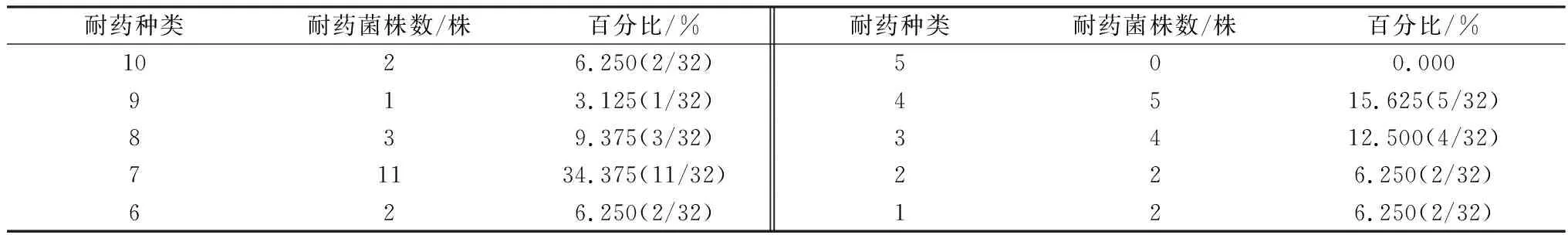
表2 32株分离株多重耐药性
2.6 系统发育分析根据多重耐药结果,选取同时对7种及以上抗生素耐药的肺炎克雷伯菌为代表菌株,命名为KP-SJ-1、KP-SJ-2、KP-SJ-3~17。如图7所示,17个代表菌株中KP-SJ-1~16与K.PneumoniaeR-70聚为一簇,表明这16株菌与K.PneumoniaeR-70亲缘关系近;KP-SJ-17与K.Pneumoniaesubsp.PneumoniaeDSM 30104位于同一分支,置信率大于90%。
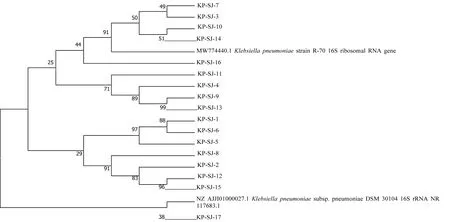
图7 17株代表菌株的系统发育进化树
2.7 治疗试验将最敏感的恩诺沙星用于治疗试验,中药选用麻杏石甘散。本试验32头患病奶牛分为4组:A组(恩诺沙星治疗组,8头),恩诺沙星注射液 30 mg/kg,肌肉注射,每天2次,连用7 d;B组(麻杏石甘散治疗组,8头),麻杏石甘散 0.4 g/kg,拌料,每天2次,连用7 d;C组(恩诺沙星+麻杏石甘散治疗组,8头),恩诺沙星注射液(30 mg/kg,肌肉注射)+麻杏石甘散(0.4 g/kg,拌料),每天2次,连用7 d;D组(患病组,8头),不予治疗;选8头年龄相近,并处于同一阶段的健康奶牛设为E组,作为对照组。治疗结果见表3。
从表3结果显示,7 d后,C组的治愈率最高(100.0%);A和B组的治愈率分别为75.0%(6/8)和62.5%(5/8)。B和D组的死亡率分别为12.5%(1/8)和37.5%(3/8)。恩诺沙星和麻杏石甘散联合应用,治疗效果最佳。

表3 肺炎克雷伯菌所致奶牛肺炎的治疗效果(n=8)
3 讨论
肺炎克雷伯菌属于条件性致病菌,能引起多种动物的败血症,发病率和死亡率较高[7]。此次试验中,从84份样品中分离得到32株肺炎克雷伯菌,分离率为38.10%,重庆某地的分离率达19.70%[8],江苏某地的分离率为6.27%[9],西藏部分地区的分离率为7.76%[10],表明肺炎克雷伯菌的分离率存在地域性差异。此次分离的肺炎克雷伯菌对小鼠致死率为87.50%。本试验分离的菌株具有较高的分离率和较强的致病性,应引起足够重视。
生化鉴定结果与王乐等[11]报道的奶牛源肺炎克雷伯菌的生化鉴定结果基本一致。此外16S rDNA序列分析是一种能弥补传统细菌鉴定法中的不足,能对细菌进行高效鉴定的一种方法[3]。对分离株的16S rDNA序列分析结果表明,该菌与肺炎克雷伯菌的同源性达到99.0%以上,说明在应用传统方法进行细菌鉴定的同时,结合使用16S rDNA鉴定法,能更准确地得出结果。
在兽医临床上,由于抗生素大量使用,肺炎克雷伯菌会产生抗生素水解酶,导致耐药菌株不断出现,使细菌所致疾病的防治变得困难[12]。药敏试验显示,肺炎克雷伯菌对不同的抗生素的敏感性不同:在β-内酰胺类抗生素中,对氨苄西林、头孢唑啉和头孢曲松的敏感率在21.875%以下,这与王乐等[11]对奶牛乳房炎肺炎克雷伯菌的研究结果一致。在氨基糖苷类抗生素中,对链霉素、庆大霉素的敏感率在31.250%以下。在四环素类抗菌药中,对多西环素的敏感率在12.500%以下。在磺胺类药物中,对复方新诺明的敏感率仅为15.625%。对多西环素和复方新诺明的敏感率较低的原因可能在于这些药物的使用频率高,在治疗时尽量减少此类药物的使用。所有菌株对氨苄西林均耐药,林雅等[8]对肉牛上呼吸道分离出的肺炎克雷伯菌耐药性进行研究时,发现氨苄西林的耐药率为100.00%,这与本研究结果一致。从分离菌株的多重耐药结果来看,耐7种抗生素的分离菌株最多,占分离菌的34.30%。杜琳等[7]报道了我国部分地区奶牛克雷伯菌的多重耐药率为54.35%,这与本试验结果一致,说明肺炎克雷伯菌的耐药情况呈严重趋势。由进化树可知,17株耐药性较强的代表菌株中的大部分在同一分支上,表明部分多重耐药性强的菌株存在较近的亲缘关系。此次分离的菌株对喹诺酮类抗菌药恩诺沙星均敏感。在此次研究中发现肺炎克雷伯菌对阿米卡星的敏感率较高为90.625%,高亚桃等[13]对河北省奶牛呼吸道病病原进行检测,同样发现肺炎克雷伯菌对阿米卡星中度敏感,说明阿米卡星可以作为治疗药物进行选择。SUH等[14]在韩国肺炎克雷伯菌的耐药性研究中显示部分菌株对黏菌素敏感,韩坤等[15]对貂源肺炎克雷伯菌研究结果显示,所有分离株都对多黏菌素敏感,王佳佳等[16]对兔源肺炎克雷伯菌进行鉴定时发现其对多黏菌素B敏感,本研究中肺炎克雷伯菌对多黏菌素B的敏感率为93.750%,这与上述研究结果相符,说明地区和物种不同,不会影响肺炎克雷伯菌对多黏菌素的敏感性。
在治疗效果方面,麻杏石甘散具有清肺化痰、止咳平喘等作用[17],恩诺沙星对克雷伯菌具有较强的抑菌作用,本试验中C组的治疗效果颇为显著,说明中西药结合治疗的方式最佳。
在奶牛肺炎的治疗上,建议奶牛场先进行病原体的分离鉴定和药敏试验,选出有效的抑菌药物,结合传统的中兽医疗法,以达到良好的治疗效果。同时,要加强对此类疫病的监测,合理使用药物,来有效地控制奶牛肺炎。

