内皮细胞电压门控钙离子通道及其功能研究进展*
李双君 潘 君 崔玉红**
(1)天津大学机械工程学院,天津 300350;2)重庆大学生物工程学院,重庆 400044)
自世界首次记录心肌细胞存在钙离子电流以来[1‑2],随着膜片钳技术的创造与发展,越来越多的钙离子电流和电压门控钙离子通道(voltage‑gated calcium channel,VGCC)在神经元和神经内分泌细胞、腺细胞、肌细胞、心肌细胞等可兴奋细胞中被发现[3‑4],人们对于VGCC 的电生理特性和功能有了一定的认识。VGCC通过细胞膜去极化激活,并通过响应动作电位和亚阈值去极化信号介导钙离子内流。钙离子通过VGCC 进入细胞,作为电信号的第二信使,在细胞内的收缩、分泌、突触传递和基因表达等事件中发挥重要作用[5]。随着深入研究,VGCC 的各种不同亚型也被发现和定义,根据电生理学及药理学特性不同,可将其分为:a.高电压激活钙离子通道,包括L、N、P/Q及R 型VGCC;b.低电压激活钙离子通道,只有T 型VGCC。VGCC 是跨膜蛋白复合体,由α1、β、α2δ、γ 4 个亚基组成。α1 亚基是VGCC 的主要亚基;β、α2δ、γ是辅助性亚基,用于调节α1亚基功能,从而改变钙离子内流数量(图1)。目前,根据α1 亚基基因序列的同源性不同又可分为Cav1、Cav2、Cav3。其 中,Cav1 包 括Cav1.1 (α1S)、Cav1.2 (α1C)、Cav1.3 (α1D)、Cav1.4 (α1F),全部编码L 型VGCC。Cav2 包括Cav2.1(α1A)、Cav2.2(α1B)、Cav2.3(α1E),分别编码P/Q、N、 R 型VGCC。 Cav3 包 括Cav3.1 (α1G)、Cav3.2 (α1H)、Cav3.3 (α1I),全 部 编 码T 型VGCC[6‑7]。
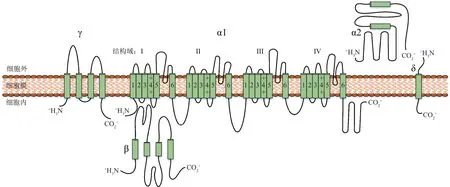
Fig.1 The subunit structure and membrane topology of VGCC[5]图1 VGCC的亚基结构和膜拓扑结构[5]
对于神经细胞、骨骼肌细胞等兴奋性细胞而言,膜表面的离子通道尤其是VGCC是细胞兴奋和功能发挥的分子基础[3‑4]。与诸多可兴奋细胞不同的是,作为不可兴奋细胞的内皮细胞通常被认为缺乏VGCC[8‑11]。早在1980年代即有人通过电压钳或膜片钳技术对人脐静脉内皮细胞[12‑13]、牛肺动脉内皮细胞等进行电生理学研究[14‑15],发现它们不具有VGCC。到了1990年代,牛心房内膜内皮细胞[16]、猪冠状动脉内皮细胞[17]等也相继被发现不存在VGCC。
然而,伴随着荧光染色技术和数字成像显微观测技术的发展,这一长期存在的观点受到了挑战。首先,1993年,Bkaily 等[18]发现人和成年杂种犬主动脉内皮细胞存在R型VGCC,同时也参与周围细胞的兴奋‑分泌耦合过程,打破了由来已久的笼统共识。随后,Lee 等[19]在1999年发现大鼠心脏内皮细胞存在VGCC,Yazawa等[20]在2002年发现人主动脉内皮细胞存在VGCC。众多不同种类内皮细胞不断的被发现存在VGCC。
内皮细胞是否存在VGCC?本文就VGCC在不同种类血管内皮细胞的研究进展作以综述。同时,相关研究表明内皮细胞VGCC对内皮细胞自身的分泌、周围细胞(平滑肌细胞)的收缩和舒张以及迁移和增殖方面均有显著的影响,本文也将进行简要阐述。
1 内皮细胞的VGCC及分类
目前对于VGCC主要有3种检测方法:
a.离子通道电流的检测
VGCC由细胞膜去极化激活,产生钙离子内向电流。应用膜片钳技术,对膜片实行电压钳制,模拟细胞膜去极化。若测量到单个离子通道开放产生的电流,说明VGCC存在;反之则不存在。通过观测单个通道开放和关闭的电流变化,可直接得到各种离子通道开放的电流幅值分布、开放几率、开放寿命、分布等功能参量,并分析它们与膜电位、离子浓度等之间的关系。其他几个主要的钙离子通道的激活均与膜电位变化无关,包括受体操纵钙通道(receptor‑operated Ca2+channel,ROC)、钙池调控钙通道(store‑operated Ca2+channel,SOC)、机械敏 感 性 钙 通 道(mechano‑sensitive Ca2+channel,MS)等。
b.胞内钙离子浓度变化的检测
VGCC激活的另一个特征是胞内钙离子浓度显著提高。应用VGCC 阻滞剂诸如地尔硫卓(diltiazem,DTZ)、依福地平(efonidipine)、硝苯地平(nifedipine)等对细胞膜已去极化的内皮细胞进行处理,利用fura‑2、fluo‑3 等荧光指示剂对胞内钙离子浓度进行检测。若阻滞剂处理后胞内钙离子浓度提高被阻断,则表明VGCC存在。
c.离子通道基因、蛋白质表达的检测
目前对VGCC 在基因和蛋白质层面上有了深入的了解,认为去极化激活钙离子电流形成的分子基础是编码VGCC的基因家族,包括Cav1、Cav2、Cav3 等。应用实时定量PCR 技术进行检测,不但可以检测VGCC 通道是否表达,还可以从基因的角度明确通道类型,如Cav1.1 编码L 型VGCC、Cav2.1 编码P/Q 型VGCC、Cav3.1 编码T 型VGCC等。另外,免疫组织化学染色法也可以对VGCC在细胞中的表达进行检测,进一步观察到通道在细胞膜上不同位置的分布特点。
根据探究问题的不同,以上3种检测方法还可以联合使用。由于内皮细胞的形态和功能特征因血管类型和血管范围的不同而不同[21]。因此,就目前所调研的文献而言,根据内皮细胞所处组织不同分为以下4类分别进行阐述其研究进展。
1.1 静脉内皮细胞
20世纪80年代早期,由于技术手段上的困难,关于完整组织或培养的内皮细胞中VGCC 存在与否的报道很少[12]。膜片钳技术和荧光显微技术的发展及培养的内皮细胞可用性的提高,使得众多学者获得了人脐静脉内皮细胞不存在VGCC 的结论[12‑13,22‑23]。例如,Bregestovski等[12]在1988年采用全细胞膜片钳技术和单通道膜片钳技术研究了人脐静脉内皮细胞对组胺的膜响应,在宏观或单通道水平上都没观察到电压门控钙离子电流,表明VGCC 不存在于人脐静脉内皮细胞中。Niluus等[22]在1990年采用膜片钳技术研究了人脐静脉内皮细胞的离子通道,其电生理特性结果表明VGCC不存在。Vargas等[23]在1994年发现去极化的电压钳脉冲不能激活内向电流,表明在人脐静脉内皮细胞中缺乏VGCC。然而,人脐静脉内皮细胞存在VGCC的结论也有报道。2010年,Martini等[24]对血管紧张素II(angiotensin II,Ang II)通过不同的机制诱导细胞内Ca2+的变化进行实时监控,结果表明Ang II通过T型VGCC和L型VGCC 调节胞内Ca2+浓度,但仅通过T型VGCC的钙内流调节内皮细胞的迁移,证实人脐静脉内皮细胞含有L和T型VGCC。
1.2 动脉内皮细胞
动脉内皮细胞是否存在VGCC 的研究率先在动物动脉内皮细胞中开展。1987年,Johns 等[14]应用膜片钳技术发现去极化没有激活内向电流,这强烈表明在培养的牛肺动脉内皮细胞中,没有功能性电压门控钙或钠通道。同年,Takeda等[25]在膜片钳记录中发现存在一种超极化激活的内向电流和强烈的内向整流,并且该细胞亚群的去极化过程没有观察到依赖电压的钙离子电流,因此推测出牛主动脉内皮细胞不存在VGCC。同样应用膜片钳技术,Colden‑Stanfield 等[26]将细胞置于10 mmol/L或110 mmol/L 的氯化钙中,电压敏感的钙电流没有被激活,表明牛主动脉内皮细胞不存在VGCC。1989年,Bregestovski 等[13]也提到,牛肺动脉内皮细胞、牛主动脉内皮细胞的膜片钳探测结果表明它们不存在VGCC。同年,Cannell等[15]将膜片钳技术与Ca2+荧光显微技术联合运用于牛肺动脉内皮细胞的研究,发现去极化降低而不是增加胞内Ca2+浓度,这有力地表明牛肺动脉内皮细胞中不存在VGCC。1992年,Kimura等[17]对猪冠状动脉内皮细胞内Ca2+浓度进行检测,结果显示VGCC不参与持续大量增加的胞内钙离子相关的细胞损伤的发生,表明猪冠状动脉内皮细胞不存在VGCC。1993年,Bkaily 等[18]应用荧光染色技术和数字显微技术对犬类主动脉内皮细胞进行研究,结果显示K+去极化和血小板活化因子(platelet activating factor,PAF)通过激活R 型VGCC 增加胞内钙离子浓度,表明犬类主动脉内皮细胞存在R 型VGCC。近几年,关于动物动脉内皮细胞VGCC的研究多见于鼠动脉内皮细胞。2017年,Gilbert等[27]应用免疫荧光法的结果显示野生型小鼠的内皮细胞中存在与内皮一氧化氮合酶共定位的Cav3.1通道。该研究表明,小鼠肺动脉内皮细胞存在T型VGCC,主要通过Cav3.1通道,控制内皮细胞Ca2+和乙酰胆碱(acetylcholine,Ach)介导的舒张作用,促进小鼠肺内血管反应。2020年,Cao 等[28]发现无Ca2+的Krebs 溶液显著减弱了花椒毒素(xanthotoxin,XAT)诱导的大鼠主动脉血管舒张,对大鼠主动脉环应用L型VGCC阻断剂地尔硫卓预处理减弱了XAT 诱导的血管舒张,表明大鼠主动脉内皮细胞存在L型VGCC。
人动脉内皮细胞是否存在VGCC 的研究相对动物动脉细胞而言开展较晚。1993年,Bkaily等[18]对人主动脉内皮细胞应用fura‑2 处理和数字成像显微镜的观察,发现细胞内Ca2+浓度在血小板活化因子刺激下显著增加,并显示出对L型VGCC阻滞剂硝苯地平(nifedipine)不敏感,但对R 型VGCC 阻滞剂伊拉地平(isradipine,PN200‑110)敏感,从而得出存在R 型VGCC 的结论。2002年,Yazawa等[20]发现对人主动脉内皮细胞应用米贝拉地尔(mibefradil),一种T 型VGCC 阻滞剂,能够降低组胺诱导的胞内Ca2+浓度的提高,表明人主动脉内皮细胞存在T 型VGCC。2005年,Oshima等[29]发现依福地平,一种T 型和L 型Ca2+通道阻滞剂,可显著改变内皮功能指数FMD/NTG、8‑OHdG的尿排泄量、血清丙二醛修饰的低密度脂蛋白即逆转原发性高血压患者的内皮功能障碍,而L 型VGCC 阻滞剂硝苯地平对内皮功能无改善作用,表明人肱动脉内皮细胞存在T型VGCC而非L型VGCC。进一步,可以通过免疫组织化学染色法和实时定量PCR 技术使内皮细胞VGCC 的不同亚型和分布特点得以明确。例如,2017年,Thuesen等[30]应用免疫组织化学染色法在人乳腺动脉平滑肌细胞和内皮细胞中检测到Cav2.1 和Cav3.1,在人大脑动脉的内皮细胞中检测到Cav2.1,揭示了两种不同类型的VGCC均参与人脑和乳腺血管的收缩活动。
1.3 微血管内皮细胞
不同于静脉内皮细胞和动脉内皮细胞,微血管内皮细胞VGCC 存在与否的研究开展得较晚。Li等[31]在1999年发现激动剂ATP(100 μmol/L)、凝血酶(10 U/ml)和组胺(100 μmol/L)能够诱发人大脑微血管内皮细胞内瞬时Ca2+浓度升高,该浓度的提高被受体操纵Ca2+通道阻滞剂所阻断。然而电压门控通道阻滞剂地尔硫卓并没有阻止胞内Ca2+浓度的提高。Li 等[31]进一步用K+平衡盐溶液(80 mmol/L) 去极化或使用VGCC 激动剂BAY k8644 对细胞进行处理,结果显示K+平衡盐溶液(80 mmol/L)降低了组胺(100 μmol/L)诱导的胞内Ca2+浓度升高,表明人大脑微血管内皮细胞不存在VGCC通道。
随后,众多研究集中于鼠微血管内皮细胞。2004年,Wei 等[32]发现大鼠肺微血管内皮细胞表达T型VGCC,该通道承担由于流动障碍介导的膜去极化而发生的Ca2+内流。2006年,Townsley等[33]总结了Ca2+通道在肺内皮细胞中的表达,并指出大鼠肺微血管内皮细胞存在T 型通道。同年,Zhou等[34]讨论了有关T型VGCC在肺内皮细胞中的表达和功能作用,阐述了内皮细胞T型VGCC的分子特征、生物物理和药理特征,并指出大鼠肺微血管内皮细胞中表达了低电压门控钙通道(Cav3.1)。2007年,Proost 等[35]应用双免疫染色法发现Cav3.1 和血小板内皮细胞黏附分子1(platelet endothelial cell adhesion molecular‑1,PECAM‑1,内皮细胞的标记物),显著地染色于内皮细胞的侧壁,少量染色了基壁和根尖壁,表明T 型VGCC 存在大鼠肺微血管内皮细胞中。2018年,Zheng 等[36]发现大鼠肺微血管内皮细胞本身具有形成体外血管“网络”能力,减少细胞外Ca2+可消除“网络”的形成,但是阻断血管内皮生长因子受体(VEGF receptor)或一氧化氮合酶的作用很小或没有,说明“网络”形成是一个Ca2+浓度依赖的过程。阻断T型VGCC或沉默α1G基因,破坏了“网络”的形成。相反,阻断瞬时受体电位通道4(canonical transient receptor potential 4,TRPC4)或辣椒素4(transient receptor potential vanilloid 4,TRPV4)这两种钙通道对“网络”形成没有影响,说明大鼠肺微血管内皮细胞存在T 型VGCC[36]。2019年,Leo 等[37]研究发现溶血磷脂酰肌醇(L‑alpha‑lysophosphatidylinositols,LPI)可以促进大鼠脑微血管内皮细胞的Ca2+内流,但是通过应用硝苯地平抑制L型VGCC或在无Ca2+盐水中这种内流被消除,表明该细胞存在L型VGCC。
1.4 其他内皮细胞
尽管VGCC在内皮细胞中存在与否的研究多开展于静脉、动脉、微血管内皮细胞中,其他一些组织器官的内皮细胞是否存在VGCC 也有一些报道。例如,1990年,Laskey 等[16]将膜片钳技术与Ca2+荧光显微技术相结合,发现激动剂刺激的Ca2+内流仅仅是由于电化学驱动力的变化引起的,Ca2+通过一种与电压无关的被动渗透通路进入细胞,表明牛心房内膜内皮细胞不存在VGCC。Vinet 等[38‑39]应用全细胞膜片钳技术发现牛肾上腺髓质内皮细胞去极化产生了Ca2+内向电流,并且其电流‑电压曲线结果表明细胞存在T型和L型VGCC。Lee等[19]对大鼠心脏内皮细胞应用fura‑2进行荧光染色检测的结果显示血清素诱导的胞内Ca2+浓度变化与VGCC和无机钙通道阻滞剂有关,这与一些有关VGCC参与激动剂刺激Ca2+内流的研究一致[40‑41],表明VGCC 存在于大鼠心脏内皮细胞中。另外,T 型VGCC参与血管直径的调节已经在大鼠和小鼠的传入和传出小动脉中被观察到[42‑45],而L型VGCC被认为在皮质传出小动脉收缩中不发挥作用[46‑48]。例如,2014年,Thuesen 等[49]对小鼠肾血管内皮细胞的研究显示,Cav3.2通道和内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)阻断剂抑制了去极化诱导的灌注传出小动脉收缩后的二次扩张,因此Cav3.2 通道参与了一氧化氮(NO)依赖性的传出小动脉扩张。
进一步,可以通过免疫组织化学染色法和实时定量PCR 技术使得内皮细胞VGCC 的不同亚型和分布特点得以明确。例如,Blanks等[50]在2007年通过免疫组化法发现,Cav3.1在部分人子宫肌层血管平滑肌细胞中表达,而Cav3.2 在血管内皮细胞和白细胞中表达,表明T型VGCC存在于人子宫肌层血管内皮细胞。
综上所述,本文统计了涉及静脉、动脉、微血管及其他一些内皮细胞中VGCC 存在与不存在的研究结果,具体见表1。
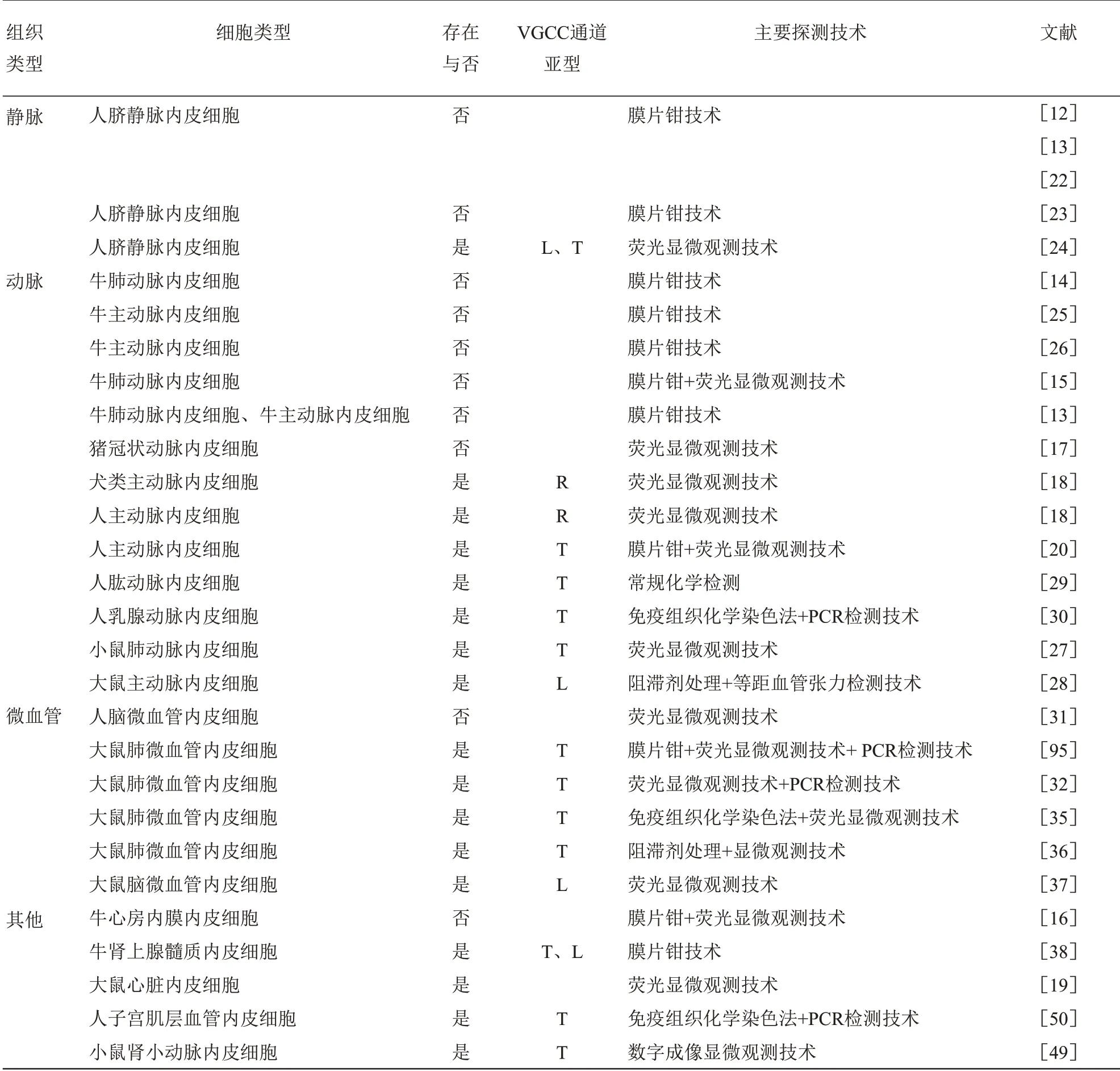
Table 1 Research progress of voltage-gated calcium channels in endothelial cells表1 内皮细胞钙离子电压门控通道研究进展
2 内皮细胞VGCC的作用
2.1 调节血管内皮舒张和收缩活动
内皮细胞远不只是血液和血管壁平滑肌细胞和基质蛋白之间的简单的物理屏障。内皮细胞的多功能性使它们能够调节血管张力的平衡和营养物质的流动、释放血管活性物质,其中最重要的一种叫做内皮衍生放松因子(endothelium‑derived relaxing factor,EDRF),这些物质导致皮下平滑肌松弛,并调节血液成分在血管壁上的流动(渗透性)[51‑53]。EDRF 被确定为NO,由精氨酸(arginine)通过激活内皮细胞中的内皮一氧化氮合酶形成,其释放与胞内游离钙浓度的增加有关[40,54‑55]。EDRF/NO 是血管平滑肌和血小板中可溶性冠苷酸环化酶(guanylate cyclase,GC)普遍存在的激活因子,它催化环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)的产生,导致平滑肌松弛,进而调节血管内皮的舒张和收缩[56‑57](图2a)。例如,小鼠肺动脉内皮细胞和平滑肌细胞通过间隙连接通道交流物质和电信号,产生协调效应[27,58‑59]。另一方面,内皮细胞的连接通透性,也受到NO的调控,通过Ca2+的增加而增强,可能是因为Ca2+对胞内收缩元素的作用导致细胞间连接区域的收缩和间隙的扩大[60‑63]。因此,内皮细胞的Ca2+调控的机制对于理解血管活性物质调节血管张力和血管通透性的作用是至关重要的。
关于存在VGCC 的内皮细胞相关研究显示VGCC对Ca2+的调控起到关键作用,进而影响血管内皮的舒张和收缩活动。例如,Oshima等[29]发现T型VGCC阻滞剂,通过降低氧化应激改善原发性高血压患者的血管内皮功能障碍。Gackiere 等[64]在文章中表明被称为容量性钙进入的通路(capacitative calcium entry,CCE)在非兴奋性细胞中尤为重要,该通路是由钙储存耗尽所激活的。虽然这种钙离子内流通常被认为是通过TRP 通道(一种非选择性阳离子通道)发生的,但通过使用T型VGCC拮抗剂米贝拉地尔抑制了CCE期间的钙增加,表明T型VGCC可能有助于在储存耗尽后的钙离子进入。另外,T型VGCC参与微血管直径的调节已经在大鼠和小鼠的传入和传出小动脉中被观察到[42‑45]。例如,Cav3.2和内皮一氧化氮合酶阻断剂抑制了去极化诱导的灌注传出动脉收缩后的二次扩张,表明Cav3.2参与了NO依赖性的传出动脉扩张[49]。在肺动脉内皮细胞中,Ca2+通道和细胞内Ca2+浓度控制着NO 等血管舒张因子的释放,参与调节肺动脉血压。免疫荧光标记显示野生型小鼠的内皮细胞中存在与内皮一氧化氮合酶共定位的Cav3.1通道。这表明T型VGCC主要通过Cav3.1通道,控制内皮细胞Ca2+和乙酰胆碱介导的舒张作用,促进小鼠肺内血管反应[27]。此外,L、P/Q和T型VGCC存在于人肾内动脉,并参与去极化诱导的血管收缩[49,65],但不同亚型钙通道在其他类型人动脉中的重要性尚不清楚[50]。值得注意的是,T型VGCC对血管张力的控制在病理条件下也发挥了关键作用[66‑68]。例如,T型VGCC在肺毛细血管的内皮细胞中表达,参与炎症过程,包括血管性血友病因子的分泌、P选择素的表面转移或炎症的肺微循环中镰状红细胞介导的血管阻塞[69‑70]。然而,T型VGCC在大动脉内皮细胞和血管舒张中的作用却鲜为人知。例如,在表达T 型VGCC(Cav3.1)的小鼠肠系膜动脉内皮细胞中,在非生理KCl去极化剂的刺激下,T 型VGCC 会驱动动脉二次舒张[71]。
2.2 影响内皮细胞迁移、增殖
血管内皮细胞迁移在损伤愈合、血管生成等生理过程中起着重要作用[29,72]。Ca2+是内皮细胞迁移和增殖过程中多种信号的重要信使[73]。作为Ca2+内流重要途经的VGCC,其与内皮细胞迁移关系的研究却很少。Martini等[24]利用改进的博伊登室(Boyden chamber)系统对Ang II 刺激人脐静脉内皮细胞迁移进行了实验。目的是探究Ang II是否通过VGCC刺激人脐静脉内皮细胞中的钙内流,以及这种内流是否在细胞迁移中起作用。Ang II通过作用于AT1和AT2受体位点发挥生物学作用。AT1拮抗剂ZD7155 阻断了钙对Ang II 的反应,而AT2拮抗剂PD‑123319没有表现出这种作用。对其应用T型VGCC阻滞剂米贝拉地尔和L型VGCC阻滞剂维拉帕(verapamil)进行处理后,发现只有前者才会显著减少迁移细胞的数量。这些结果表明,内皮细胞的迁移仅通过T型VGCC的钙内流调节,这种作用是由Ang II‑AT1受体途径介导的。Wang等[74]进一步研究了Ang II对T型VGCC表达的影响,发现Ang II通过AT1受体、Ras和MEK诱导内皮细胞中T 型VGCC α1G 亚基的表达。Ang II 诱导的α1G表达是由AT1 受体介导的,这一结果与Martini等[24]研究一致。重要的是,Ras和MEK通路参与了该过程。应用阿托伐他汀(atorvastatin),抑制法尼基焦磷酸(farnesyl pyrophosphate,FPP)的产生,阻止Ras激活,阻断了Ang II诱导的α1G的表达。此外,为了确定MEK1/2的激活是否参与Ang II 诱导的α1G 表达,应用MEK1/2 抑制剂PD98059对人脐静脉内皮细胞进行预处理,同样抑制了Ang II 诱导的α1G 表达。这些结果表明,Ang II 通过AT1受体介导的Ras/MEK通路诱导α1G表达。
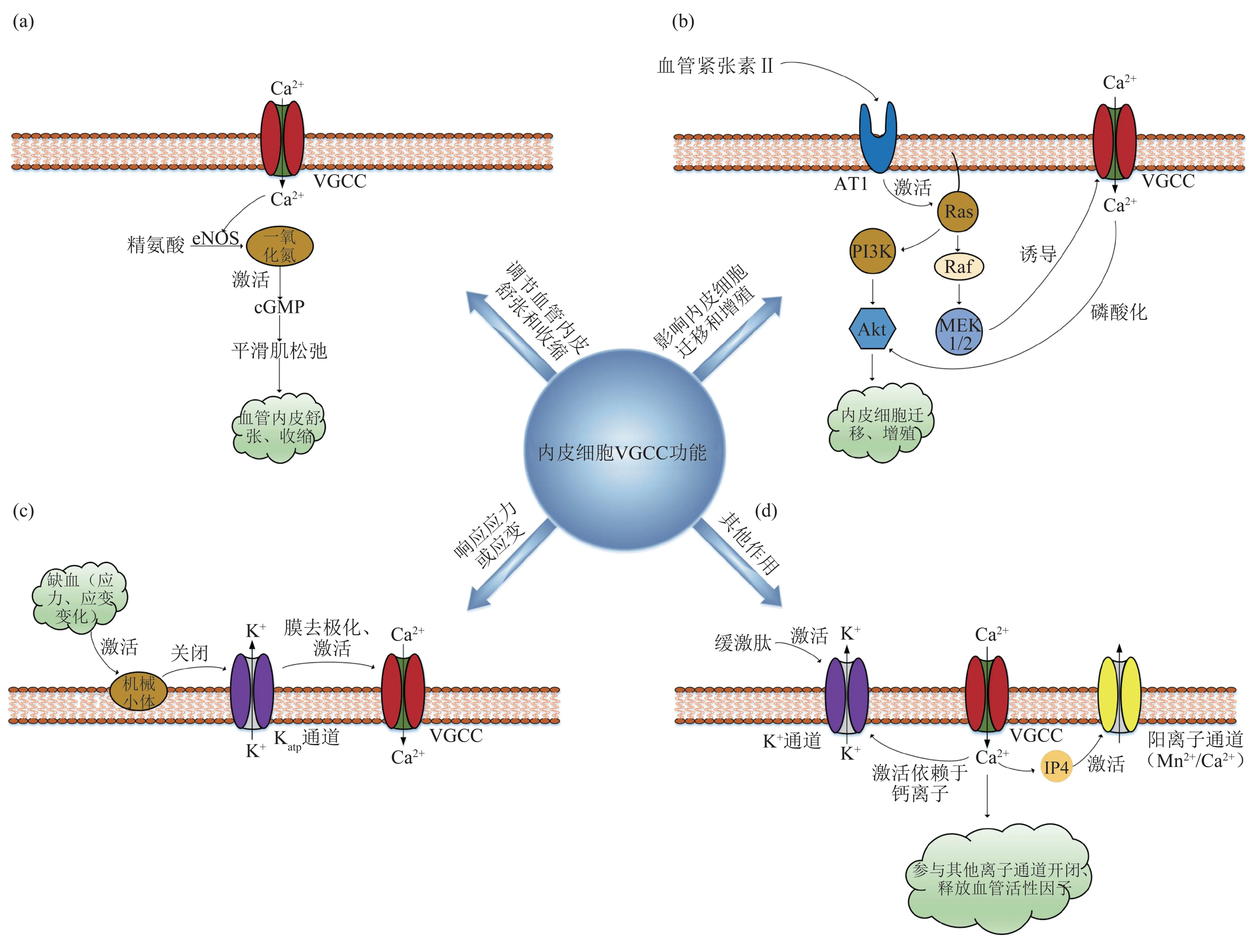
Fig.2 Function of VGCC in endothelial cells图2 内皮细胞VGCC功能
Zheng 等[75]采用了伤口愈合试验来测试T 型VGCC 阻滞剂是否影响肺微血管内皮细胞(PMVEC)迁移。该试验首先培养PMVEC 生长至汇合,通过刮擦细胞单层形成间隙,然后在缺乏血清的条件下进行监控,保证了缺口闭合的过程主要由细胞迁移构成。结果显示,T 型VGCC 阻滞剂NNC 55‑0396或使α1G基因沉默会使间隙闭合分别延迟多达32%和28%。显然,T型VGCC阻滞显著影响了PMVEC的迁移,表明VGCC在内皮细胞迁移过程中发挥了重要作用[75]。另外,PMVEC本质上具有体外生成血管“网络”的能力[75]。耗尽细胞外钙离子,消除了“网络”的形成,而血管内皮生长因子受体或一氧化氮合酶的阻断作用很小或没有作用,表明“网络”形成是钙离子依赖性过程。阻断T 型VGCC 或沉默α1G(PMVEC 中表达的唯一VGCC)破坏“网络”形成。从机制上讲,T型VGCC通道阻滞剂以剂量依赖性方式降低Akt磷酸化。阻断Akt 或其上游激活剂磷脂酰肌3‑激酶(PI3K),也会损害“网络”形成。T型VGCC道阻断的后果不单单是体外“网络”形成的破坏,还显着降低了细胞增殖、细胞基质粘附和细胞迁移。因此,T 型VGCC 阻断明显破坏了PMVEC 血管生成活性的多个组成部分。这些发现表明α1G型VGCC可通过PI3K‑Akt 信号通路促进细胞的血管生成潜力。参考以上研究,我们绘制了内皮细胞VGCC影响内皮细胞迁移、增殖的功能图(图2b)。
值得注意的是,VGCC在许多其他细胞迁移过程中均发挥重要作用。例如,Nebe等[76]发现T型VGCC阻滞剂米贝拉地尔而不是L型VGCC阻滞剂氨氯地平(amlodipine)和维拉帕米在体外减弱了白细胞黏附,表明T型VGCC参与了白细胞迁移过程。Agabiti‑Rosei 等[77]发现L 型VGCC 阻滞剂拉西地平(lacidipine)可以显着降低自发性高血压大鼠小阻力动脉内膜‑中膜比例,表明VGCC 对平滑肌细胞的迁移和增殖有巨大的影响。Blaheta 等[78]观察到米贝拉地尔对淋巴细胞水平运动和渗透的抑制作用,进一步展示VGCC 对细胞迁移的显著影响。这些发现强调了细胞迁移过程中VGCC的功能作用和对细胞内钙的依赖。尽管目前VGCC与内皮细胞迁移、增殖关系的研究很少,其调节机制仍未完全了解,但是上述发现可以为两者关系的研究提供思路。有理由相信VGCC 会发挥重要作用,因此,未来应扩大和加深VGCC与内皮细胞迁移、增殖关系的研究。
2.3 响应应力或应变
VGCC通过响应力或应变的变化调节胞内Ca2+浓度。微血管内皮细胞常受到机械力的作用,包括血管内压力产生的机械应变和与血流相关的剪切应力[79‑80]。Yoshikawa等[81‑82]对剪切应力刺激人脐静脉内皮细胞(HUVECs)造成胞内Ca2+浓度变化进行研究,结果显示在ATP存在的情况下,剪切应力导致胞内Ca2+浓度升高,而在缺乏ATP或存在非特异性Ca2+通道阻滞剂Ni2+的情况下,则观察不到这种反应。这是因为非特异性Ca2+通道阻断剂Ni2+可消除剪切应力诱导的Ca2+瞬变,表明Ca2+内流是产生胞内Ca2+瞬态变化的主要原因[82]。然而,由于应用的是非特异性Ca2+通道阻滞剂,因此不能判断出是何种钙离子通道在内流中发挥作用。此外,Isshiki 等[83]发现剪切应力可以诱导胎牛胸降主动脉内皮细胞的胞内Ca2+浓度发生变化。然而,产生浓度变化的Ca2+是内质网释放的,与膜上的Ca2+通道无关。尽管其他一些研究发现缺血早期时原位大鼠肺微血管内皮细胞感受到剪切应力减少,紧接着细胞膜去极化、活性氧(reactive oxygen species,ROS)产生,随后胞内Ca2+浓度升高[79‑80,84],上述研究只建立了应力变化与胞内Ca2+浓度变化的相关性,并未将应力、应变与VGCC联系起来。
关注于缺血或剪切应力变化导致的膜去极化与胞内Ca2+浓度变化过程的相关研究,则解释了应力变化、VGCC、胞内Ca2+三者之间的潜在关系。起初,Tozawa等[85]用膜电位调节剂和ROS抑制剂对膜去极化、ROS的产生与Ca2+内流的关系进行实验研究。研究表明缺血导致膜去极化,其中K+通道失活是膜去极化的机制,这是肺内皮细胞缺血的最初表现。应用克罗卡林(cromakalim),一种K+通道开放器,可以使内皮细胞膜超极化,减弱了缺血诱导的去极化,并抑制缺血期间Ca2+的增加。这表明,内皮细胞膜去极化导致细胞内Ca2+增加。因此,Ca2+内流可能是由VGCC 介导的,VGCC 被缺血诱导的膜去极化激活。需要注意的是,许多报道表明VGCC在培养的内皮细胞中不存在,是由于在静态细胞培养过程中可能会丢失这些通道,但暴露于剪切应力的原位肺内皮细胞拥有这些通道[85]。
进一步,Song等[86]明确了缺血开始后内皮细胞变化与时间的关系。第1秒内发生膜去极化,1~2 s 检测到血管内H2O2增加,10~15 s 之间细胞内Ca2+浓度增加。该时间关系表明内皮细胞在缺血后按顺序发生了以下一系列事件:膜去极化、H2O2生成、细胞内Ca2+增加和NO 生成。细胞对缺血的快速有序响应表明剪切应力通过合适的“传感器”在内皮细胞的稳态中起着重要作用。Chatterjee 等[87]给出了“传感器”的构成及作用,并总结了内皮细胞感受剪切应力变化并传递信号的过程。实际上,剪切应力改变是缺血的一种表现。血流的停止是由一个位于内皮细胞小窝的“ 机械小体(mechanosome)”感受到的,该小体由血小板内皮细胞黏附分子、血管内皮生长因子受体、血管内皮细胞钙黏连蛋白(VE cadherin)等构成[88]。机械小体的激活导致Katp通道关闭,引起内皮细胞膜的去极化。胞膜去极化还导致T 型VGCC 的打开,细胞内Ca2+增加,一氧化氮合酶的激活和NO 的生成。由于流动的刺激使机械小体保持激活和Katp通道开放,可以认为机械小体既能感知剪切的开始也能感知剪切的停止,它应该以Off‑On 状态存在。Off‑On模式如何打开或关闭K+通道目前还不清楚。另外,目前机械小体工作的确切机制也不是很清楚,仍需要后续的研究工作来揭示。
参考以上研究,本文总结了内皮细胞VGCC响应应力、应变的功能图(图2c)。
2.4 其他作用
尽管内皮细胞VGCC 的主要作用体现在调节内皮舒张和收缩、响应应力或应变等方面,仍有一些其他的作用被发现(图2d)。一些递质、激素激活的离子通道具有胞内游离钙浓度依赖的特性。例如,激活剂为缓激肽的钾离子通道的开闭,受胞内钙离子浓度变化的激活;激活剂为组胺的阳离子通道的开闭,依赖于胞内钙离子的存在;Mn2+/Ca2+通道的开闭,依赖于胞内钙离子的存在,并被肌醇1,3,4,5‑四磷酸激活(IP4,一种IP3 的代谢产物)。其中VGCC 作为细胞内钙离子浓度调控的关键通道参与了以上受体、配体的结合及通道的门控[89]。另外,VGCC 在内皮细胞激活‑分泌耦合机制中起着重要作用。Bkaily 等[18]发现血小板活化因子诱导刺激胞内钙浓度的变化以及血管内皮细胞随后释放血管活性因子,如内皮细胞舒血管因子和内皮素1是通过激活R型VGCC介导的。
3 讨 论
目前,除VGCC 外,在内皮细胞膜表面还存在多种钙离子通道,包括钙池调控钙通道、环核苷酸门控性离子通道(cyclic nucleotide‑gated channels,CNG)、瞬时受体电位通道(transient receptor potential channel,TRP)、嘌呤碱样受体门控性阳离子通道(purinergic ligand‑gated receptor‑channel,P2X)等。这些离子通道通过影响钙信号,在多种生理和病理过程中也发挥着重要作用。例如,Shalom等[90]发现环核苷酸门控性离子通道可在超极化状态下开放,并在调节NO分泌水平方面起重要作用。Freichel 等[91]发现,TRPC4 缺陷型小鼠的动脉环,对乙酰胆碱诱发的血管舒张反应不敏感。原因是在动脉内皮细胞中,TRPC4 的缺失会使ATP 和乙酰胆碱诱发的钙内流减少。该内流会增强内皮细胞产生舒血管活性物质,如NO、内皮源性超极化因子(endothelium derived hyperpolarizing factor,EDHF)和前列环素,从而降低血管紧张度。另外,已有很多关于内皮细胞存在P2X 的研究报道,并且肯定了P2X4 和P2X7 在内皮细胞分布的普遍性[92]。
需要注意的是,尽管VGCC 同上述其他一些胞膜钙通道均在诸多生理或病理过程中发挥重要作用,但是诱发方式却有很大不同。VGCC由膜电位改变的方式特异性诱发,而钙池调控钙通道是由内质网内钙库耗竭触发的一种外钙内流通道;环核苷酸门控性离子通道是一种与cAMP及cGMP直接结合后激活的离子通道;嘌呤碱样受体门控性阳离子通道为一种嘌呤碱样的受体门控性阳离子通道,与胞外ATP 结合时被打开,允许Na+和Ca2+等阳离子通过;瞬时受体电位通道由ATP、内皮素、乙酰胆碱、多种生长因子、温度、膜张力等诸多因素激活。可以看到,仅VGCC 由膜电位变化激活,其他通道大多为受体配体结合的方式激活。因此,在某些特定生理环境或体外培养条件下,可以通过控制诱发因素的方式特定的研究某一种通道的特性及功能。
通过结合生物化学、分子生物学和生物物理等方法,对复杂的内皮细胞VGCC 系统的研究已经取得一定的进展。然而,该领域目前所研究的内皮细胞VGCC 的种类不是很多,机制上阐明的也不是很透彻。目前,最主要问题是现有研究数据显示VGCC表达存在显著的类型异质性。例如,人脐静脉内皮细胞不存在VGCC[12‑13,22‑23],而人主动脉内皮细胞、人肱动脉内皮细胞、人乳腺动脉内皮细胞存在VGCC[18,29‑30]。这可能与动静脉差异有关,内皮细胞的形态和功能特征因血管类型和血管范围的不同而不同[21]。人脐静脉内皮细胞的胚胎性质不同于成人组织细胞,脐静脉执行动脉功能,如将氧气和营养物质从胎盘运送到胎儿,而它的血压和氧张力与静脉很接近[93]。因此,人脐静脉内皮细胞电生理特征可能主要由胚胎起源和微环境的局部效应决定,而不是严格由血管大小决定。此外还关注到,同为主动脉内皮细胞,人主动脉内皮细胞存在VGCC而牛主动脉内皮细胞不存在[14‑15,18];牛肺动脉内皮细胞不存在VGCC 而小鼠肺动脉内皮细胞存在VGCC[13,27]。造成这些差异的原因尚不清楚,但可能与物种间多态性有关,或许仅仅是由于培养条件的差异。
另外,早期对VGCC 的研究多为电生理学研究,采用膜片钳技术。尽管膜片钳技术有很强的记录分析功能,然而单纯应用仍远不足以研究、解释内皮细胞活动的许多现象。因此,出现了与其他技术的结合运用:膜片钳技术与显微荧光测钙技术相结 合[15‑16,94];显 微 荧 光 测 钙 技 术 与PCR 相 结 合等[28,33,94]。考虑到VGCC肩负转运钙离子的作用,对Ca2+的测量显得尤为重要。直到今天,最突出的Ca2+指示剂为fura‑2,一种比例计量化学荧光Ca2+敏感染料,适合观测全细胞Ca2+浓度的改变[95]。然而,与所有化学荧光指标相比,fura‑2具有一些严重的缺点,包括紫外线激发引起的光毒性、亚细胞靶向困难和对活体动物的适用性差。鉴于荧光共振能量转移(FRET)技术具有适于定量分析、便于实时监测、灵敏度高等优点,科学家们发展了基于FRET 的基 因 编 码探针(FRET‑based GEPs)。Miyawaki等[96]在1997年成功设计了世界上第一个基于FRET 的基因编码Ca2+指示剂Cameleons。如今,这种指示剂的种类变化繁多。对不同细胞器具有不同Ca2+敏感性的变种也已产生。最常用的探针包 含 D1、 D2cpV、 D3cpV、 4mtD1GO‑Cam、D1ERCmR2 等[96‑98]。未来VGCC 的研究工作也许可以考虑对实验技术手段给予更多的关注和思考,更多应用诸如基因编码检测技术、膜片钳技术、显微荧光测钙技术等技术的结合对钙离子进行测量,以提高结果的精确性。
4 总结和展望
综上所述,本文回顾了人脐静脉内皮细胞、人主动脉内皮细胞、牛肺动脉内皮细胞、牛主动脉内皮细胞、猪冠状动脉内皮细胞、大鼠肺微血管内皮细胞等主要内皮细胞中VGCC 存在与否的研究成果。同时,本文探讨了VGCC在血管内皮舒张和收缩活动、细胞迁移和增殖、响应应力或应变等生理活动中发挥的作用。
随着科学技术和内皮细胞功能知识的发展,对VGCC和Ca2+动力学的理解显著加强,其电生理特性也被周知,其通过VGCC调控兴奋性、分泌、迁移是内皮细胞功能的关键机制。一方面,血管内皮细胞迁移在伤口愈合、动脉粥样硬化和血管生成等生理过程中起着重要作用[71]。另外一方面,血管内皮细胞在炎症反应的诱导中发挥着独特的作用。内皮细胞的运动和收缩通过调节白细胞的迁移和血浆蛋白的渗漏直接影响炎症反应[99]。细胞内Ca2+浓度变化可能是调控内皮屏障功能的关键信号,以应对渗透性增强剂,如缓激肽和凝血酶[100‑101]。因此,对VGCC的深入而广泛的研究对揭示并治疗诸如原发性高血压、动脉粥样硬化等内皮功能性疾病有着十分重要的意义。值得注意的是,受体门控通道激活与内皮源产物的释放有关,也与VGCC产生的离子电流有关。这两个过程之间的联系也将为未来研究提供一个重要方向。

