基于感官评价和分子对接的Pro、Glu二肽与鲜味受体构效关系
赵孟斌,顾华蓉,穆洪涛,高向阳*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,岭南现代农业科学与技术广东省实验室,广东广州 510642)(2.广东第二师范学院生物与食品工程学院,广东广州 510303)
鲜味,是继酸、甜、苦、咸味后,第五个被确定的基本味觉,具有增加食物口感丰富性和令人舒服愉快的特点[1]。引起鲜味的物质根据化学成分可分为氨基酸类、核苷酸类、有机酸类、有机碱类和鲜味肽[2],其中鲜味肽是一种分子量约为150~3 000 u的小分子肽,具有增鲜、增香及增强食品整体味感作用,并且有良好的加工特性、热稳定性和营养价值。鲜味肽不仅具有鲜味,而且可以掩盖和减弱苦味以改善食品风味[3],与其他物质协同增鲜还可减少食盐和谷氨酸钠的摄入[4]。1978年,Yamasaki等[5]首次从木瓜蛋白酶水解的牛肉水解液中分离纯化得到氨基酸序列为Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala的鲜味肽,目前已经发现鲜味肽在鱼类[6]、鸡汤[7]、火腿[8]和菌类[9]等许多食品中广泛存在,是食品中重要的呈味物质。现阶段对鲜味肽的研究主要集中在分离鉴定等方面,具体的呈鲜机理与构效关系尚不明确。鲜味在人体的感知主要依靠异源二聚体味觉受体第一家族亚型1/3(Taste Receptor Type 1/3,T1R1/T1R3)[10]、味型代谢性谷氨酸受体4(Metabotropic Glutamate Receptor 4,mGluR4)[11]、胞外钙敏感受体(Calcium-sensing Receptor,CaSR)[12]和G蛋白偶联受体C家族6组A亚型(G Protein-coupled Receptor Family C Group 6 Member A Receptor,GPRC6A)[13],均属于G蛋白偶联受体家族的C亚族,可广泛感知多种鲜味物质,将鲜味信号传递至大脑[14],但人类鲜味受体的晶体结果尚未被完全解析[15],因此有必要通过蛋白质结构预测来获得其三维结构,利用计算机辅助受体-配体结合的分子对接技术,从小分子(配体)及蛋白大分子(受体)各自的三维结构入手,检验两者结合能力,预测其结合模式及关键结合位点,分析鲜味肽与受体间的相互作用,有助于阐明鲜味肽呈鲜机制。
本研究以鱼露中鉴定得到的脯氨酸二肽和谷氨酸二肽[16]为研究对象,通过分子对接技术表征二肽与T1R1、T1R3及CaSR鲜味受体的结合模式,寻找二肽与鲜味受体结合的关键位点,同时结合二肽的呈鲜强度与阈值来探究其呈鲜机理与构效关系。
1 材料与方法
1.1 材料与数据库
谷氨酸钠、蔗糖、柠檬酸、氯化钠均为食品级,购自广州利成实业有限公司。奎宁:色谱纯,购自广州丛源仪器有限公司。
根据前期实验分离鉴定得到的鱼露寡肽序列[17],从中选取12个二肽:丝氨酸-脯氨酸(Serine-proline,Ser-Pro)、脯氨酸-丝氨酸(Proline-serine,Pro-Ser)、丙氨酸-脯氨酸(Alanine-proline,Ala-Pro)、脯氨酸-丙氨酸(Proline-alanine,Pro-Ala)、缬氨酸-脯氨酸(Valine-proline,Val-Pro)、脯氨酸-缬氨酸(Proline-valine,Pro-Val)、γ-谷氨酸-蛋氨酸(γ-Glutamic Acid-methionine,γ-Glu-Met)、蛋氨酸-谷氨酸(Methionine-glutamic Acid,Met-Glu)、γ-谷氨酸-甘氨酸(γ-Glutamic Acid-glycine,γ-Glu-Gly)、甘氨酸-谷氨酸(Glycine-glutamic Acid,Gly-Glu)、γ-谷氨酸-亮氨酸(γ-Glutamic Acid-leucine,γ-Glu-Leu)和亮氨酸-谷氨酸(Leucine-glutamic Acid,Leu-Glu),采用固相合成法合成以上二肽,并进行脱盐处理,使纯度≥98%,委托生工生物工程(上海)股份有限公司完成。
鲜味受体蛋白均来自Uniprot蛋白数据库(https://www.uniprot.org):T1R1、T1R3和CaSR的检索号分别为Q7RTX1、Q7RTX0、P41180。模板蛋白来自PDB数据库(https://www.rcsb.org)。
序列对比、同源建模及模型评估涉及的平台:SWISS-MODEL(https://swissmodel.expasy.org)、NCBI(https://www.ncbi.nlm.nih.gov)、SAVES v6.0(https://saves.mbi.ucla.edu/)。
1.2 实验方法
1.2.1 感官评价
感官评价小组由20名味觉正常人员组成(10女10男,20~25岁),并依据GB/T 16291.1-2012[18]接受了感官培训以辨别五种基本味觉(酸、甜、苦、咸、鲜)。参考丛艳君等[19]分别以柠檬酸(0.8 mg/mL)、蔗糖(10 mg/mL)、奎宁(0.8 mg/mL)、氯化钠(3.5 mg/mL)和谷氨酸钠(3.5 mg/mL)作为酸、甜、苦、咸、鲜的评价标准,配制2 mg/mL合成肽供评价小组进行感官描述。采用三角试验法[20]确定二肽的呈鲜阈值,样品用超纯水溶解,将起始质量浓度为2 mg/mL的合成肽溶液逐级稀释,至评价小组无法品尝出溶液中的鲜味,则该合成肽的呈鲜阈值即为倒数第2个合成肽溶液的质量浓度值。采用各感官评价员评定结果的平均值,且每个评定员之间的误差应不超过2个稀释水平。感官评价在恒定温度(24±1)℃下进行。
1.2.2 鲜味受体同源建模与能量优化
获取目标蛋白序列后,于NCBI网站进行protein blast比对,以序列覆盖率较高、E值小于10-5以及序列相似性大于30%为标准[21],选取打分较高的蛋白作为备选模板。利用SYBYL-X 2.0将模板与目标蛋白进行序列比对,选取序列一致性最高且RMSD值最小的模板,利用SWISS-MODEL进行建模。利用SYBYL-X 2.0软件中的Powell法对模型进行能量最小化(Minimize)处理。
1.2.3 模型评估
利用拉氏图与Verify 3D对优化后的模型进行结构评估。
1.2.4 Pro、Glu二肽与鲜味受体的分子对接
1.2.4.1 小分子配体的准备
通过SYBYL-X 2.0中的sketch模块与蛋白质自动生成模块建立目标二肽结构,采用tripos力场对二肽分子进行能量最小化处理。
1.2.4.2 分子对接
采用Docking suite模块准备模块蛋白与二肽分子。对模块蛋白进行末端残基修复与加氢处理后,Automatic模式生成活性口袋,Surflex for searching模式对二肽分子进行准备处理,最后利用Surflex-Dock Screen模式进行分子对接,计算受体与配体的对接分值并预测结合位点,综合考虑打分函数的一致性,选择对接总评分最高的构象以进行后续分析研究。
1.2.4.3 配体-受体相互作用研究
利用SYBYL-X 2.0中的Merge功能将配体的最优对接构象与受体进行合并,得到配体-受体复合物,再利用Proteins Plus中的PoseView 2D interaction diagrams模块做出配体与受体的相互作用模式图。利用SYBYL-X 2.0中的MOLCAD模块创建分子表面。
1.2.5 数据分析
分子对接所用软件为SYBYL-X 2.0。二肽与鲜味受体结合的2D模式图利用在线服务器Proteins Plus(https:proteins.plus/)得出。
2 结果与讨论
2.1 Pro、Glu二肽的感官评价
对合成Pro、Glu二肽进行感官评价,结果见表1。除Pro-Ser、Val-Pro和Leu-Glu不呈鲜,其余二肽的呈鲜阈值均低于谷氨酸钠阈值(0.3 mg/mL)。其中γ-Glu-Met和Gly-Glu的呈鲜阈值最低,为0.07 mg/mL,说明其鲜味强度最高,Pro-Ala的呈鲜阈值最高,为0.21 mg/mL,说明其鲜味强度最低。呈鲜阈值较低的肽如γ-Glu-Met、Gly-Glu、Ser-Pro、Ala-Pro、Pro-Ala和Pro-Val等具有较强的鲜味。所有二肽均未表现出苦味,表明含有疏水性氨基酸的二肽不一定呈现苦味,可能是由于部分疏水性基团对呈鲜起辅助作用[22]。呈鲜味的二肽都伴随着一定的酸味和甜味,Zhang等[23]也发现鲜味肽除了呈鲜味,也呈酸味、苦味和甜味,证明鲜味肽并不是呈单一鲜味,而是具有以鲜味为主的多种呈味效果,对鲜味肽呈鲜起重要作用。具有相同氨基酸但排列顺序不同的二肽呈鲜阈值有差异,当Pro位于肽链C端时,二肽呈鲜阈值相对较低,表明鲜味肽的鲜味与其氨基酸排列顺序及肽链的构效有关。γ-Glu-Met和Gly-Glu均比其相反氨基酸序列二肽的呈鲜阈值低,可能是由于相反序列导致二肽空间构效差异,改变肽与受体的相互作用,影响肽与受体的结合位置,使其产生不同的呈鲜效果。

表1 二肽的感官评价结果Table 1 The sensory evaluation of dipeptides
2.2 鲜味受体同源建模
T1R1、T1R3及CaSR受体同源模板结果如表2~4所示,T1R1和T1R3模板序列覆盖率均≥54.00%,E值均接近于0。E值越低则打分结果越可靠[21]。序列相似性大于30%表明模型可靠[21],CaSR模板序列一致性≥64.00%,同源性较高。RMSD表示模板蛋白与目标蛋白的结构一致性,该值越小则蛋白的结构一致性越强。因此T1R1、T1R3建模模板为5x2m,CaSR建模模板为5fbh,其他学者也采用了5x2m[21]和5fbh[24]作为建模模板。
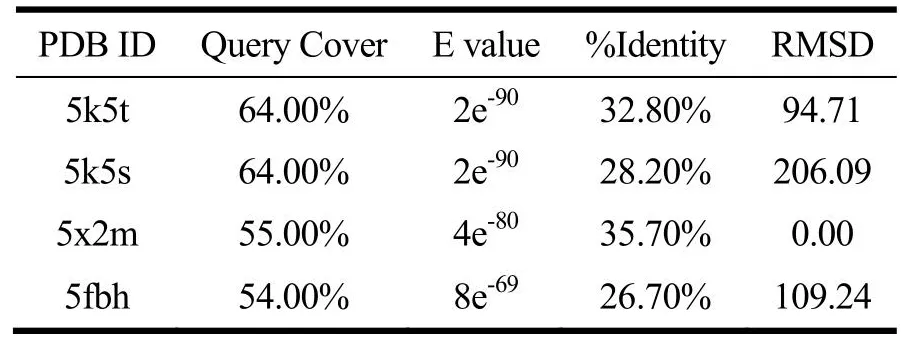
表2 T1R1同源模板序列比对结果Table 2 Sequence alignment results of T1R1 homologous template

表3 T1R3同源模板序列比对结果Table 3 Sequence alignment results of T1R3 homologous template
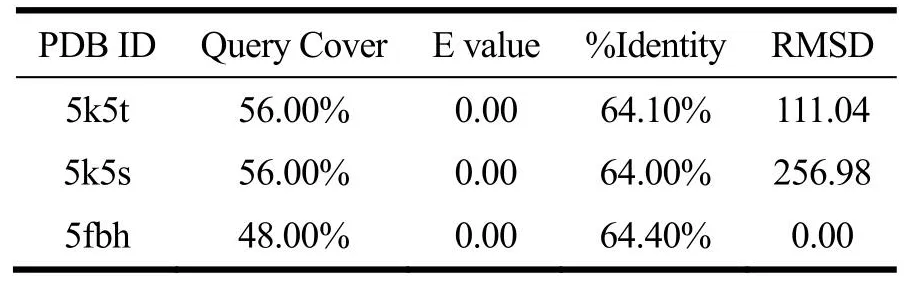
表4 CaSR同源模板序列比对结果Table 4 Sequence alignment results of CaSR homologous template
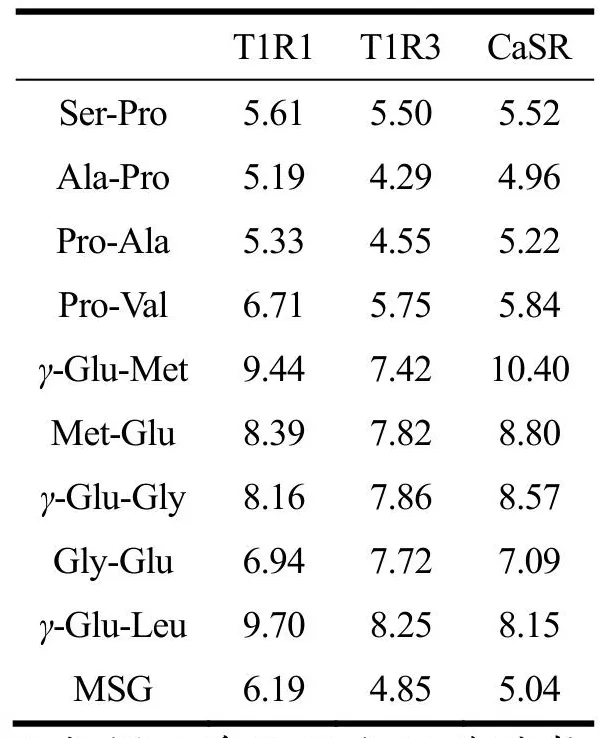
表5 二肽与T1R1、T1R3及CaSR受体的分子对接评分Table 5 Molecular docking score of dipeptides with T1R1,T1R3 and CaSR receptors
2.3 模型评估
T1R1、T1R3和CaSR受体的模型图、拉氏图与Verify 3D打分结果如图1、图2所示,图1中a、c为受体蛋白模型图,b、d为拉氏图,e、f和图2c为Verify 3D评分图。
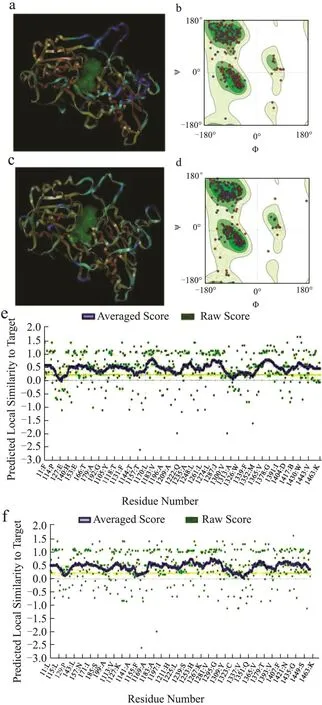
图1 T1R1(a、b、e),T1R3(c、d、f)模型结构与模型评估Fig.1 T1R1 (a, b, e), T1R3 (c, d, f) model structure and model evaluation
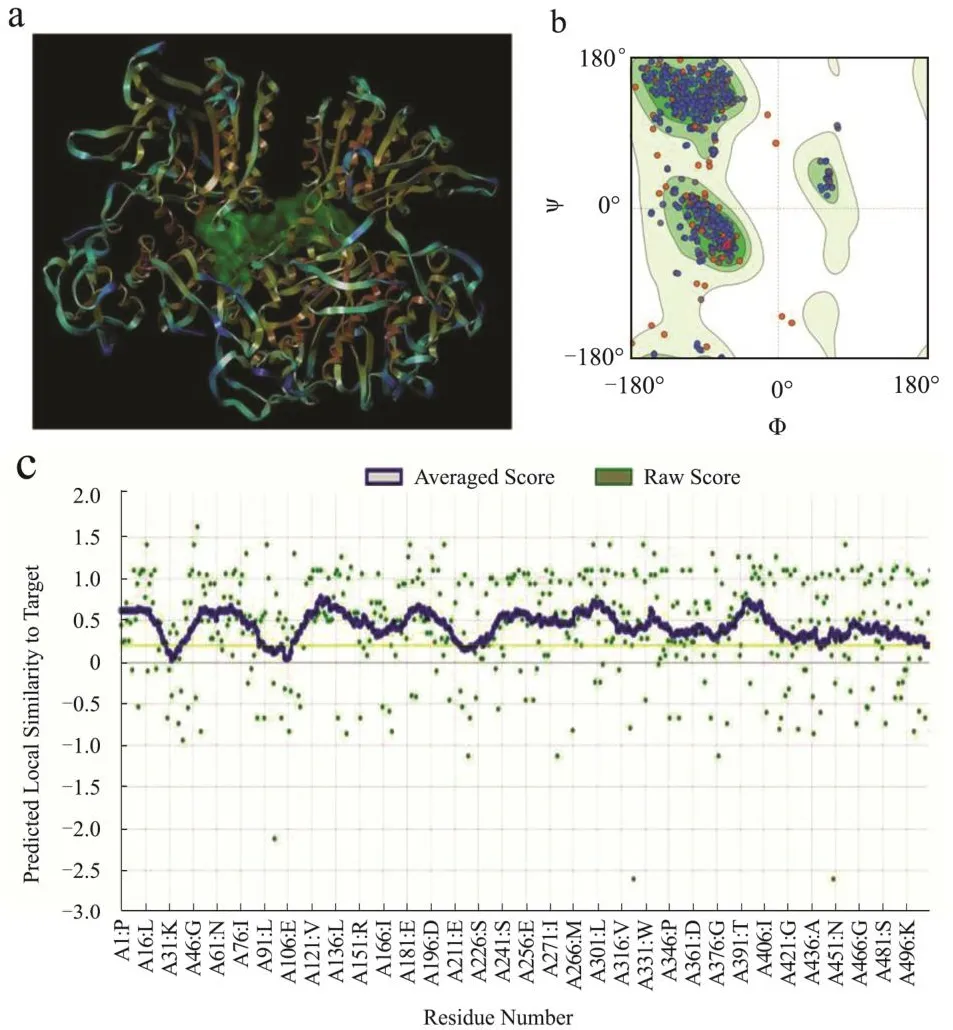
图2 CaSR模型结构与模型评估Fig.2 CaSR model structure and model evaluation
拉氏图中的圆点代表蛋白的氨基酸残基,绿色越深则氨基酸残基构象越合理,白色区域为不可接受区[25]。结果显示,T1R1模型中99.13%的氨基酸处于合理区,其中94.14%处于最适区,4.99%处于可接受区;T1R3模型中98.07%的氨基酸处于合理区,其中92.70%处于最适区,5.37%处于可接受区;CaSR模型中99.12%的氨基酸处于合理区,其中95.71%处于最适区,3.41%处于可接受区。当不低于90%的ψ,φ二面角分布在可接受区则表明模型合理[26],因此3个模型均合理。Verify 3D打分显示模型均具有超过90%的氨基酸残基3D/1D值大于0.2,表明模型质量合格。三个受体蛋白的配体结合口袋如受体模型图中绿色区域所示,均位于受体中心的空腔区域,位置与前人研究结果基本一致[24,27,28]。
2.4 二肽与鲜味受体的分子对接
2.4.1 对接评分
选择感官评价结果中呈鲜的4个Pro二肽和5个Glu二肽及鲜味基准物谷氨酸钠(MSG)与T1R1、T1R3及CaSR受体进行分子对接评分,考虑了分子极性、疏水性、焓和溶剂化等因素,对配体与受体的结合亲和程度,一般认为评分≥7表示受体与配体结合能力强,小于4则结合能力弱[29]。
Pro二肽与T1R1对接评分均高于与T1R3和CaSR的评分,与T1R1结合较为紧密,顾华蓉等[30]在Pro二肽呈鲜特性中也发现T1R1可能是Pro二肽呈鲜的重要受体。
Glu二肽与受体的对接评分均大于6.90,同时也均大于MSG的相应对接评分,大多数超过8分,肽与受体的亲和程度较高。除Gly-Glu和γ-Glu-Leu,其余Glu二肽与T1R1和CaSR的对接评分高于T1R3,提示Glu二肽主要与T1R1和CaSR结合呈鲜,可能与T1R3受体特殊的结合构象有关[31]。与T1R1和CaSR的对接评分显示,N-γ-Glu二肽的评分均高于相同氨基酸组成的C-Glu二肽,与T1R1和CaSR结合更为紧密,进一步说明鲜味肽呈鲜效果与氨基酸排列顺序有关,Masahiro等[32]发现二肽氨基酸顺序排列相反时,Lys-Glu不具有鲜味,Glu-Lys具有鲜味,与本研究结果类似。
2.4.2 二肽与鲜味受体结合的关键氨基酸残基分析
表6为二肽与鲜味受体的对接能量。Glu二肽的对接能量整体大于Pro二肽,对接能量越低,肽与受体结合的亲和力越强,说明Glu二肽更易与受体结合。其中γ-Glu-Met和Gly-Glu进入T1R1、T1R3和CaSR结合腔所需能量最低,结合的亲和力最强,可能是由于能更嵌入到受体的结合口袋部位,最终导致γ-Glu-Met和Gly-Glu的呈鲜阈值低。

表6 二肽与鲜味受体的对接能量(kcal/mol)Table 6 The docking energies of dipeptides with umami receptors
表7中结合位点Asp147和Arg277出现频率和成键数量均较多,可能是二肽与T1R1的关键结合位点。Thr149和Ser172出现4次,与T1R1形成氢键的均为Glu二肽,同时Thr149是MSG与T1R1的结合位点,Thr149和Ser172可能是Glu二肽与T1R1结合的关键位点,与其他学者的研究结果一致[26,33],T1R1是Glu二肽呈鲜的重要受体。Liu等[28]和Zhang等[33]鉴定出T1R1的关键氨基酸残基有D147、S148、T149、S172、Y220、R277、Q278、A302,S385,除Ala302外,其余残基也在本研究中Pro、Glu二肽与T1R1的对接位点,进一步证明其具有呈鲜特性。

表7 二肽与T1R1受体的结合位点Table 7 Binding sites of dipeptides to T1R1 receptor
表8中Glu45、Ser147、Val277和His278出现频率和成键数量较多,Ser147同时是MSG与T1R3的结合位点,这些残基可能是二肽与T1R3的关键结合位点。与Ser147结合的均为N-γ-Glu二肽,而谷氨酸位于C端的二肽,除Gly-Glu外其余均不能与Ser147结合,Ser147可能是N-γ-Glu二肽与T1R3的关键结合位点。Pro、Glu二肽均能在His145、Ser147、Ser170和Gly168结合T1R3,Cascales等[34]发现这些位点是T1R3上的关键氨基酸残基,进一步表明二肽可通过T1R3受体呈鲜。

表8 二肽与T1R3受体的结合位点Table 8 Binding sites of dipeptides to T1R3 receptor
表9显示Leu173、Asn176、Gln179、Arg220和Ser244是Pro、Glu二肽与CaSR结合较多的位点,其中在Asn176、Gln179残基处对接的肽有5个,成键数也较多,这些位点可能是二肽与CaSR的关键结合位点。Pro二肽中的Pro-Ala与Ser-Pro分别在Asp275处与受体形成3或4个氢键,主要原因是其引起鲜味受体细胞产生强烈信号[30],产生较多的氢键结合;除Gln179和Asp275位点外,其余4个位点主要结合Glu二肽,氢键数也较多,说明相比于Pro二肽,Glu二肽更易与CaSR结合。Asn102、Asp216、Ser272、Asp275是CaSR激活剂与CaSR的相互作用位点[24],部分二肽可在这些位点与CaSR形成氢键,进一步验证Pro、Glu二肽也能通过与上述残基结合激活CaSR受体。
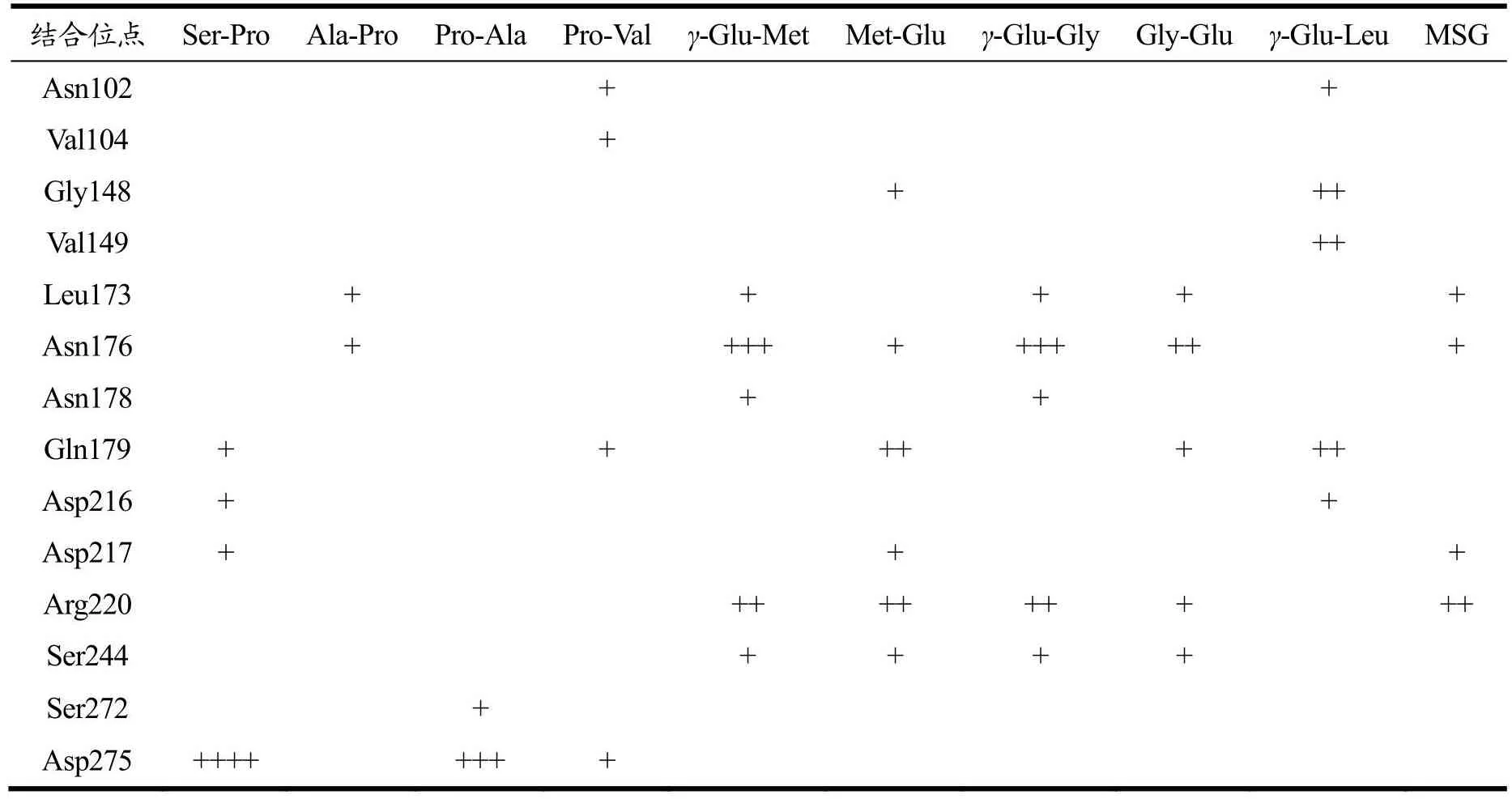
表9 二肽与CaSR受体的结合位点Table 9 Binding sites of dipeptides to CaSR receptor
2.4.3 Pro、Glu二肽的呈鲜构效关系
Pro、Glu二肽与T1R1、T1R3和CaSR不同的结合能力影响鲜味阈值和呈鲜强度,主要与二肽与受体间的构效关系有关,因此分析了Pro、Glu二肽及其潜在鲜味受体的构效关系,同时分别将未呈鲜二肽Pro-Ser、Val-Pro和Leu-Glu的受体-配体结合情况与鲜味较强的Ser-Pro、Pro-Val和Glu-Leu进行对比,探究导致其呈鲜效果差异的原因。
图3显示Ser-Pro与T1R1受体上的Ser107、Ser148、Asp218、Arg277及Gln278 残基形成氢键,与Gln278存在疏水相互作用。图4中Pro-Ser的对接位点为Thr149、Asn150、Ser216及Ser276,比Ser-Pro少结合一个残基且不存在疏水接触。疏水相互作用是受体-配体结合的驱动力[35,36],当配体与受体的疏水区发生相互作用时,其间的水分子从疏水区排出,增加配体与受体的结合亲和力,Ser-Pro与T1R1的疏水接触使结合更加稳定;Ser-Pro中丝氨酸位于N端有一个游离的氨基与受体形成氢键,而Pro-Ser中N端脯氨酸的亚氨基未能与受体形成氢键,因此Pro-Ser与T1R1的结合力相较于Ser-Pro更弱,Ser-Pro呈鲜阈值低,呈现较强鲜味,Pro-Ser不能呈鲜。
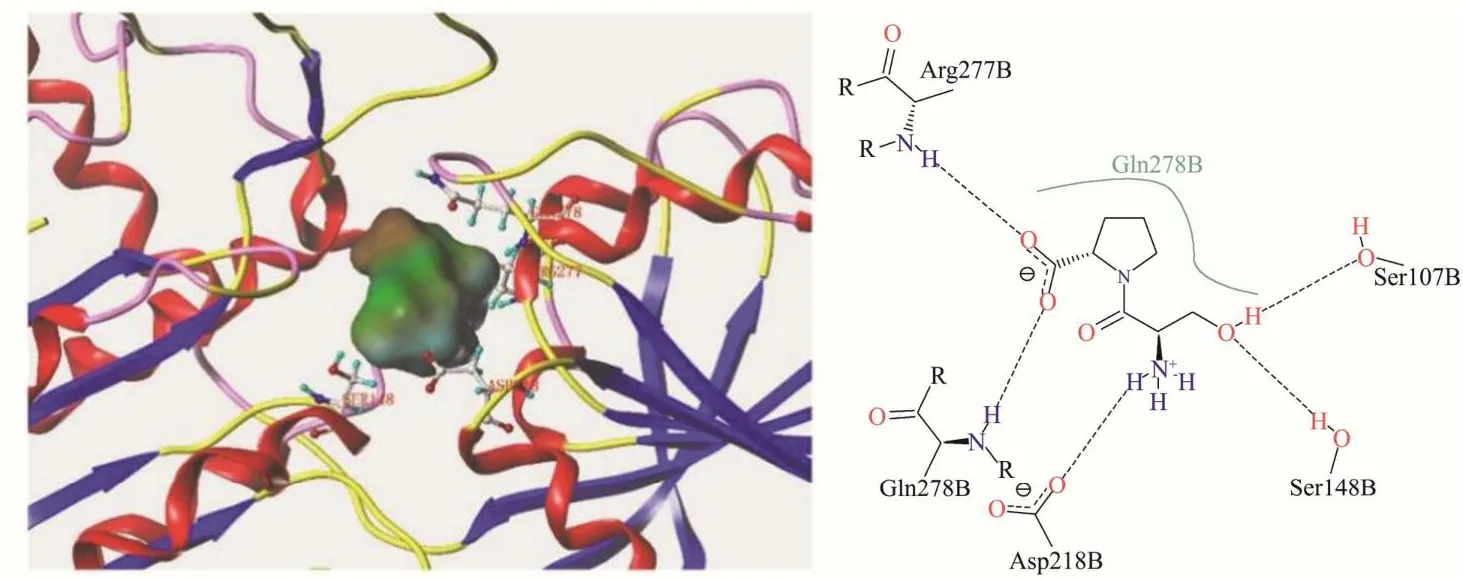
图3 Ser-Pro与T1R1受体结合模式图Fig.3 Binding pattern of Ser-Pro to T1R1 receptor
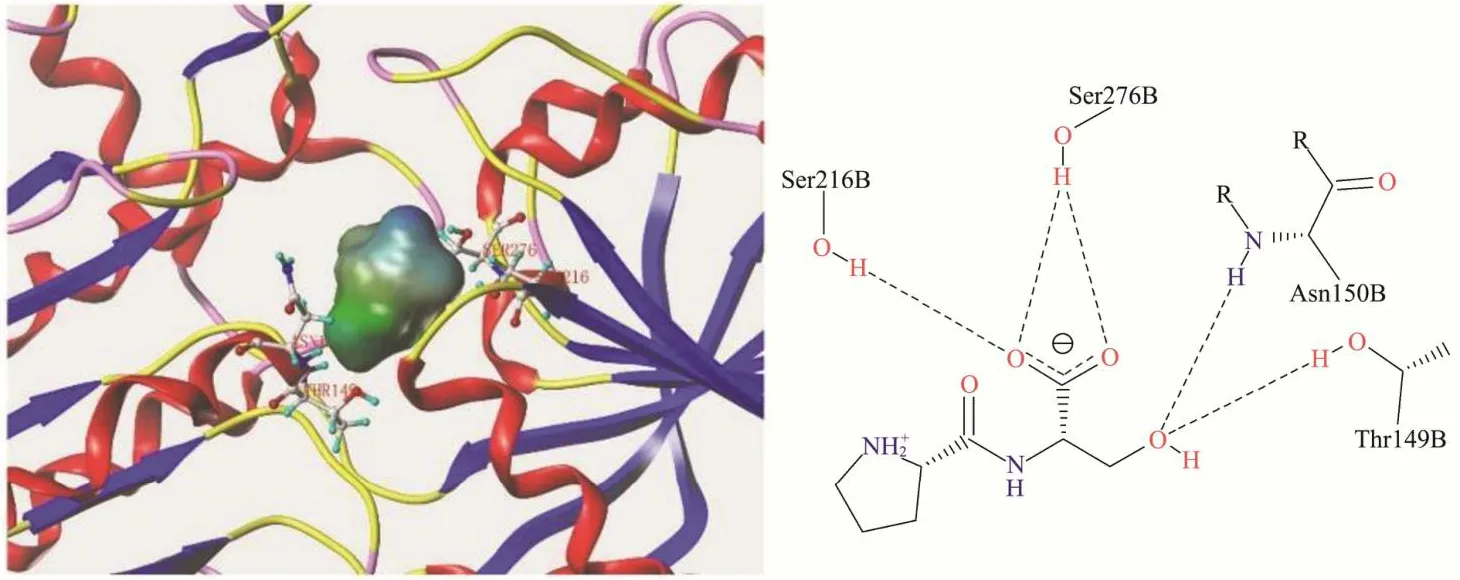
图4 Pro-Ser与T1R1受体结合模式图Fig.4 Binding pattern of Pro-Ser to T1R1 receptor
如图5和图6所示,Ala-Pro及Pro-Ala与T1R1均在Ser107与Asp147处对接,但Pro-Ala与Ala302残基间存在疏水接触,与T1R1的结合相对紧密。Ala-Pro及Pro-Ala与CaSR的结合位点完全不同,但均能形成氢键,丙氨酸是分子量仅大于甘氨酸的氨基酸,仅含有一个甲基,Ala-Pro与Pro-Ala由于分子量小、体积小更易与鲜味受体结合,Ala-Pro中的丙氨酸残基比Pro-Ala更接近受体活性口袋,因此Ala-Pro表现出较低的呈鲜阈值和较强鲜味,Dang等[37]报道在鲜味肽与鲜味受体研究中也发现小分子量的二肽或三肽更易与受体结合。

图5 Ala-Pro与T1R1(a)、CaSR(b)受体结合模式图Fig.5 Binding pattern of Ala-Pro to T1R1 (a), CaSR (b) receptor
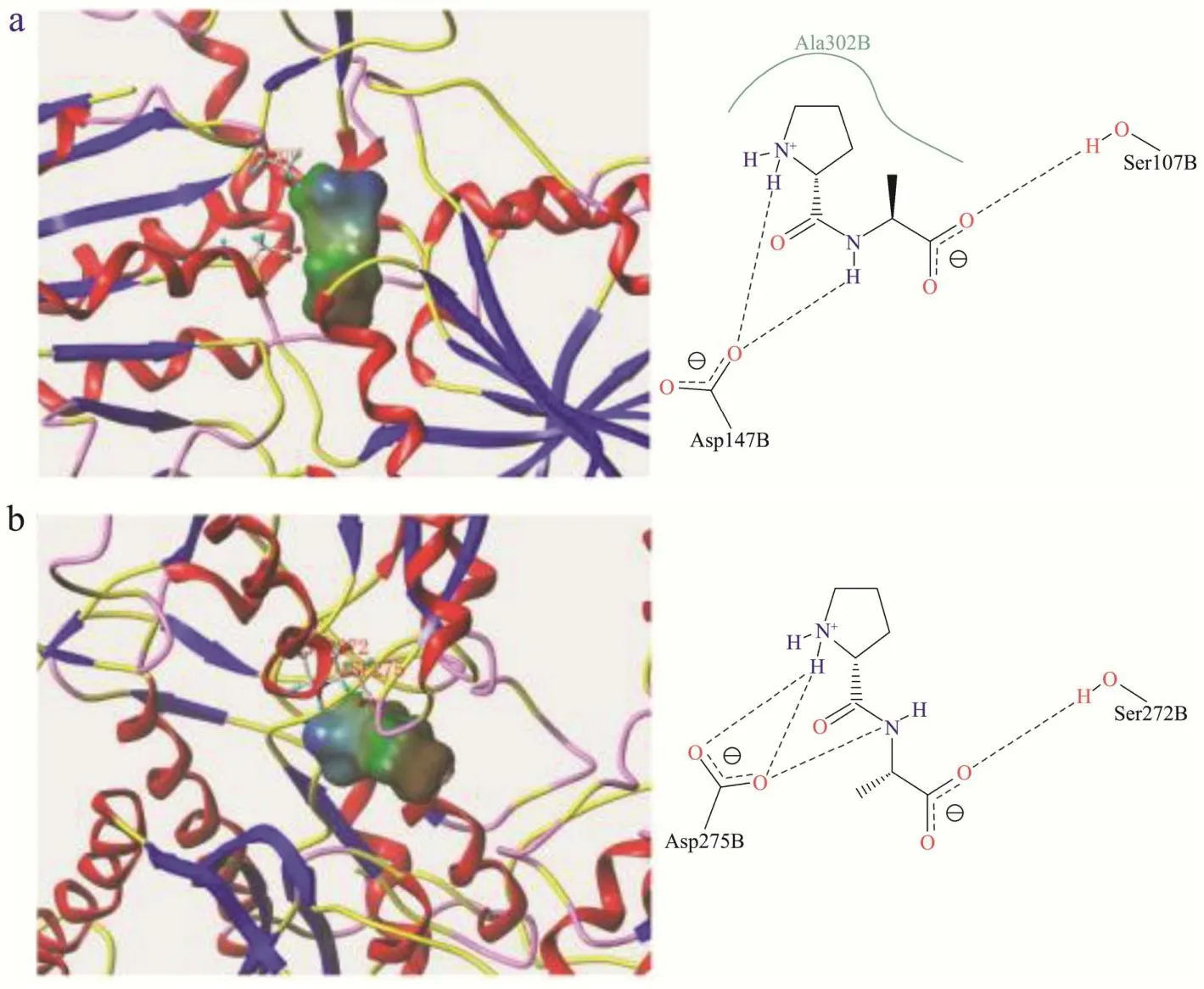
图6 Pro-Ala与T1R1(a)、CaSR(b)受体结合模式图Fig.6 Binding pattern of Pro-Ala to T1R1 (a), CaSR (b) receptor
由图7可知,Pro-Val和Val-Pro与T1R1均有3个对接位点,其中Pro-Val与Arg277结合形成两个氢键,Arg277是报道的关键氨基酸残基[26];Val-Pro与Ser276形成氢键,与Ser148及Ser276存在疏水相互作用,3D图显示Val-Pro的亲水区域暴露于受体外,未能与受体产生相互作用,可能与溶剂水结合,导致与T1R1的结合亲和力减弱。

图7 Pro-Val与T1R1(a)、T1R3(b)受体结合模式图Fig.7 Binding pattern of Pro-Val to T1R1 (a), T1R3 (b) receptor
Pro-Val和Val-Pro与T1R3之间均形成多个氢键且存在疏水接触,其中Pro-Val与Glu45及Val277均形成两个氢键,其疏水区被包裹在受体空腔内部,配体-受体复合物更加稳定;Val-Pro与图8中结合口袋左侧部分仅与His145的1个氢键连接,对接位置相比于Pro-Val更浅,疏水区域更接近结合口袋表面,导致Val-Pro与受体结合稳定性差,未能呈鲜。鲜味肽与T1R3的结合归因于C端氨基酸与受体关键氨基酸残基之间的静电相互作用、氢键等[38],不同的C端氨基酸残基使其产生有差异的结合力,导致Pro-Val和Val-Pro相反的呈味效果。
图9所示,γ-Glu-Met与CaSR有5个对接位点,形成8个氢键,其中与Asn176形成3个氢键,与Tyr246存在疏水接触。γ-Glu-Met分子各部分均可与CaSR形成相互作用,Glu残基嵌入受体深处,与受体结合更紧密,呈鲜阈值低至0.07 mg/mL。庄金达[39]研究发现鲜味肽与受体形成的疏水相互作用可增强二者的亲和力,与本研究结果一致。Met-Glu与CaSR有5个对接位点,形成9个氢键,从3D图可见Met-Glu的亲水区Glu残基朝向受体表面,易与溶剂水结合导致与受体亲和力减弱,与CaSR的对接评分(8.80)小于γ-Glu-Met,呈鲜阈值也高于γ-Glu-Met两倍多,故Met-Glu鲜味程度小于γ-Glu-Met,从受体与分子的角度表明γ-Glu-Met可通过结合CaSR受体呈现较强鲜味。

图9 γ-Glu-Met(a)、Met-Glu(b)与CaSR受体结合模式图Fig.9 Binding pattern of γ-Glu-Met (a), Met-Glu (b) to CaSR receptor
图10和11可知,Gly-Glu与多个氨基酸残基形成氢键,均完全嵌于两个受体结合口袋内部,可能与分子大小有关[37],Gly-Glu中甘氨酸的R基仅为一个氢原子,Gly-Glu分子更易进入受体的结合口袋。γ-Glu-Gly与T1R1、T1R3分别有5个或6个对接位点,氢键数较多,但呈味强度弱于Gly-Glu,可能与二肽与受体的结合位置有关:与T1R1的结合图可知,γ-Glu-Gly的亲水区趋向受体外表面,易与水分子亲和而减弱二肽与受体的结合力;在与T1R3结合时,γ-Glu-Gly分子整体位于结合口袋的浅表处,疏水区域暴露于受体表面,水溶液中的配体与受体结合不稳定,阮仕艳[40]发现鲜味肽与T1R3受体氢键数越多,距离越短,越能结合受体口袋,本研究中位于结合口袋浅表处的γ-Glu-Gly可能由于与受体口袋中心距离较远,使γ-Glu-Gly呈味强度弱于Gly-Glu。
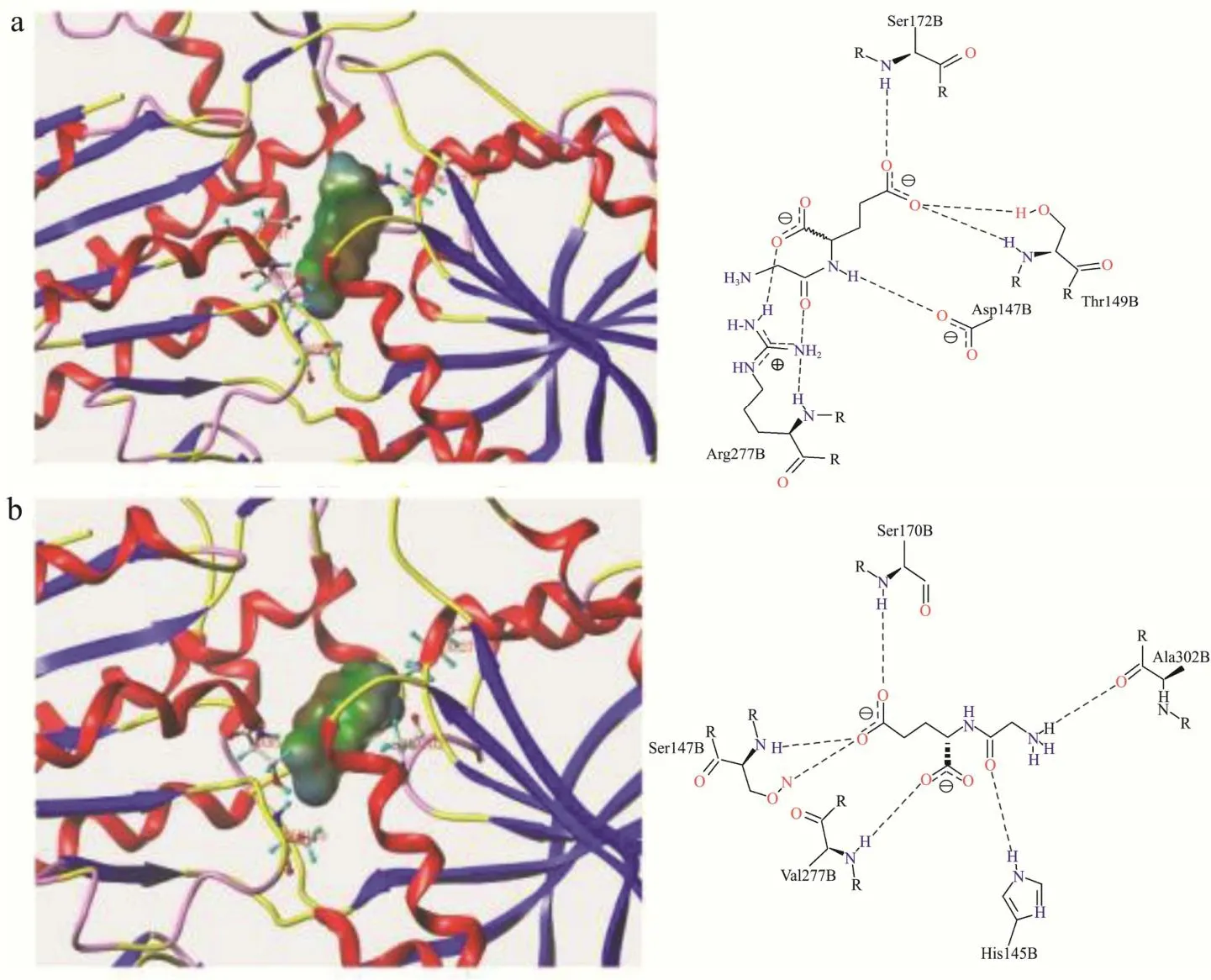
图10 Gly-Glu与T1R1(a)、T1R3(b)受体结合模式图Fig.10 Binding pattern of Gly-Glu to T1R1 (a), T1R3 (b) receptor

图11 γ-Glu-Gly与T1R1(a)、T1R3(b)受体结合模式图Fig.11 Binding pattern of γ-Glu-Gly to T1R1 (a), T1R3 (b) receptor
图12显示γ-Glu-Leu、Leu-Glu与T1R1均存在多个对接位点且形成7个氢键,但Leu-Glu的对接评分(7.60)远低于γ-Glu-Leu(9.70),感官评价显示Leu-Glu未呈鲜,上述结果表明Leu-Glu与T1R1的结合效果不理想,与二肽分子的对接位置有关。从3D图可见,γ-Glu-Leu以水平向的状态被包裹于受体结合口袋内部较深的位置,而Leu-Glu是以竖直向状态嵌于受体结合口袋,位置较浅,疏水区域暴露于受体表面,因此Leu-Glu与T1R1的结合稳定性弱于γ-Glu-Leu,导致呈鲜能力弱。
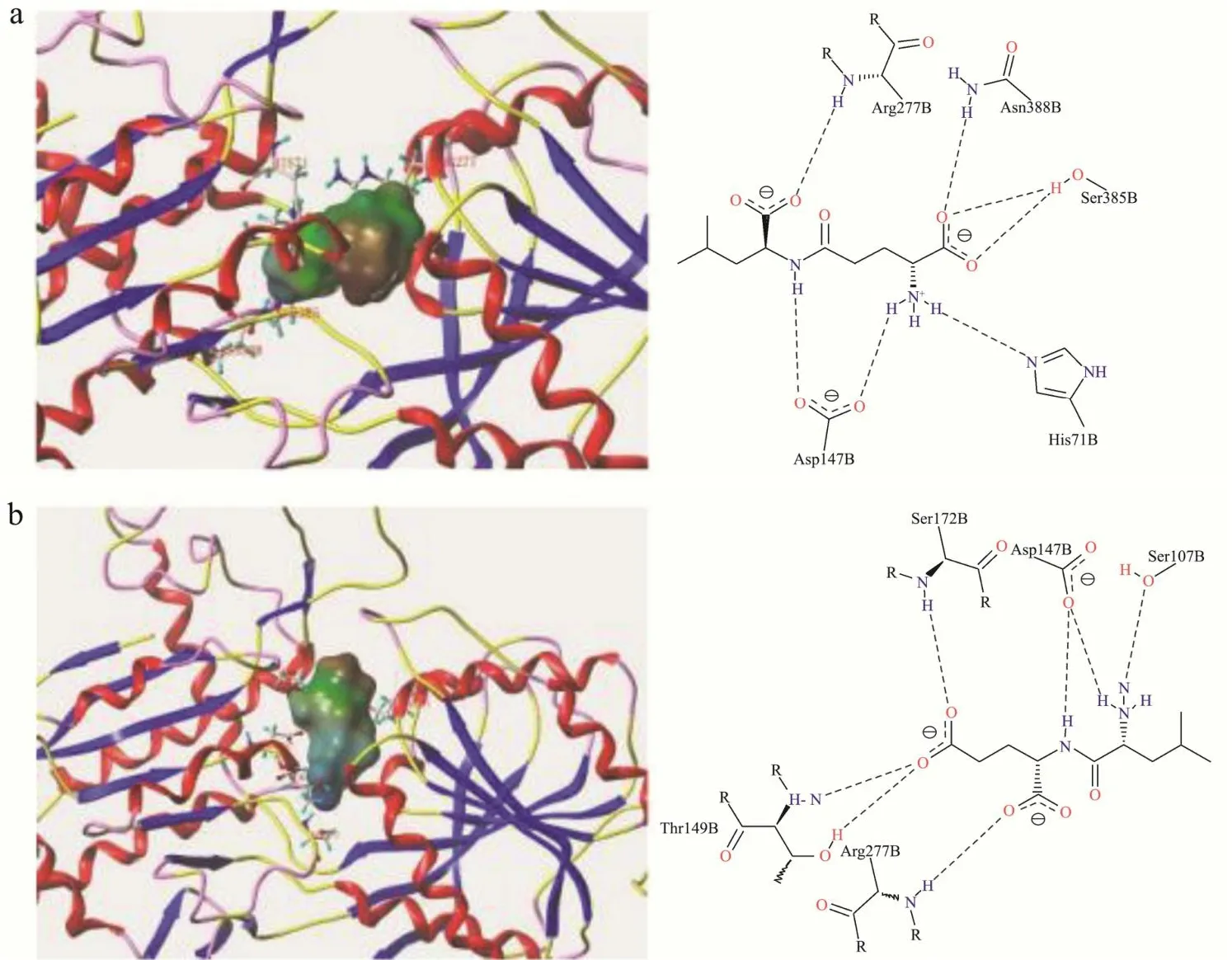
图12 γ-Glu-Leu(a)、Leu-Glu(b)与T1R1受体结合模式图Fig.12 Binding pattern of γ-Glu-Leu (a), Leu-Glu (b) to T1R1 receptor
3 结论
本研究以感官评价为基础,利用同源建模、分子对接技术研究Pro、Glu二肽与鲜味受体T1R1、T1R3和CaSR的构效关系。结果表明:除Pro-Ser、Val-Pro和Leu-Glu不呈鲜,其余二肽的呈鲜阈值均低于谷氨酸钠阈值,γ-Glu-Met、Gly-Glu、Ser-Pro、Ala-Pro、Pro-Ala和Pro-Val等具有较强鲜味。二肽与T1R1的关键结合位点为Asp147、Thr149、Ser172和Arg277,T1R1是Glu二肽呈鲜的重要受体;与T1R3的关键结合位点为Glu45、Ser147、Val277和His278,Ser147是N-γ-Glu二肽与T1R3受体的关键结合位点;与CaSR的关键结合位点为Leu173、Asn176、Gln179、Arg220、Ser244和Asp275,Glu二肽比Pro二肽更易与CaSR受体结合。二肽与受体之间主要通过氢键与疏水相互作用结合,呈味较强的二肽在对接时多嵌于受体结合口袋的深处,或与受体间形成多个氢键及疏水接触;呈味较弱的二肽有的位于结合口袋较浅的位置,有的肽疏水区或亲水区暴露于受体表面,配体与受体结合不稳定或易与溶剂水发生相互作用影响结合稳定性。本研究明晰了Pro、Glu二肽呈鲜的构效关系,有助于阐明二肽与T1R1、T1R3和CaSR鲜味受体分子相互作用机制,为鲜味肽呈鲜机理的研究提供了理论依据。

