欧洲葡萄VvCAX 基因家族的鉴定与表达分析
崔小月,尚泓泉,吕中伟,娄玉穗,张 柯
(河南省农业科学院 园艺研究所,河南 郑州 450002)
钙一般以Ca2+的形式存在,是植物生长发育过程中一种必需的营养元素。一方面,作为构成植物细胞壁和细胞膜结构的必需物质,Ca2+具有稳定细胞壁、细胞膜和膜结合蛋白的功能[1];另一方面,Ca2+又可作为一种信号分子响应激素和多种逆境胁迫[2-3]。Ca2+浓度过高或过低均会影响植物的正常生长,过高的Ca2+浓度引起Ca2+中毒和代谢紊乱,过低的Ca2+浓度则会阻碍植物生长,且极易引发因缺素而产生的并发症,严重影响作物产量和品质[4]。因此,细胞质Ca2+浓度的稳定对于维持细胞功能十分重要,而Ca2+的稳定主要依赖于Ca2+通道、Ca2+-ATPase 和Ca2+/H+反向转运蛋白(CAX)等组成的Ca2+转运系统[5-6]。其中,CAX 与CCX(Cation/Ca2+exchanger)、NCX 和NCKX(依 赖K+的Na+/Ca2+exchanger)、YRBG(原 核 生 物 特 有 的Na+/Ca2+exchanger)共同组成CaCA(Ca2+/Cation antiporter)超家族[5,7]。CAX 是一个多基因家族,主要定位在液泡或液泡膜上[8-10],拟南芥中有6个AtCAX基因[11],苹果8个[4],水稻6个[12],均分为ⅠA和ⅠB 2个亚家族[13]。
研究表明,除了反向转运Ca2+,CAX还可以转运其他金属离子。如拟南芥AtCAX1基因可以转运Cd2+[14],AtCAX2基因可以转运包括Cd2+、Zn2+、Ca2+和Mn2+在内的多种二价阳离子[15],AtCAX4基因可以转运Mn2+、Na+和Ni2+[16],水稻OsCAX1和OsCAX3基因可以转运Mn2+[17]等。除具有离子转运功能外,CAX 还能参与响应多种生物和非生物胁迫。目前,对植物CAX 基因在抵抗非生物胁迫中功能的研究主要集中在耐寒、耐旱、耐盐和耐渗透胁迫方面。例如,AtCAX1的表达受低温诱导,受干旱抑制,cax1拟南芥突变体通过诱导CBF/DREB1的表达提高了植物的抗寒性[18]。苹果MdCAX基因对不同的盐离子胁迫有不同的响应[4]。脱落酸(ABA)、水杨酸(SA)和PEG 胁迫诱导甘蔗ScCAX1基因的表达,茉莉酸甲酯(MeJA)和NaCl 处理下ScCAX1基因的表达量也会发生变化,推测ScCAX1的表达可能与甘蔗的耐盐和渗透胁迫有关[19]。一些学者认为CAX 基因正向调控植物耐盐性。在拟南芥中过表达莱茵衣藻(Chlamydomonas reinhardtii)CrCAX1和 大 豆GmCAX1均提高了转基因拟南芥对盐胁迫的耐受性[20-21]。共表达AtCAX1和AtCAX3基因能够提高酵母细胞在盐胁迫下的生长速率,突变AtCAX1和AtCAX3基因的拟南芥双突变体表现出对盐胁迫更敏感[22]。然而,另一些学者持有不同的观点,认为CAX 基因负向调控植物的耐盐性。例如,过表达OsCAX4基因的酵母细胞对盐胁迫的耐受性降低[23]。过表达碱蓬(Suaeda salsa)SsCAX1的转基因拟南芥液泡膜透性、K+含量和V-H+-ATPase 水解酶活性都发生显著变化,导致转基因植株表现出比野生型更敏感的盐胁迫耐受性[24]。芜菁(Brassica rapa)BraA.cax1突变体能够改善盐胁迫下植物的光合性能[25]。此外,过表达AtCAX4基因可以在不影响植物生长的情况下,适当提高转基因番茄的Ca2+含量,延长其货架期[26]。
目前,关于植物中CAX 基因家族的研究主要包括拟南芥、水稻、苹果和甘蓝型油菜等[4,7,27],在葡萄中尚未见相关报道。葡萄基因组的公布[28-29]使得对葡萄CAX 基因家族的鉴定和分析成为可能。本研究通过生物信息学分析方法鉴定欧洲葡萄CAX 基因家族的成员,进行包括理化性质、二级结构、三级结构、跨膜结构域、基因结构、保守基序、系统进化树等分析,并预测了VvCAX基因的上游转录因子和启动子中存在的顺式作用元件。通过分析VvCAX基因在葡萄不同组织中和多种胁迫下的表达水平预测VvCAX基因的生物学功能,以期为进一步验证VvCAX基因的功能奠定理论基础。
1 材料和方法
1.1 欧洲葡萄CAX基因家族成员鉴定
欧洲葡萄全基因组序列、蛋白序列和注释文件从Ensemble Plants(http://plants.ensembl.org/index.html)下载,CAX基因家族成员的鉴定基于隐马尔可夫模型,通过搜索关键词的方法在Pfam 网站(https://pfam-legacy.xfam.org/)得到CAX家族的保守结构域模型(PF01699)并下载其hmm 文件,E 值设置为<e-6,通过软件TBtools获得潜在的VvCAX序列。经CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和SMART(http://smart.embl-heidelberg.de/)进行保守结构域分析,得到含有CAX 蛋白保守结构域的序列。将获得的序列与拟南芥的6个CAX序列进行比对和进化树分析,采用邻接法(Neighbor-joining algorithm)、泊 松 模 型(Poisson model)、成对删除(Pairwise deletion)、Bootstrap 重复1 000次,最终获得VvCAX的全部成员。
1.2 欧洲葡萄CAX基因家族生物信息学分析
根据葡萄基因组序列,利用TBtools获得葡萄各条染色体的长度,VvCAX家族基因的染色体定位通过MapGene2Chromosome v2(http://mg2c.iask.in/mg2c_v2.0/)呈现,并根据各基因在染色体上的位置依次对其进行命名。利用ExPASy(https://web.expasy.org/protparam/)分析葡萄CAX 蛋白的氨基酸数目、分子质量、等电点、脂溶指数、总平均疏水指数,TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)用于分析跨膜结构域数目。VvCAX基因家族成员的二级结构、三级结构、亚细胞定位、基因结构和保守基序分别通过SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org/interactive)、WoLF PSORT(https://wolfpsort.hgc.jp/)、GSDS 2.0(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)和MEME(http://meme-suite.org/tools/meme)进行分析。
1.3 多序列比对和系统发育分析
通过ClustalX 2 对5 个VvCAX 的氨基酸序列进行比对分析。为了了解CAX 基因家族的进化关系,通过MEGA 6软件,用邻接法对已鉴定的欧洲葡萄、拟南芥、甘蓝型油菜、水稻和苹果的CAX 家族蛋白质进行系统进化树构建,Bootstrap 值设置为1 000。通过在线软件EvolView(https://www.evolgenius.info//evolview/#login)将结果进行可视化。
1.4 共线性和进化选择压力分析
根据葡萄基因组序列、蛋白组序列和注释文件,利用TBtools 比对葡萄蛋白组获得CAX 基因在葡萄基因组中的重复序列,通过TBtools 的Advanced Circos功能将共线性结果进行可视化。此外,使用TBtools 的Simple Ka/Ks Calculator 功能计算进化速率,包括非同义突变率(Ka)、同义突变率(Ks)及其比值Ka/Ks。
1.5 启动子顺式作用元件预测
为了进一步探索VvCAX家族的功能,分析了家族各基因启动子的顺式作用元件。将家族每个基因起始密码子上游2 000 bp 的序列提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)用于启动子分析,通过GSDS 2.0 将结果进行可视化。
1.6 VvCAX的互作蛋白分析
根据VvCAX 的氨基酸序列,在网站STRING(https://string-db.org/cgi/input.pl? UserId=1vwOzleiKhas&sessionId=5lLmnN0J8SUO&input_page_active_form=single_sequence)预 测 其 互 作 蛋 白 ,利 用PlantRegMap 数据库(http://plantregmap.gao-lab.org/network.php)鉴 定VvCAX1、VvCAX2、VvCAX3、VvCAX4和VvCAX5基因上游可能存在的转录因子,利用软件Cytoscape将结果进行可视化。
1.7 VvCAX基因的表达模式分析
供试材料红地球葡萄保存于河南现代农业研究开发基地葡萄示范园,采集成熟叶、幼叶、卷须、花、果、茎用于组织特异性分析。ABA 处理下VvCAX基因在赤霞珠葡萄不同组织的表达变化分析基于微阵列数据(GSE78798)进行,机械损伤、紫外线照射和霜霉菌侵染时黑比诺葡萄VvCAX基因的表达变化基于微阵列数据(GSE37743)进行。长势一致且生长健壮的红地球葡萄叶片用于非生物胁迫处理,将采回的叶片叶柄用湿棉花包裹,置于放有湿滤纸的托盘上,分别对叶片进行4、40 ℃和10%PEG 6000 处理,并分别于处理的0、2、4、8、12、24 h取样,每个处理设置3次生物学重复。
将样品在液氮中研磨,使用E.Z.N.A.®植物总RNA 试剂盒(OMEGA,美国)按照说明书提取RNA。利用诺莱酶公司的反转录试剂盒合成cDNA 的第一条链,稀释到质量浓度为100 ng/μL 后用作实时荧光定量PCR(qRT-PCR)的模板。使用Primer3(https://primer3.ut.ee/)设计基因的特异性qRT-PCR引物,内参基因为VvActin7(Accession no.XM_002282480),各引物序列如表1 所示。qRT-PCR 的反应体系和程序参照丁兰等[30]的方法,每个处理设置3 个重复,基因相对表达量采用2-ΔΔCT法分析,误差线代表3 次生物学重复的标准误差(SE)。使用SPSS 23.0 采用图基检验进行单因素方差分析(P<0.05)。
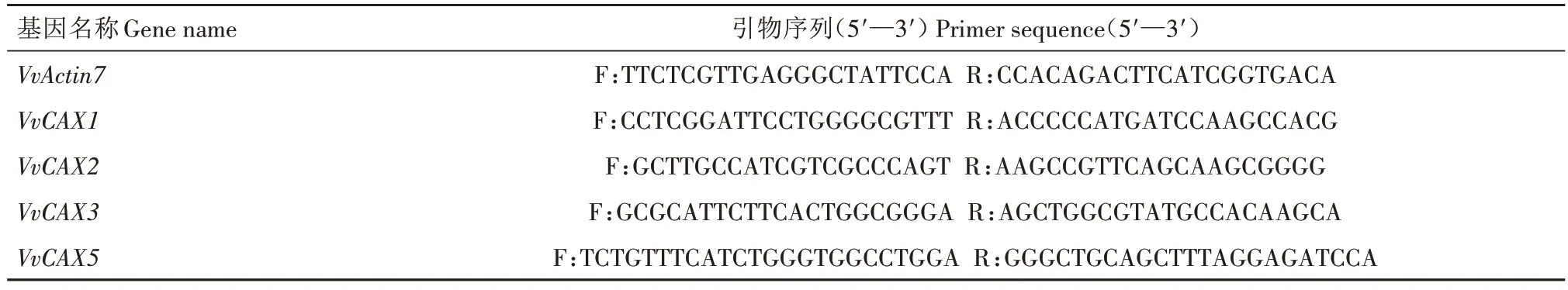
表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequences
2 结果与分析
2.1 VvCAX基因家族的鉴定和特征分析
根据CAX家族的保守结构域模型(PF01699)的hmm 文件,通过软件TBtools 获得26 条潜在的VvCAX 序列,符合E 值<e-6且包含Na_Ca_ex 结构域的序列有22 条。将这22 条序列与拟南芥的6 个CAX 进行系统进化分析发现,22 条序列中有5 个CAX 家族成员(图1A),因此,欧洲葡萄中共存在5个CAX 基因。经染色体定位分析发现,5 个CAX基因分布在葡萄的5 条染色体上,每条染色体上分布1 个VvCAX基因(图1B),根据它们在染色体上的位置,依次命名为VvCAX1—VvCAX5。理化性质分析(表2)显示,VvCAX家族基因编码区长度为1 341~1 566 bp,编码446~521 个氨基酸,等电点为5.38~7.25,其中,VvCAX3 为碱性蛋白,其余4 个为酸性蛋白。5 个VvCAX 蛋白均为较为稳定(脂溶指数<90)的疏水性(总平均疏水指数<0)蛋白质,且含有10~11 个跨膜结构域。VvCAX 蛋白的二级结构主要为α-螺旋和无规则卷曲,占比超过80%,主要定位在质膜和液泡上(表3)。对VvCAX 进行三级结构分析发现,所有VvCAX蛋白的三级结构非常相似且均为单体(图1C)。
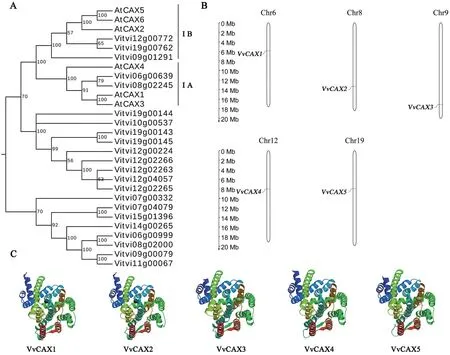
图1 VvCAX家族聚类(A)、染色体分布(B)及三级结构(C)分析Fig.1 Cluster(A),chromosome distribution(B)and tertiary structure(C)analysis of VvCAX family
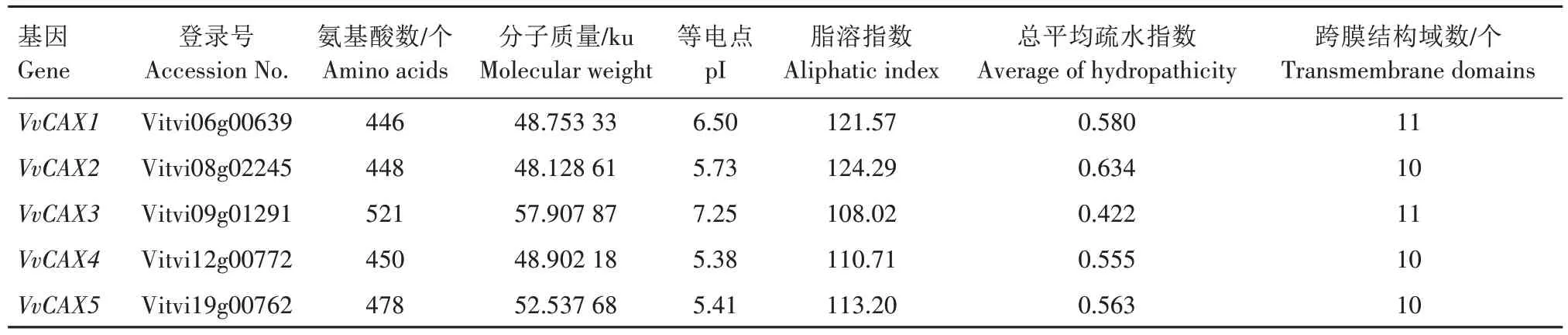
表2 VvCAX基因家族的理化性质Tab.2 Physiochemical properties of VvCAX gene family

表3 VvCAX家族成员的二级结构和亚细胞定位Tab.3 Secondary structure and subcellular localization prediction of VvCAX proteins
2.2 VvCAX家族的氨基酸序列比对和系统发育分析
经分析发现,VvCAX 有10~11 个跨膜结构域(TM)和4 个典型的功能域,分别是N 端自抑制区域(NRR)、Ca2+功能域(CaD)、C 功能域和D 功能域,且在TM3 与TM4、TM8 与TM9 之间包含与转运特异性离子有关的保守氨基酸重复序列c-1 和c-2(图2)。对欧洲葡萄VvCAX1—VvCAX5、拟南芥AtCAX1—AtCAX6、甘蓝型油菜BnaCAX1-1—BnaCAX5-3、苹果MdCAX1—MdCAX8 和水稻OsCAX1—OsCAX4共42 个CAX 家族蛋白进行系统进化树分析发现,VvCAX 蛋白可分为2 个亚家族,分别为亚家族ⅠA和ⅠB。其中,亚家族ⅠA包含2个成员,即VvCAX1和VvCAX2,亚家族ⅠB包含3个成员,即VvCAX3—VvCAX5(图3)。

图2 欧洲葡萄CAX蛋白的氨基酸序列比对分析Fig.2 Amino acid sequence alignment analysis of VvCAX proteins
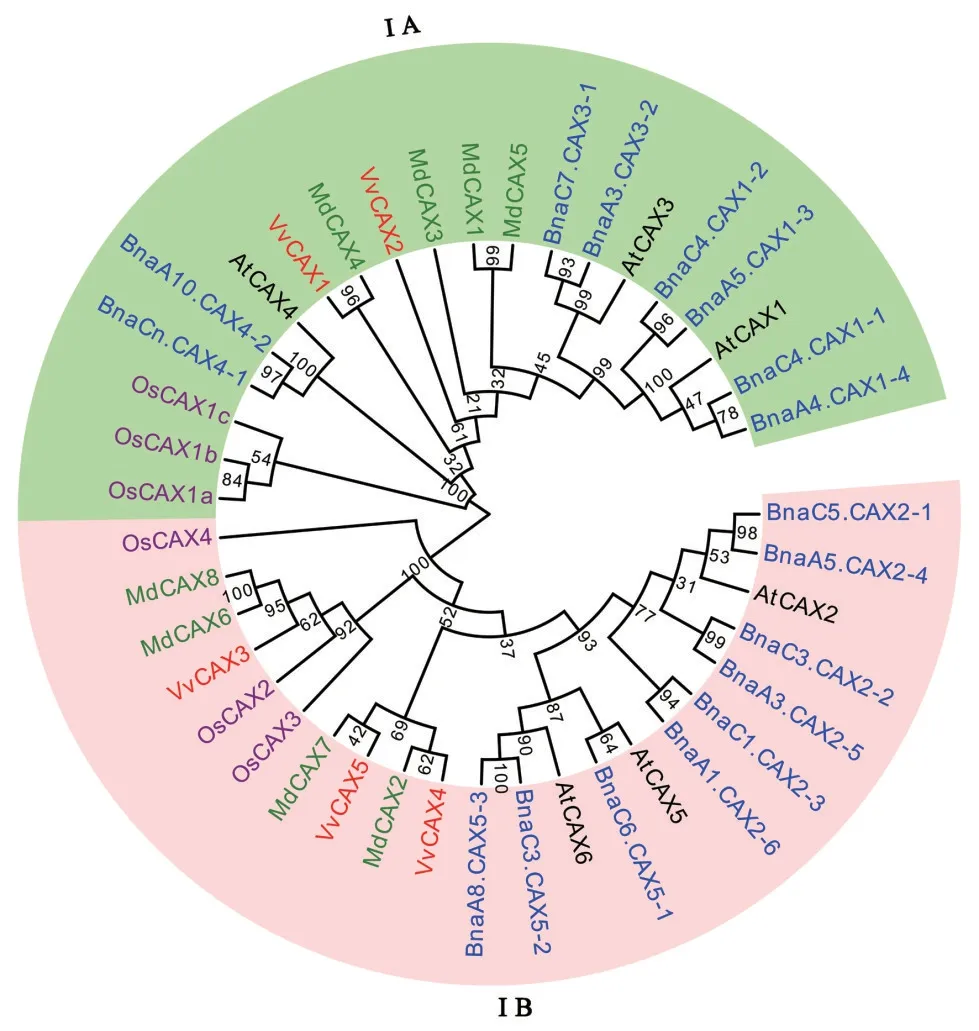
图3 欧洲葡萄、拟南芥、甘蓝型油菜、苹果和水稻CAX蛋白的系统发育分析Fig.3 Phylogenetic tree analysis of CAX proteins in Vitis vinifera,Arabidopsis thaliana,Brassica napus,Malus domestica and Oryza sativa
2.3 VvCAX家族保守基序和基因结构分析
利用在线工具MEME 通过氨基酸序列预测VvCAX 家族的保守基序,保守基序个数设置为10,其他参数设置为默认。由图4A 可知,所有VvCAX家 族 成 员 均 含 有motif1、motif2、motif3、motif4、motif5、motif6、motif7 和motif9。此外,亚家族ⅠA 还包含motif10,亚家族ⅠB还包含motif8。经PFAM 检测,motif1—motif6 均包含Na_Ca_ex 保守结构域,除此之外,motif2 中还含有一个功能未知的DUF3935结构域,motif4 中还含有一个抗溴氰菊酯的结构域和一个未知的DUF423结构域,motif6中还含有一个糖基水解酶结构域。通过对VvCAX基因家族进行基因结构分析发现,所有VvCAX基因都含有9~11个内含子(图4B)。
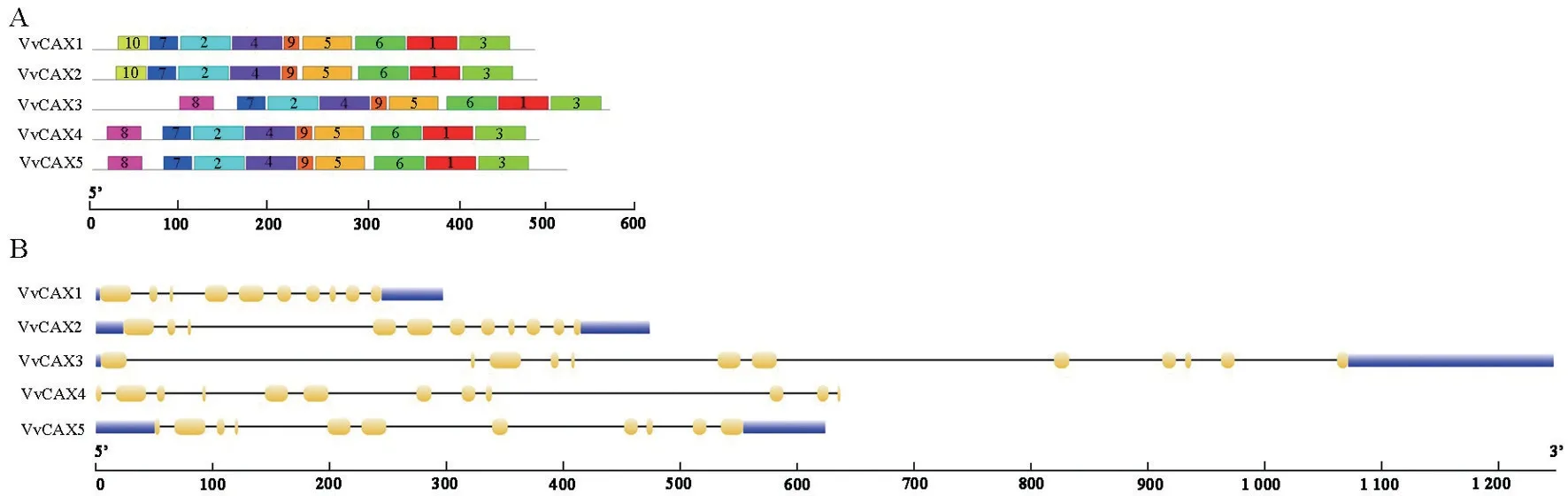
图4 VvCAX家族的保守基序(A)和基因结构(B)Fig.4 The conserved motifs of VvCAX proteins(A)and the exon-intron structure of VvCAX genes(B)
2.4 VvCAX基因复制事件分析
结合VvCAX基因在染色体的位置,共发现了7对VvCAX基因位于欧洲葡萄基因组的重复位置,即欧洲葡萄共经历了7 次与CAX 家族有关的基因复制事件,且7 次均为片段重复事件(图5)。通过进化选择压力分析发现,6 对片段复制的VvCAX基因的Ka/Ks 值小于1(表4),为纯化选择作用。VvCAX2与VvCAX5的序列分歧度太大,进化距离很远,表明这2 个基因在进化过程中发生了较大程度的非同义突变。
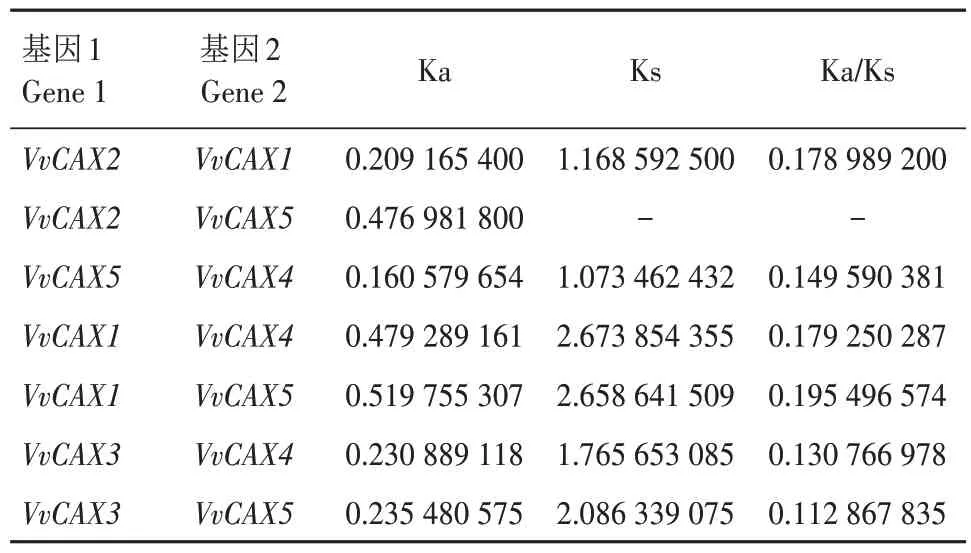
表4 发生基因复制的VvCAX成员的进化选择压力分析Tab.4 Analysis of evolutionary selection pressure of VvCAX members with gene replication
2.5 VvCAX的互作蛋白分析
根据VvCAX 的氨基酸序列预测得到的候选互作蛋白如图6 所示,多数与离子转运和钙相关。其中 SLC6、CaCA、TPC1、PEI12、Ion_trans、ATPsynt_ab 和nramp6 分别和至少2 个VvCAX 蛋白互作。SLC6和CaCA 均属于钙离子转运蛋白,TPC1是一个钙离子通道蛋白,PEI12 编码一个果胶酯酶抑制剂,Ion_trans、ATP-synt_ab 和nramp6 均参与离子转运。VvCAX3 和VvCAX5 的互作蛋白大都相同,VvCAX4 与其他VvCAX 蛋白的互作蛋白完全不同。由 图7 可 知,VvCAX1、VvCAX2、VvCAX3、VvCAX4、VvCAX5基因的上游分别存在17、14、12、3、14 个转录因子,这些转录因子包括MYB、ERF、C2H2、MADS、AP2等。
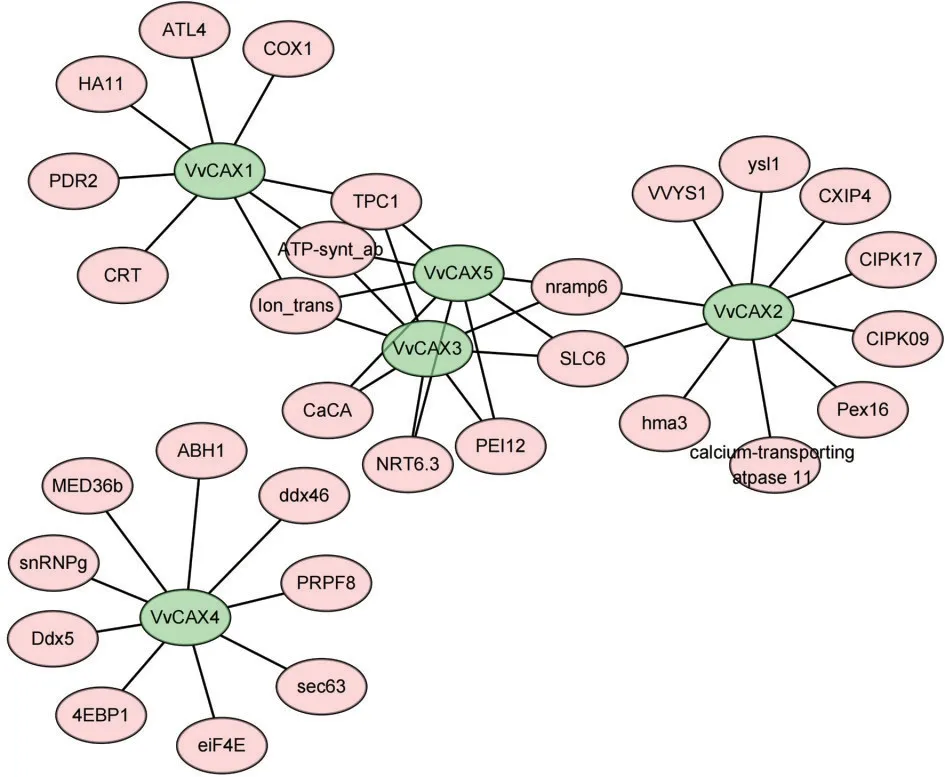
图6 VvCAX蛋白与其候选互作蛋白之间的网络关系Fig.6 The network relationships between VvCAX proteins and their candidate interacting proteins
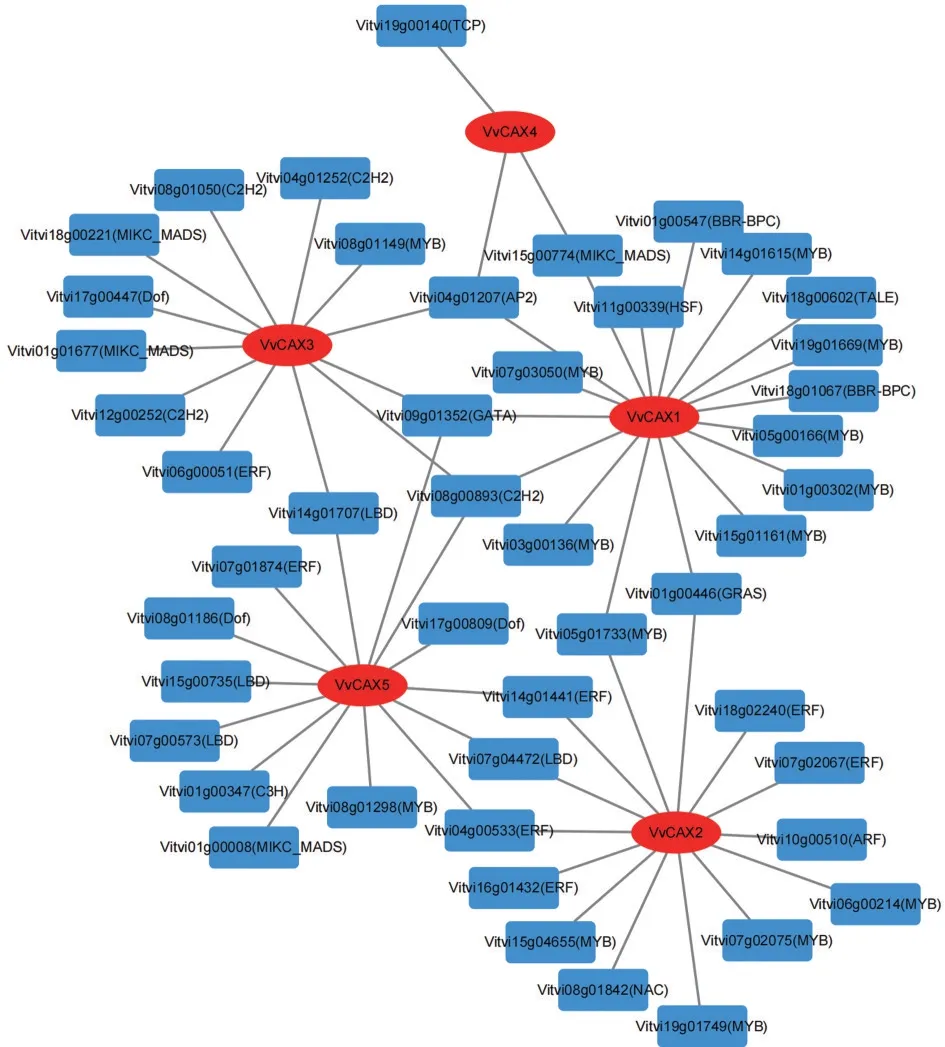
图7 VvCAX基因的上游调控因子Fig.7 Upstream regulatory factors of VvCAX genes
2.6 VvCAX基因启动子顺式作用元件分析
经分析发现,除了CAAT、TATA 和光响应元件外,VvCAX基因家族启动子中出现频率最高的作用元件是Dof(90个),其次是激素(赤霉素、乙烯、水杨酸、茉莉酸甲酯、脱落酸和生长素)响应元件(40个),MYB 和MYC 结合元件紧随其后(图8),表明VvCAX基因可能参与调控激素响应。VvCAX1和VvCAX2的启动子具有最丰富的MYB 结合元件;VvCAX4和VvCAX5的启动子具有最丰富的赤霉素响应元件;VvCAX5的启动子具有最丰富的乙烯响应元件;VvCAX4的启动子具有最丰富的水杨酸响应元件;仅VvCAX2和VvCAX5的启动子具有茉莉酸甲酯响应元件;仅VvCAX2和VvCAX4的启动子具有脱落酸响应元件;仅VvCAX5的启动子具有生长素响应元件。此外,一些VvCAX基因的启动子中还含有响应机械损伤、低温、防御和胁迫反应的顺式作用元件(图8)。
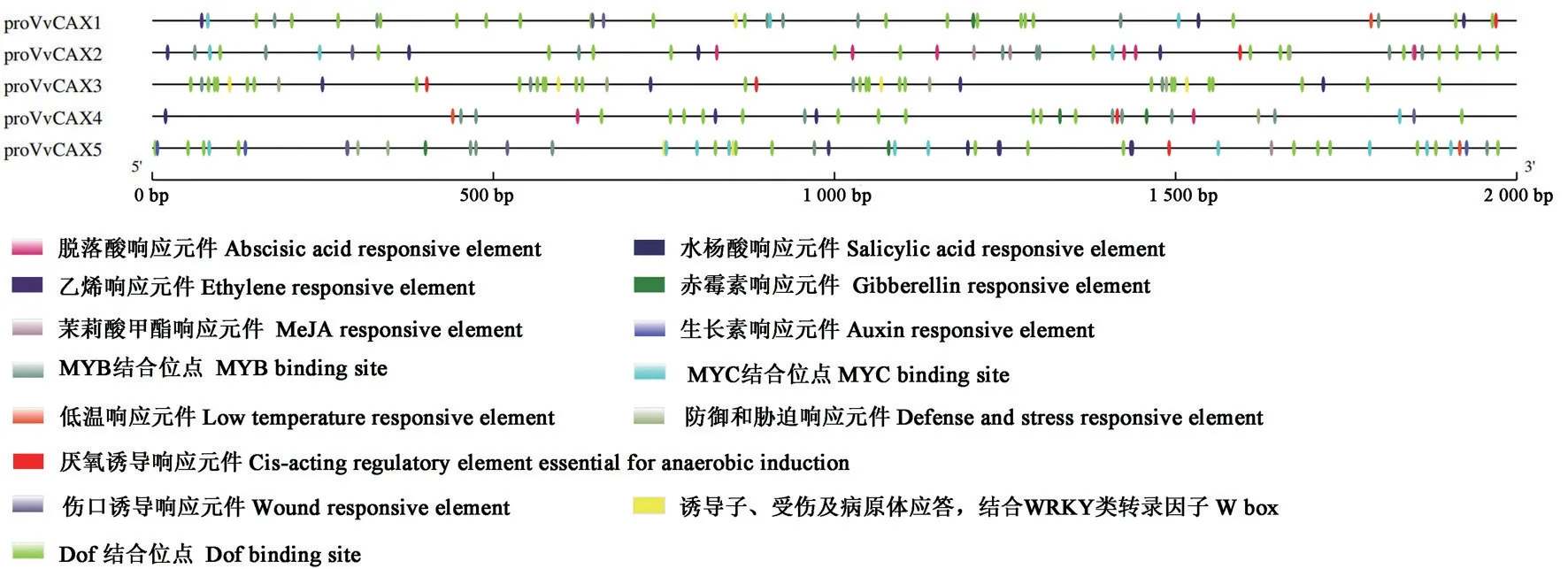
图8 VvCAX基因家族启动子顺式作用元件分析Fig.8 Analysis of cis-acting elements of VvCAX gene promoters
2.7 VvCAX基因的表达模式分析
分析了4个VvCAX基因在欧洲葡萄品种红地球不同组织中的相对表达量发现,ⅠA 亚家族的VvCAX1和VvCAX2基因在花中的表达量最高;ⅠB亚家族的VvCAX3和VvCAX5基因主要在葡萄成熟叶和卷须中表达(图9)。对赤霞珠葡萄的浆果、枝条、叶片、根和悬浮细胞进行10 μmol/L ABA 处理2 h 后发现,与对照(含有0.05%免疫佐剂和0.002%乙醇的蒸馏水处理)相比,ABA 能够提高VvCAX1和VvCAX2基因在叶片中的表达量,降低VvCAX3、VvCAX4和VvCAX5基因在叶片中的表达量(图10A)。对黑比诺葡萄进行创伤和霜霉菌侵染发现,创伤和霜霉菌处理后,VvCAX1表达水平降低,VvCAX2基因表达水平升高,ⅠB 亚家族的VvCAX基因变化不明显;紫外线处理后,ⅠA 亚家族的VvCAX基因表达下调,ⅠB 亚家族的VvCAX基因表达上调(图10B)。对红地球葡萄叶片进行4 ℃低温处理发现,短时间(2 h)的低温抑制VvCAX基因的转录,所有VvCAX基因的转录水平均呈现出“下降—升高—下降”的趋势,其中VvCAX1基因对低温胁迫最敏感,在处理8 h 时转录水平达到最大值,约为处理前的3 倍(图11A)。4 个VvCAX基因对高温(40 ℃)均有响应,其中VvCAX1和VvCAX5响应最为明显(图11B)。ⅠA 亚家族的VvCAX基因比ⅠB 亚家族的VvCAX3和VvCAX5基因对PEG 6000 模拟的干旱胁迫更敏感(图11C)。以上结果表明,位于同一亚家族的VvCAX基因具有相似的表达模式,可能具有相似的生物学功能,所有VvCAX基因均响应ABA,ⅠA亚家族的VvCAX基因可能与创伤、霜霉菌、干旱和低温相关,ⅠB 亚家族的VvCAX基因则可能与高温有关。
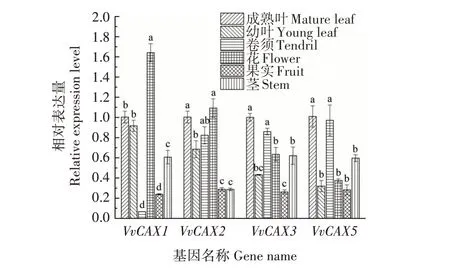
图9 红地球葡萄不同组织中VvCAX基因的表达水平Fig.9 Expression levels of VvCAX genes in different tissues of Red Globe grape
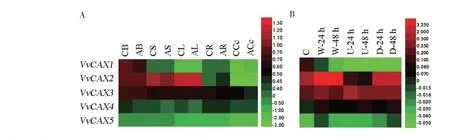
图10 不同处理后VvCAX基因的表达模式热图Fig.10 The expression pattern heat map of VvCAX genes under different treatments
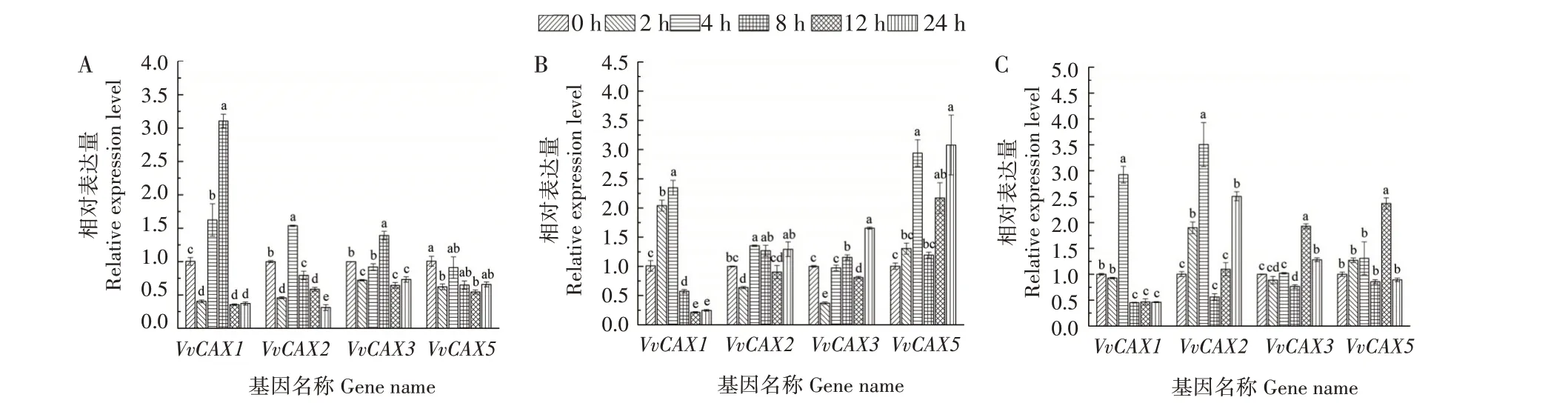
图11 不同处理后VvCAX基因的表达水平Fig.11 The expression levels of VvCAX genes under different treatments
3 结论与讨论
CAX 是一类广泛存在于自然界中的跨膜转运蛋白[5]。目前,CAX 家族基因已在拟南芥[11]、苹果[4]、丹参[31]、甘蓝型油菜[27]、森林草莓[32]、水稻[12]和杨树[33]等物种中被鉴定。但是,迄今为止还未见到关于葡萄CAX 基因家族的系统研究。本研究从欧洲葡萄基因组中鉴定出5 个CAX 基因,与二倍体植物拟南芥、水稻、苹果、森林草莓、丹参和杨树的基因数量相仿,少于四倍体植物甘蓝型油菜基因数量。VvCAX1和VvCAX2属 于ⅠA 亚 家 族,VvCAX3、VvCAX4和VvCAX5属 于ⅠB 亚 家 族,预 示 着 葡 萄CAX基因的功能可能存在分化。
蛋白质的结构与其功能密切相关。本研究发现,VvCAX 蛋白均为疏水蛋白,同一亚家族的成员表现出相似的结构特征,如跨膜结构域和内含子数量、二级结构、三级结构、保守基序等,这种现象也出现在拟南芥[11]、水稻[12]和苹果[4]等物种中,表明CAX 家族在进化过程中具有保守性。亚细胞定位预测结果显示,VvCAX 主要定位在质膜和液泡上,与前人在其他物种上的研究结果相同[20,23,34-35],但还需要进一步进行试验验证。共线性分析结果显示,葡萄基因组内存在7 对同源的VvCAX基因,然而所有同源基因均分布在不同的染色体上,不存在串联复制的情况。其中6 对同源基因的Ka/Ks 值小于1,表明这6对VvCAX基因在葡萄的进化过程中发生了纯化选择作用,基因功能保守。VvCAX2和VvCAX5基因表现出较大的序列分歧度,可能具有不同的生物学功能。
CAX 基因家族在不同的组织中表达丰度不同。AtCAX1、AtCAX2和AtCAX5基因在根、叶、花和种子中特异性表达,AtCAX3基因在根、花和种子中表达,而AtCAX4基因仅在根和叶中特异性表达[7]。本研究发现,ⅠA 亚家族的VvCAX基因在红地球葡萄花中的表达量最高,ⅠB 亚家族的VvCAX3和VvCAX5基因主要在葡萄成熟叶和卷须中表达,暗示了这2个亚家族的VvCAX基因在不同的组织和发育阶段中发挥作用。
转录因子可通过与下游基因启动子中的顺式作用元件结合,在转录水平上调控基因的表达。前人研究发现,MYB、Dof、WRKY、W-box、MBS 和LTR等顺式作用元件在调控植物CAX 基因响应外界胁迫时发挥了重要作用[27,32]。本研究中,VvCAX基因上游可能存在一些转录因子,如MYB、Dof、ERF 等,启动子序列中也包含相应的的顺式作用元件(MYB、Dof、ERE),推测VvCAX基因可能响应激素和胁迫反应。为了证明这一推论,分析了不同条件下VvCAX基因的表达水平,发现VvCAX家族基因在不同处理下表达丰度不同。对赤霞珠葡萄的各组织和器官进行10 μmol/L ABA 处理2 h 后,2 个亚家族VvCAX基因表现出相反的表达趋势。创伤和霜霉菌侵染后VvCAX1基因的表达量均下降,其余4 个VvCAX基因受到创伤和霜霉菌侵染后表达量增加,但ⅠB 亚家族的VvCAX基因表达水平变化不大。VvCAX5基因受紫外线影响不大,VvCAX1和VvCAX2基因受到紫外线的抑制,VvCAX3和VvCAX4基因受到紫外线的诱导。拟南芥AtCAX1与植物的抗寒性密切相关[18,36],与其处于同一分支的VvCAX1基因在红地球受到低温胁迫后表达上调,推测VvCAX1基因可能参与调控植物的低温胁迫耐受性。VvCAX1和VvCAX5基因对高温的响应最为明显,表明这2个基因可能参与调控高温胁迫。ⅠA 亚家族的VvCAX基因比ⅠB 亚家族的VvCAX3和VvCAX5基因对PEG 6000 模拟的干旱胁迫更敏感,表明ⅠA 亚家族的VvCAX基因更有可能与干旱胁迫相关。此外,ⅠA亚家族的AtCAX1、AtCAX3和AtCAX4还具有响应渗透胁迫、磷缺乏和有毒金属的功能,ⅠB 亚家族的AtCAX2和AtCAX5具有响应低温、渗透和有毒金属的功能[7]。以上结果表明,VvCAX基因可能具有响应多种胁迫的功能,但是还需进行进一步的验证。

