足趾小汗腺汗孔癌1例
赵文军, 米新陵, 王坤, 刘冬梅, 黄池清, 许功军
金华市第五医院,浙江 金华 321000
1 临床资料
患者女,67岁,因左足第三趾浸润性斑块3年就诊。3年前患者无明显诱因左足第三趾趾端出现一红斑,无明显痛痒,未予重视。红斑面积渐扩大,且出现破溃,曾间断涂擦多种消炎药物治疗(具体药物不详),未见好转。近来皮损明显加重,趾甲损毁,表面破溃、结痂,反复不愈,走路时疼痛,遂来我院就诊。患者既往体健,个人史及家族史均无特殊。
体格检查:一般情况正常,各系统检查未见明显异常。皮肤科检查:左足第三趾甲床浸润性斑块,呈棕红色,质硬,趾甲损毁,边缘增生隆起,表面结痂,界限不清 (图1)。实验室检查:生化全套、HIV、梅毒相关检查均未见异常。皮损组织病理检查:部分表皮坏死,肿瘤与表皮相连,与正常表皮界限清楚,向真皮内侵袭性生长;瘤体周边细胞未见栅栏状排列,瘤体内见较多坏死;肿瘤细胞呈多形性、泡状,核大、深染,见多核和瘤巨细胞,病理性核分裂象多见,不同程度的导管分化(图2A~2C)。腹股沟淋巴结活检未见肿瘤转移。免疫组化染色示:CK7、EMA、CK5/6阳性,p16弥漫阳性,p40、p63强阳性,Ki-67约60%~90%(+),S-100、HMB-45、Melan-A、SOX-10、CEA、AR、ER染色均阴性(图3A~3F)。腹股沟浅表淋巴结超声检查未见异常。诊断:小汗腺汗孔癌。
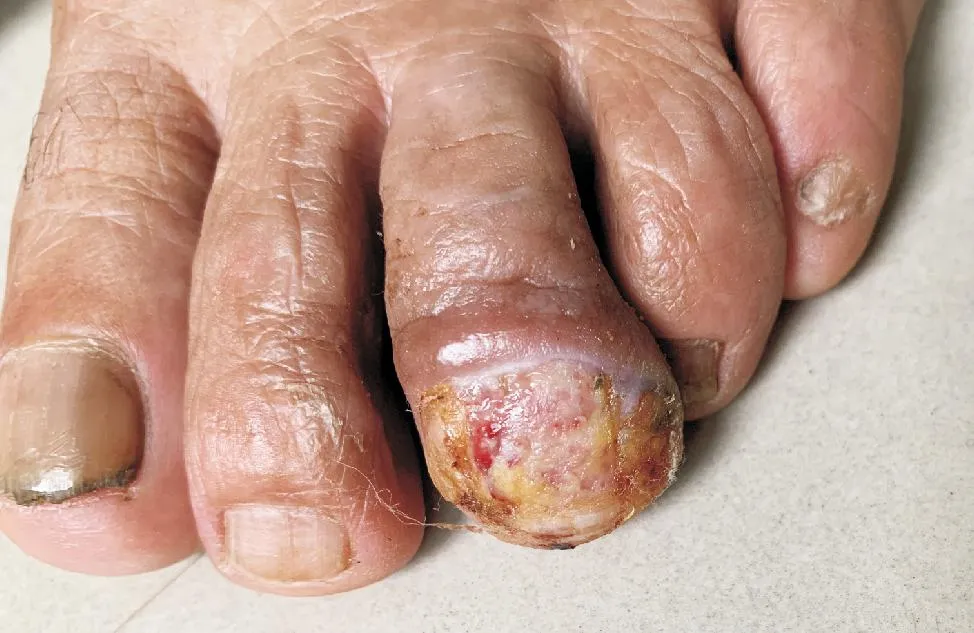
图1 患者临床照片:左足第三趾浸润性斑块

图2 皮损组织病理(HE染色) 2A:部分表皮坏死,肿瘤与表皮相连,与正常表皮界限清楚,向真皮内侵袭性生长(40×);2B:瘤体周边细胞未见栅栏状排列,瘤体内见较多坏死(200×);2C:肿瘤细胞呈多形性、泡状,核大、深染,见多核和瘤巨细胞,病理性核分裂象多见,不同程度的导管分化(400×)

图3 免疫组化染色(100×) 3A:p63强阳性;3B:p16弥漫阳性;3C:CK5/6弥漫阳性;3D:p40强阳性;3E:Ki-67约60%~90%(+);3F:EMA阳性
予Mohs显微外科手术扩大切除,术后愈合良好,目前仍在随访中。
2 讨论
小汗腺汗孔癌又称外泌汗腺汗孔癌(eccrine porocarcinoma, EPC),1963年由Pinkus 和Mehregan首次描述[1],是一种罕见的起源于小汗腺表皮内导管部分的恶性皮肤附属器肿瘤。EPC的病因尚不清楚,可从先前存在的较长时间的肿瘤(汗孔瘤、皮脂腺痣或Bowen病等)基础上发展而来,或一开始即为恶性。既往文献报道该病可能与创伤、免疫抑制、器官移植、长期暴露于紫外线和艾滋病等因素相关[2]。Salih等[3]对453例EPC的荟萃研究中发现,男性和女性发病率大致相同,平均发病年龄为67.57岁(6个月~97岁);病程平均持续时间为5.57年;最常见的发病部位是头部和颈部(占39.9%),其次是下肢(占33.9%)。临床可表现为质硬的结节、斑块、溃疡或息肉等,病变直径0.5~10 cm。EPC的局部和区域复发率约为20%[4]。远处转移率为12%,更重要的是,转移性EPC的死亡率在75%~80%之间[5]。皮损若出现自发出血、溃疡、瘙痒、疼痛和突然快速生长等现象与恶性转化有关[6]。
EPC临床缺乏特异性,容易误诊,确诊主要依据组织病理检查及免疫组化。EPC组织病理学表现多样,共同特征包括核异型性、有丝分裂增加和坏死;多角形肿瘤细胞聚集形成多个表皮内大小不一的巢,有规则的鳞状细胞或角化不良细胞;表皮棘层肥厚和角化过度。根据边缘的浸润模式,EPC 被分为3个亚型:①浸润型:下缘边界不清,恶性肿瘤细胞簇集浸入真皮;②推挤型:在息肉样肿瘤周围有明显的真皮衬里[7];③pagetoid 型:肿瘤细胞模拟Paget病表皮内扩散。EPC有多种组织学分化模式,如鳞状细胞分化、透明细胞分化、梭形细胞分化和黑素细胞定植等[8]。文献报道,最新的免疫组化标志物是YAP1和NUT:YAP1 c端部分的细胞质表达缺失和/或NUT的异常核表达均提示存在潜在的基因融合,对诊断本病特异性和敏感性高[9]。Ki-67较高的标记指数和p53、RB和p16的阳性表达在汗孔癌中更常见;其他染色包括CEA、EMA、c-KIT和管腔细胞角蛋白,在汗孔瘤和汗孔癌中显示导管分化具有不同程度的敏感性。AE1/AE3和细胞角蛋白1、5、8、10和14在汗孔细胞和表皮细胞中呈不同程度的表达,但缺乏特异性。GATA3、SOX10和GCDFP-15通常为阴性[10]。EPC的皮肤镜特征包括:①多形性血管(发夹样、不规则线样及点状血管);②圆形至卵圆形的白色/粉色无结构区;③无结构区周围白色至粉色晕[11]。但皮肤镜检查无法与汗孔瘤鉴别,需进一步做组织病理学确诊。
本病临床表现无特异性,需与多种疾病相鉴别。Le等[8]荟萃研究中提出的鉴别诊断包括(色素性)鳞状细胞癌、(无色素)黑色素瘤、基底细胞癌、脂溢性角化病、皮肤恶性肿瘤、刺激性痣、慢性湿疹、深部真菌感染、化脓性肉芽肿、寻常疣、血管瘤和脂肪瘤等。本例患者皮损发生在足趾,表现为浸润性斑块,主要与鳞状细胞癌鉴别。鳞状细胞团块向下增生进入真皮,瘤巢中无管状及囊样结构,并有角化倾向,故瘤体内可见个别角化或角化不良细胞、角珠[12]。
EPC是一种罕见的侵袭性皮肤肿瘤,具有多种临床和组织病理学特征,误诊率高,应尽早诊断和治疗,避免发生转移。本病目前尚无标准化的治疗方案,既往报道的主要治疗方法是Mohs显微外科手术切除。前哨淋巴结活检存在争议,如果患者具有高危特征,包括淋巴血管侵犯、高增殖指数(10个高倍视野中>14个有丝分裂)、肿瘤深度增加(>7 mm)、低分化肿瘤和原发肿瘤的位置(与其他原发部位相比,头部/颈部区域的淋巴结转移比例似乎相对较小),则应考虑进行淋巴结活检[13]。已经转移的肿瘤,无法手术切除或患者拒绝手术治疗时,辅助治疗是另一种选择,包括化疗(5-氟尿嘧啶、顺铂、阿霉素、多西他赛、长春新碱、环磷酰胺、卡铂联合表柔比星、紫杉醇、博来霉素和丝裂霉素)、放疗、放化疗以及偶尔使用干扰素或光疗,在既往报告的病例中通常未显示良好的疗效,只有少数病例获益[14]。Ma等[15]报告1例拇指原发性小汗腺汗孔癌伴转移,患者予截肢治疗,1年后死亡。本例患者表现为足趾斑块,病程短,发现早,经病理及免疫组化染色确诊为EPC,腹股沟淋巴结活检未见肿瘤转移,采用Mohs显微外科手术切除,术后恢复良好,目前仍在随访中。

