鼻咽癌组织中GPX4和SLC7A11的表达及临床意义
王春艳,赵兴泉,徐 鑫
四川绵阳四0四医院/绵阳市第一人民医院耳鼻咽喉科,四川绵阳 621000
鼻咽癌(NPC)是头颈部常见恶性肿瘤,全世界每年新发12.8万例,死亡5万例[1]。对于早期NPC患者可通过放疗联合化疗提高生存率,但对于晚期患者,已错失最佳治疗机会,5年生存率仅50%[2]。谷胱甘肽过氧化物酶4(GPX4)具有催化过氧化物、脂质氢过氧化物还原的功能,保护细胞免受氧化及脂质过氧化损伤,与精子及骨骼正常发育过程有关[3]。既往研究发现,GPX4在前列腺癌、乳腺癌等恶性肿瘤组织中表达水平升高,其通过清除肿瘤细胞内活性氧,避免脂质过氧化,抑制肿瘤细胞铁死亡的发生[4]。溶质载体家族7成员11(SLC7A11)是一种多通道跨膜蛋白,能够不依赖钠离子逆向转运氨基酸,调节细胞外胱氨酸的摄取[5]。有研究发现,SLC7A11在胶质瘤中表达水平升高,其通过促进肿瘤细胞胱氨酸摄取,抑制肿瘤细胞铁死亡,促进肿瘤的发生发展及耐药性形成[6]。目前NPC中GPX4、SLC7A11的表达情况及临床意义尚不清楚。本研究检测NPC中GPX4、SLC7A11的表达,探讨两者的临床意义。
1 资料与方法
1.1一般资料 将2016年3月至2017年3月于本院诊治的98例NPC患者纳入研究作为NPC组。其中男61例、女37例,年龄34~77岁,平均(63.4±6.1)岁,有吸烟史者40例,病理类型包括角化性鳞状细胞癌20例、非角化性(分化型)28例、非角化性(未分化型)50例,临床分期包括Ⅰ~Ⅱ期32例、Ⅲ~Ⅳ期66例,高分化程度30例、中分化程度33例、低分化程度36例,合并淋巴结转移43例。纳入标准:(1)经病理活检明确为NPC;(2)初发且首次诊治,既往无抗肿瘤治疗史;(3)临床资料完整。排除标准:(1)合并其他器官的恶性肿瘤或鼻咽部其他类型肿瘤;(2)合并精神障碍性疾病;(3)合并严重的肝、肾衰竭。另选取同期于本院治疗的60例因鼻中隔偏曲接受手术治疗的患者作为对照组。对照组和NPC组性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。本研究经本院伦理委员会审核批准通过。纳入研究者或直系亲属家属能够配合本研究,对本研究知情同意并签署知情同意书。
1.2方法
1.2.1免疫组化检测GPX4、SLC7A11表达 取NPC组织和对照组正常组织,采用常规的甲醛溶液固定及石蜡包埋,切片机切片,制作成石蜡切片后进行免疫组化染色。兔抗两步法免疫组化试剂盒购自北京中杉金桥公司,货号PV-6000。简要步骤:二甲苯脱蜡后梯度乙醇水化,采用柠檬酸钠溶液进行抗原热修复,过氧化氢阻断内源性过氧化物酶,3%羊血清封闭,一抗4 ℃孵育过夜,一抗GPX4、SLC7A11稀释比均为1∶1 000,一抗均购自美国Abcam公司,货号分别为ab125066、ab37185。镜下观察免疫组化染色情况,然后进行染色强度评分:未染色为0分,浅黄色1分,棕褐色颗粒2分。染色面积评分:阳性面积<25%为1分,阳性面积介于25%~50%为2分,阳性面积>50%为3分。通过计算染色强度和染色面积评分的乘积得到免疫组化染色评分[7],评分≥2分判定为染色阳性,<2分判定为阴性。
1.2.2治疗、疗效评价及随访 所有患者均接受调强放射治疗,原发灶放疗总剂量66~72 Gy,转移淋巴结区64~70 Gy,每日1次,每周5次,共30次或31次。Ⅲ~Ⅳ期患者同时接受顺铂为基础的诱导+同步化疗或辅助化疗。诱导或辅助化疗方案为多西他赛70 mg·m-2/d(第1天)+顺铂25 mg·m-2·/d (第1~3天)+5氟尿嘧啶500 mg·m-2/d(第1~4天)。同步化疗方案为顺铂25 mg·m-2/d(第1~3天)。疗效评价参照Recist1.1标准[8],完全缓解(CR):鼻咽部肿块消失,阳性淋巴结缩小到<10 mm;部分缓解(PR):鼻咽部肿块直径缩小30%;疾病进展(PD):鼻咽部肿块直径增大20%或出现新发病灶;疾病稳定(SD):鼻咽部肿块直径变化介于PR和PD之间。所有患者同步放化疗结束后第6个月采用电子鼻腔镜、鼻咽颈部MRI等影像学检查进行复查,对CR或PR者定义为放疗敏感组(n=60),对SD或PD者定义为放疗抵抗组(n=38)。所有患者在治疗后的第1年内每3个月随访1次,第2年开始每隔1年进行1次随访,以门诊或电话方式进行随访,最后随访截止时间为2022年4月1日。随访内容为患者的生存状态、临床症状、影像学检查结果等。
1.3统计学处理 采用SPSS20.0软件进行数据分析。计数资料以例数或百分率表示,组间比较采用χ2检验。采用Spearman秩相关分析NPC组织中GPX4、SLC7A11表达的相关性。Kaplan-Meier法分析GPX4、SLC7A11表达对NPC患者生存预后的影响(Log-rank检验)。Cox回归分析影响NPC患者预后的因素。P<0.05为差异有统计意义。
2 结 果
2.1NPC组织与正常鼻黏膜组织中GPX4、SLC7A11的表达情况 NPC组织中GPX4、SLC7A11棕黄色的阳性染色位于细胞质和细胞膜。NPC组织中GPX4、SLC7A11表达阳性率分别为75.51%(74/98)、73.47%(72/98),分别高于正常鼻黏膜组织的11.67%(7/60)、13.33%(8/60),差异均有统计学意义(χ2=60.715、57.632,P<0.001)。见图1。
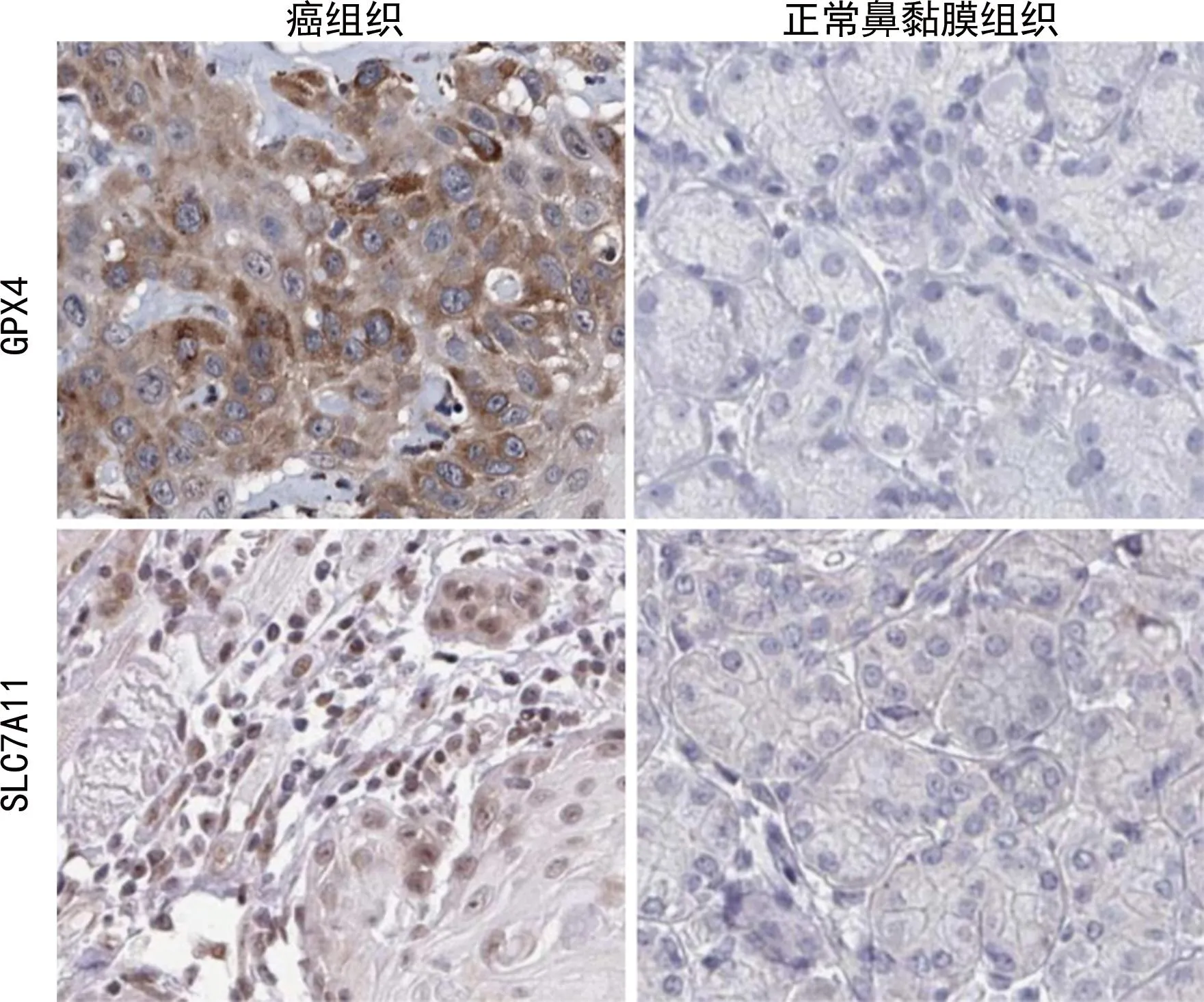
图1 NPC组织与正常鼻黏膜组织中GPX4、SLC7A11的表达(×200)
2.2NPC组织中GPX4、SLC7A11表达的相关性 Spearman秩相关分析显示,NPC组织中GPX4与SLC7A11表达呈正相关(r=0.724,P<0.001)。
2.3不同临床病理特征患者NPC组织中GPX4、SLC7A11表达阳性率比较 不同临床分期、肿瘤分化程度、淋巴结转移情况及放疗敏感性NPC患者癌组织中GPX4、SLC7A11表达阳性率比较,差异均有统计学意义(P<0.05),见表1。
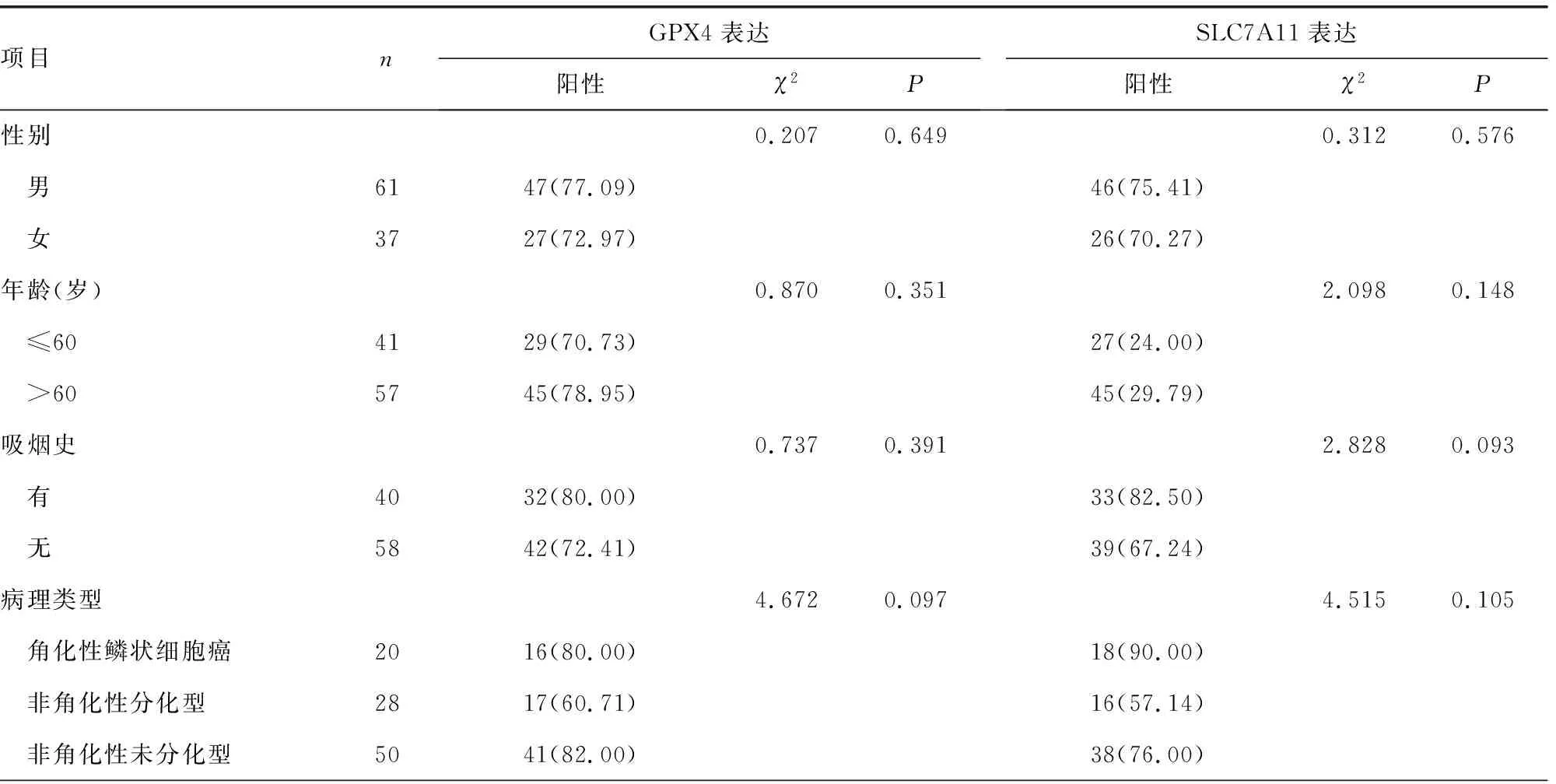
表1 不同临床病理特征NPC中GPX4、SLC7A11表达阳性率比较[n(%)]
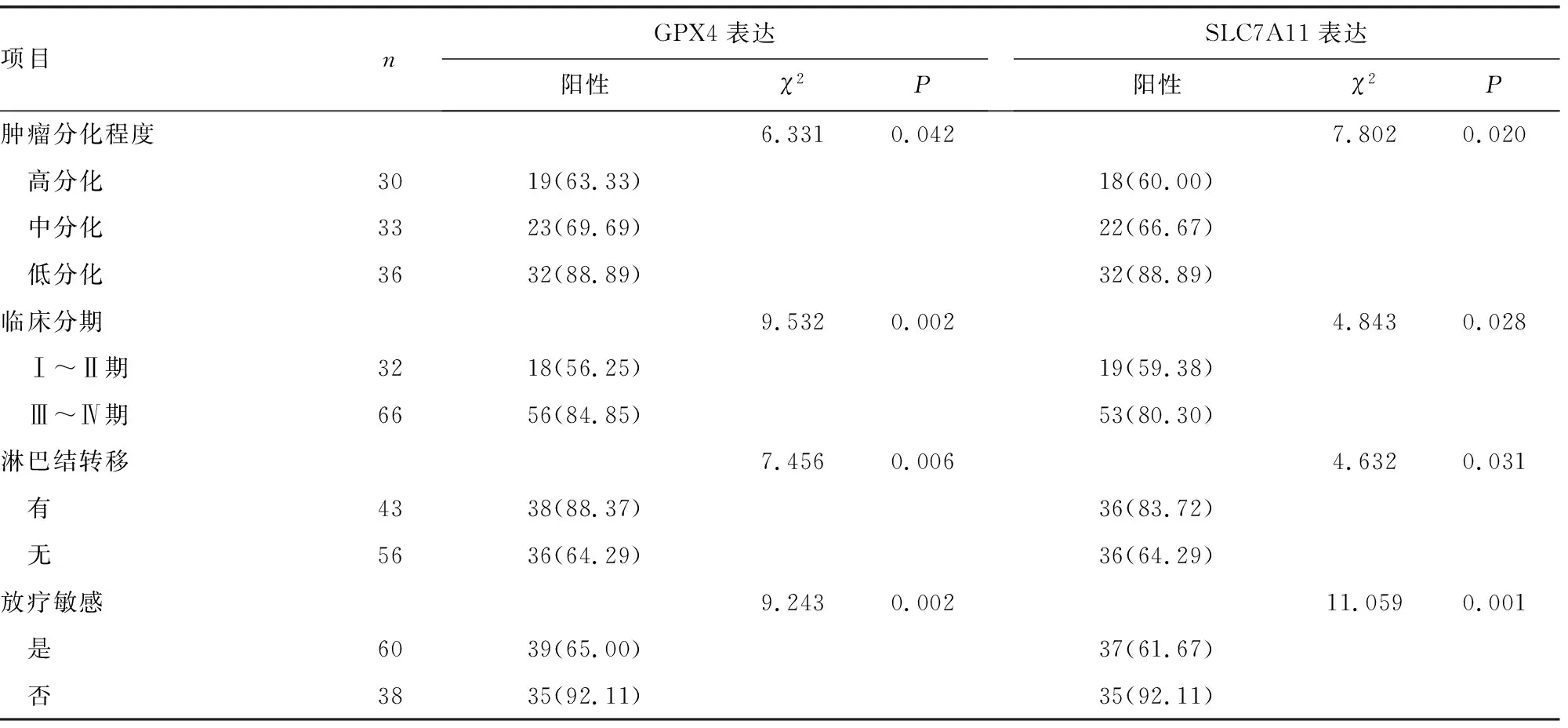
续表1 不同临床病理特征NPC中GPX4、SLC7A11表达阳性率比较[n(%)]
2.4GPX4、SLC7A11表达对NPC患者生存预后的影响 截至随访结束(共6个月),患者的中位随访时间为54个月(7~60个月),死亡27例,5年总体生存率为72.45%(71/98)。GPX4阳性及阴性表达组的5年总体生存率分别为66.22%(49/74)、91.67%(22/24);Kaplan-Meier法分析显示,GPX4阳性表达组累积生存率低于阴性表达组(Log-rankχ2=5.822,P<0.001)。SLC7A11阳性及阴性表达组5年总体生存率分别为66.67%(48/72)、88.46%(23/26);SLC7A11阳性表达组累积生存率低于阴性表达组(Log-rankχ2=5.041,P=0.012)。见图2。
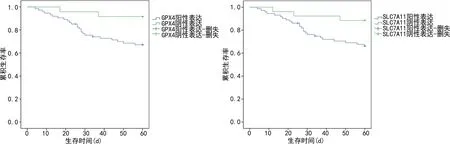
图2 Kaplan-Meier法分析GPX4、SLC7A11表达对NPC患者预后的影响
2.5影响NPC患者预后的因素分析 以NPC患者预后为因变量,包括生存状态(1=死亡,0=生存)、生存时间(d)。将年龄(1=≥60岁,0=<60岁)、性别(1=男,0=女)、吸烟史(1=有,0=无)、肿瘤分化程度(1=低分化,0=高中分化)、病理类型(1=非角化性未分化型及分化型,0=角化性鳞状细胞癌)、淋巴结转移(1=有,0=无)、临床分期(1=Ⅲ~Ⅳ期,0=Ⅰ~Ⅱ期)、GPX4(1=阳性,0=阴性)、SLC7A11(1=阳性,0=阴性)作为自变量。单因素Cox回归分析显示,临床分期、淋巴结转移、GPX4、SLC7A11是影响NPC患者预后的因素(P<0.05)。将单因素分析中差异有统计学意义的因素纳入多因素Cox回归分析,结果显示,临床分期Ⅲ~Ⅳ期、淋巴结转移、GPX4、SLC7A11是NPC患者生存预后的独立影响因素。见表2、3。

表2 单因素Cox回归分析影响NPC患者预后的因素
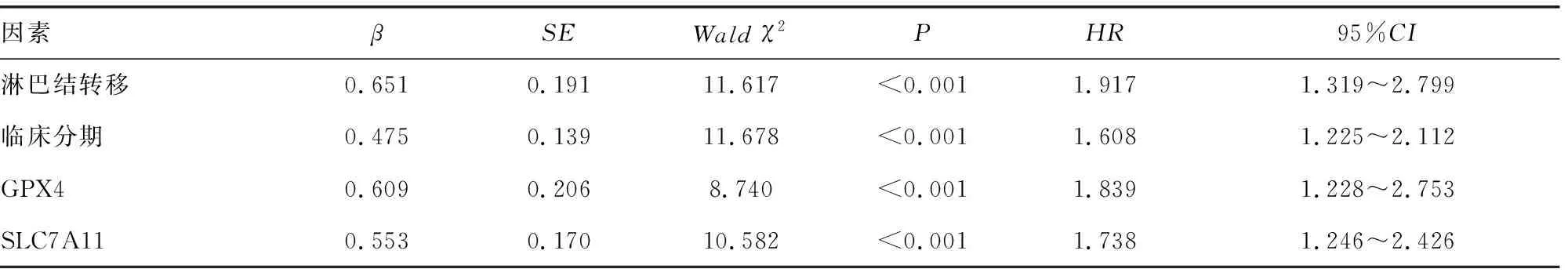
表3 多因素Cox回归分析影响NPC患者预后的因素
3 讨 论
NPC是鼻咽腔的恶性肿瘤。NPC解剖位置隐匿,恶性程度高,容易出现淋巴结转移,多数患者初诊时已为局部晚期。NPC对放疗敏感,放疗是NPC的首选治疗方案,但由于不同患者对放疗的敏感度存在差异,部分患者对放疗存在抵抗,表现为放疗后仍有部分肿瘤组织未完全消退,短时间内会发生肿瘤复发或转移,严重影响患者的生存率[9]。深入研究NPC的病理机制,寻找新的能够评估放疗敏感性及预后的生物标志物,对于选择合适的个体化治疗方案,具有重要意义。
GPX4属于谷胱甘肽过氧化物酶家族成员,具有含硒半胱氨酸的亚硒蛋白催化中心,能够还原过氧化氢,抑制脂质过氧化等生物学功能。YEE等[10]发现,胶质瘤中GPX4的表达上调能够通过抑制肿瘤细胞脂质过氧化,促进肿瘤中性粒细胞浸润,导致肿瘤免疫逃逸及恶性进展。本研究中,NPC组织中GPX4的表达升高,并与临床分期、分化程度及淋巴结转移有关,表明GPX4的表达上调促进NPC的发生发展。NPC中GPX4表达上调的机制可能与Wnt信号通路的激活有关[11]。WANG等[12]研究发现,胃癌中Wnt信号通路的激活能够促进β-连环蛋白/TCF4转录复合物直接结合GPX4的启动子区并诱导GPX4的表达。ZOU等[13]发现,肿瘤细胞的缺氧微环境导致糖脂代谢紊乱,肿瘤细胞内产生大量脂质过氧化物,GPX4通过还原脂质过氧化物及活性氧,将其转化为无毒的产物蓄积于肿瘤细胞内,避免肿瘤细胞铁死亡的发生,促进肿瘤细胞的增殖及侵袭。本研究中,GPX4表达与NPC患者放疗敏感性有关,提示GPX4有助于评估NPC患者放疗的敏感性。分析其原因,可能是GPX4的表达上调抑制放疗诱导的铁死亡的发生。有研究表明,放射治疗能够诱导活性氧产生,导致脂质过氧化,而GPX4的表达上调消除了放射治疗诱导的铁死亡,提高肿瘤的抗辐射能力,而用铁死亡诱导剂抑制肿瘤细胞中GPX4的表达后,能够恢复放疗抵抗性肿瘤细胞的放疗敏感性[14]。本研究发现,GPX4阳性表达NPC患者生存预后较差,是患者预后不良的独立危险因素,提示GPX4是一种新的评估NPC预后的生物标志物。YUAN等[15]报道,GPX4与转化生长因子β激活激酶结合形成复合物,促进下游丝裂原活化蛋白激酶和核因子κB通路的激活,促进NPC肿瘤细胞的恶性增殖和化疗耐药性的形成。
铁死亡是由Xc胱氨酸/谷氨酸反转运蛋白系统失活引起铁依赖性脂质过氧化导致的,是一种新的程序性非凋亡性细胞死亡。SLC7A11又称为xCT,是Xc氨基酸逆向转运系统的重要组成单位,其通过摄取胱氨酸并将谷氨酸转运到细胞外。越来越多的研究表明,SLC7A11在肺癌等恶性肿瘤中表达上调,导致细胞内谷胱甘肽水平升高,促进肿瘤细胞的侵袭迁移及化疗耐药性的形成[16]。本研究中,NPC组织中SLC7A11表达水平升高,并与临床分期、分化程度及淋巴结转移有关,提示SLC7A11的表达上调促进NPC肿瘤的发生及疾病进展。NPC中SLC7A11表达上调与EB病毒感染有关。YUAN等[15]研究发现,NPC中EB病毒感染通过激活p62/核因子E2相关因子2信号通路,在转录水平上调SLC7A11表达,抑制肿瘤铁死亡的发生。此外,SLC7A11还能够通过促进胱氨酸摄取和谷胱甘肽生物合成,抑制肿瘤细胞氧化应激损伤,避免铁死亡的发生,促进肿瘤细胞的增殖[17]。本研究中,SLC7A11表达与放疗敏感性有关。其原因可能是SLC7A11的表达上调抑制放疗诱导铁死亡的发生。有研究发现,肝癌中SLC7A11的N端结构域能够被细胞因子信号转导抑制因子2的SH2结构域特异性识别及泛素化降解,而细胞因子信号转导抑制因子2的表达缺失导致SLC7A11蛋白稳定性增加,抑制肿瘤铁死亡并导致肿瘤放射抵抗性的发生[18]。本研究还发现,SLC7A11阳性表达的NPC患者生存预后较差,是NPC患者不良预后的独立危险因素,提示检测NPC组织中SLC7A11的表达有助于NPC患者临床预后预测,是新的预后判断的标志物。ZHANG等[19]报道,利用小分子药物抑制SLC7A11的表达后,通过抑制雷帕霉素靶蛋白通路,促进肿瘤细胞铁死亡的发生,并增强对放化疗治疗的敏感性。因此,以SLC7A11为靶点的治疗可能是新的NPC治疗策略,有助于改善患者的临床预后。本研究中,NPC组织中GPX4与SLC7A11的表达呈正相关,提示两者共同参与NPC的肿瘤进展过程。其原因是两者共同参与抑制NPC肿瘤细胞铁死亡。SLC7A11作为氨基酸转运蛋白,其表达升高能促进谷胱甘肽合成,谷胱甘肽在GPX4催化下,还原肿瘤细胞内活性氧,避免肿瘤细胞铁死亡的发生[20]。因此,两者在NPC中协同促进肿瘤的发生和进展。
综上所述,NPC中GPX4、SLC7A11表达水平升高,两者表达与临床分期、肿瘤分化程度、淋巴结转移及放疗敏感性有关,共同参与NPC的发生、发展。GPX4、SLC7A11阳性表达的NPC患者生存预后较差,GPX4、SLC7A11是评估NPC患者预后的潜在标志物。临床医生可根据癌组织中GPX4、SLC7A11表达对患者放疗敏感性及预后进行预测,从而积极治疗,改善患者临床预后。但本研究未对NPC中GPX4、SLC7A11促进肿瘤进展的分子机制进行研究,拟后续通过细胞、分子生物学实验,进一步揭示两者的临床应用价值。

