癫痫发作患儿血清HMGB1水平与疾病严重程度及预后的关系
倪俊毅,沈 瑾,丁 焘,施燕蓉
上海健康医学院附属崇明医院儿科,上海 202150
儿童癫痫是一种伴有行为和认知问题的慢性神经系统疾病,约1/3的患儿为难治性癫痫,随着时间的推移会出现智力衰退[1],目前尚缺乏能准确反映疾病严重性或神经认知共病的生物标志物。据报道,炎症反应与癫痫的发生、发展密切相关[2-3],因此不少研究者开始寻找神经炎症的非侵入性生物标志物。星形胶质细胞是参与致痫性损伤或神经炎症的关键细胞[4],而高迁移率族蛋白B1(HMGB1)是一种由受损或活化星形胶质细胞释放的内源性分子,通过与Toll样受体(TLR)和晚期糖基化终产物受体(RAGEs)结合,激活细胞内核因子κB(NF-κB)和其他信号通路,上调促炎细胞因子的表达[5-6]。一项对癫痫动物模型的研究表明,HMGB1/TLR4信号通路的激活可显著增加癫痫发作频率[7]。李芳等[8]的研究也发现HMGB1与癫痫发作相关,但仍不清楚其作为儿童癫痫特异性神经炎症预后生物标志物的应用价值。鉴于此,本研究纳入了一组典型的神经炎症疾病——中枢神经系统获得性脱髓鞘综合征(ADS)患儿,分析其血清HMGB1水平与疾病进展的关系,以明确其在预测患儿预后评估中的应用价值。
1 资料与方法
1.1一般资料 将2019年2月至2022年6月本院收治的癫痫患儿284例纳入研究作为癫痫组,纳入研究的患儿均在就诊前48 h内有过癫痫发作,其中男143例,女141例,年龄1~12岁,平均(5.59±1.45)岁,病程0.50~9.00年,平均(6.98±1.53)年。纳入标准:(1)符合国际抗癫痫联盟制定的癫痫诊断标准[9];(2)完成了病史采集,体格和神经检查,以及脑电图、血液生化和脑磁共振成像检查,检查结果资料完整;(3)服用抗癫痫药物持续时间>6个月。排除标准:(1)自身免疫性癫痫;(2)创伤后癫痫;(3)新生儿癫痫、婴儿痉挛。另外,将同期本院收治的伴癫痫发作的ADS患儿18例作为ADS组,表现为癫痫持续至少24 h,累及视神经、脑或脊髓,并伴有T2加权图像信号增强的局部区域[10],包括急性播散性脑脊髓炎患儿4例、多发性硬症患儿3例、视神经脊髓炎谱系障碍患儿6例、急性横贯性脊髓炎患儿5例,所有ADS患儿在首次发病时即出现癫痫发作。ADS组中,男11例,女7例,年龄2~12岁,平均(5.97±1.03)岁,病程0.90~10.01年,平均(7.95±1.31)年。另外,将同期于本院进行体检的健康儿童146例纳入研究为对照组,其中男71例,女75例,年龄2~14岁,平均(5.71±1.64)岁。对照组儿童无急性头痛发作或任何热性癫痫发作,无癫痫病史或中枢神经系统病史。3组性别、年龄等一般资料比较,差异均无统计学意义(P>0.05)。本研究获医院医学伦理委员会批准(批号:2019伦审科字第G028号),纳入研究儿童的监护人对本研究知情同意并签署知情同意书。
1.2方法
1.2.1临床资料收集 查阅患儿病历,收集以下资料:性别、年龄、病程、抗癫痫药物(卡马西平、左乙拉西坦、丙戊酸钠、苯妥英钠、苯巴比妥、托吡酯)使用情况、癫痫发病原因[脑肿瘤等引起的结构性癫痫(结构性)/遗传或胎儿时受到感染或辐射等造成大脑发育异常引发的遗传性癫痫(遗传性)/代谢疾病引发的代谢性癫痫(代谢性)/病毒、细菌、寄生虫等病原体感染引起的感染性癫痫(感染性)/未知原因]、癫痫发作类型(局灶性发作/全面性发作)、是否出现神经系统发育共病(包括智力低下、注意缺陷多动障碍、自闭症谱系障碍等)、大脑皮层发育情况、是否出现癫痫持续状态(定义为癫痫连续发作时,意识未完全恢复,而又频繁再发,或发作持续时间超过30 min不能自行停止)、入院采血前最后一次癫痫发作持续时间。
1.2.2血清HMGB1水平检测 癫痫组和ADS组患儿在急性癫痫发作或神经症状复发(如视力丧失或突然运动障碍)后48 h内采集静脉血5 mL,分离血清,-70 ℃保存待检。对照组在入组时采集静脉血5 mL,分离血清,-70 ℃保存待检。采用酶联免疫吸附测定法检测血清HMGB1水平,试剂盒购自美国Thermo Scientific公司。
1.2.3脑电图异常严重程度评估[11]癫痫组患儿在急性癫痫发作或神经症状复发期间采用16导联数字脑电地形图仪(美国Cadwell)进行脑电图检查,每例描记时间不少于20 min。脑电图异常严重程度分为轻度异常、中度异常和重度异常。轻度异常:α波节律不稳定,对睁眼或任意其他活动等抑制反应不明显,高幅β波出现,各区Q波活动增加,高幅Q波主要出现在过度换气时段。中度异常:α波节律明显不对称,有些地方甚至消失,Q波活动呈弥散性,还有Q波活动阵发性出现,过度换气时成群出现高波幅δ波。重度异常:Q波和δ波弥散性出现,α节律变慢或消失,δ波阵发出现,伴有自发或诱发高波幅尖波、棘波或棘慢综合波,有时甚至爆发性活动。
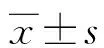
2 结 果
2.13组血清HMGB1水平比较 与对照组相比,癫痫组和ADS组血清HMGB1水平升高(P<0.05),而癫痫组和ADS组血清HMGB1水平比较差异无统计学意义(P>0.05),见图1。对照组HMGB1水平为9.96(6.34,17.49)ng/mL,癫痫组为29.63(17.82,44.82)ng/mL,ADS组为27.27(17.65,80.27)ng/mL,3组间比较差异有统计学意义(H=6.693,P=0.036)。
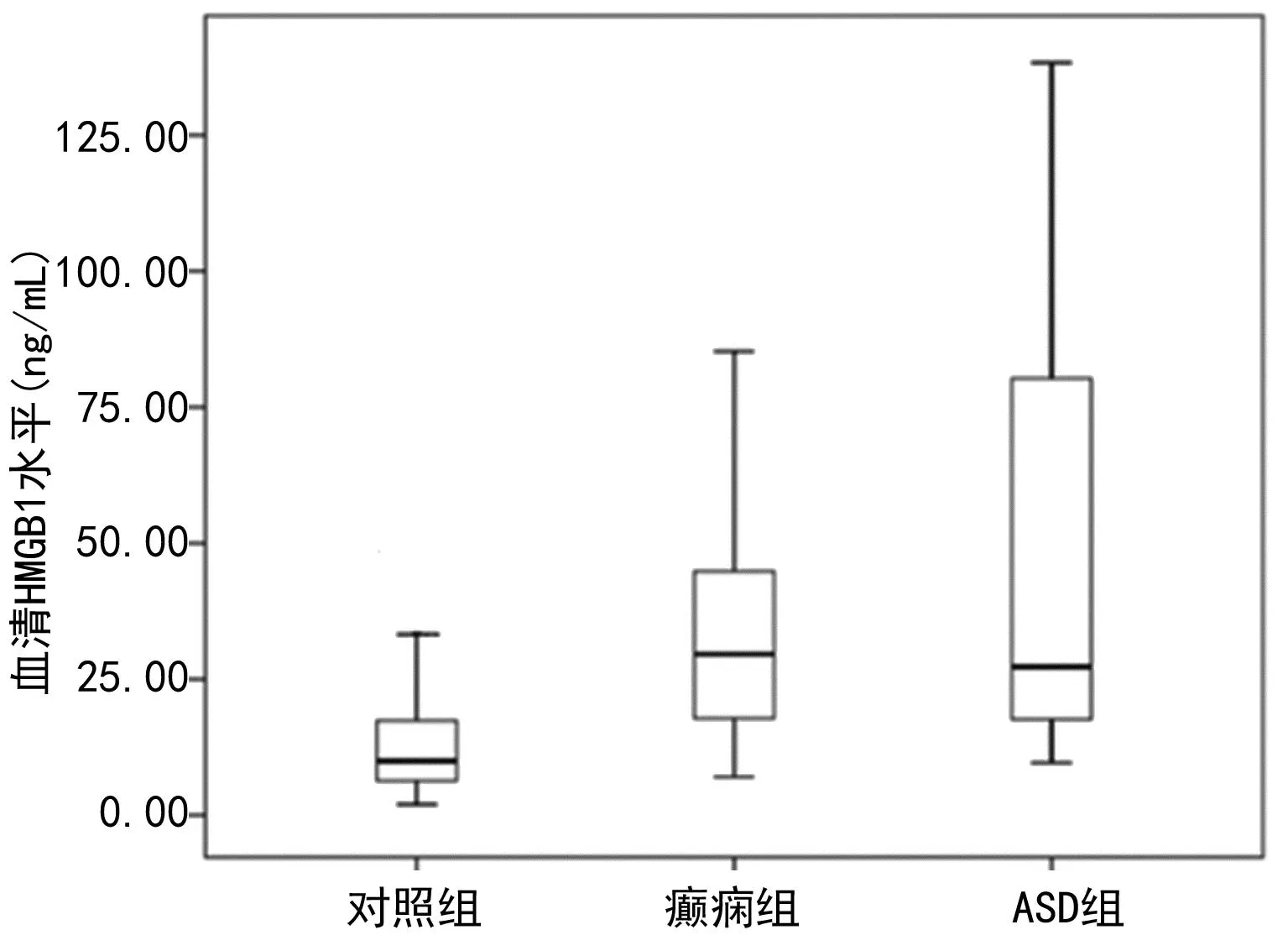
图1 3组血清HMGB1水平比较
2.2血清HMGB1水平诊断癫痫和ADS的效能分析 以对照组为参照,对癫痫或ADS进行诊断,ROC曲线分析显示,血清HMGB1用于癫痫和ADS的诊断,AUC分别为0.785(95%CI:0.739~0.831,P<0.001)、0.843(95%CI:0.760~0.927,P<0.001)。HMGB1用于诊断癫痫的截断值为16.0 ng/mL,灵敏度和特异度分别为80.62%、64.81%。HMGB1用于诊断ADS的截断值为17.53 ng/mL,对应的灵敏度和特异度分别为77.84%、75.36%。见图2。
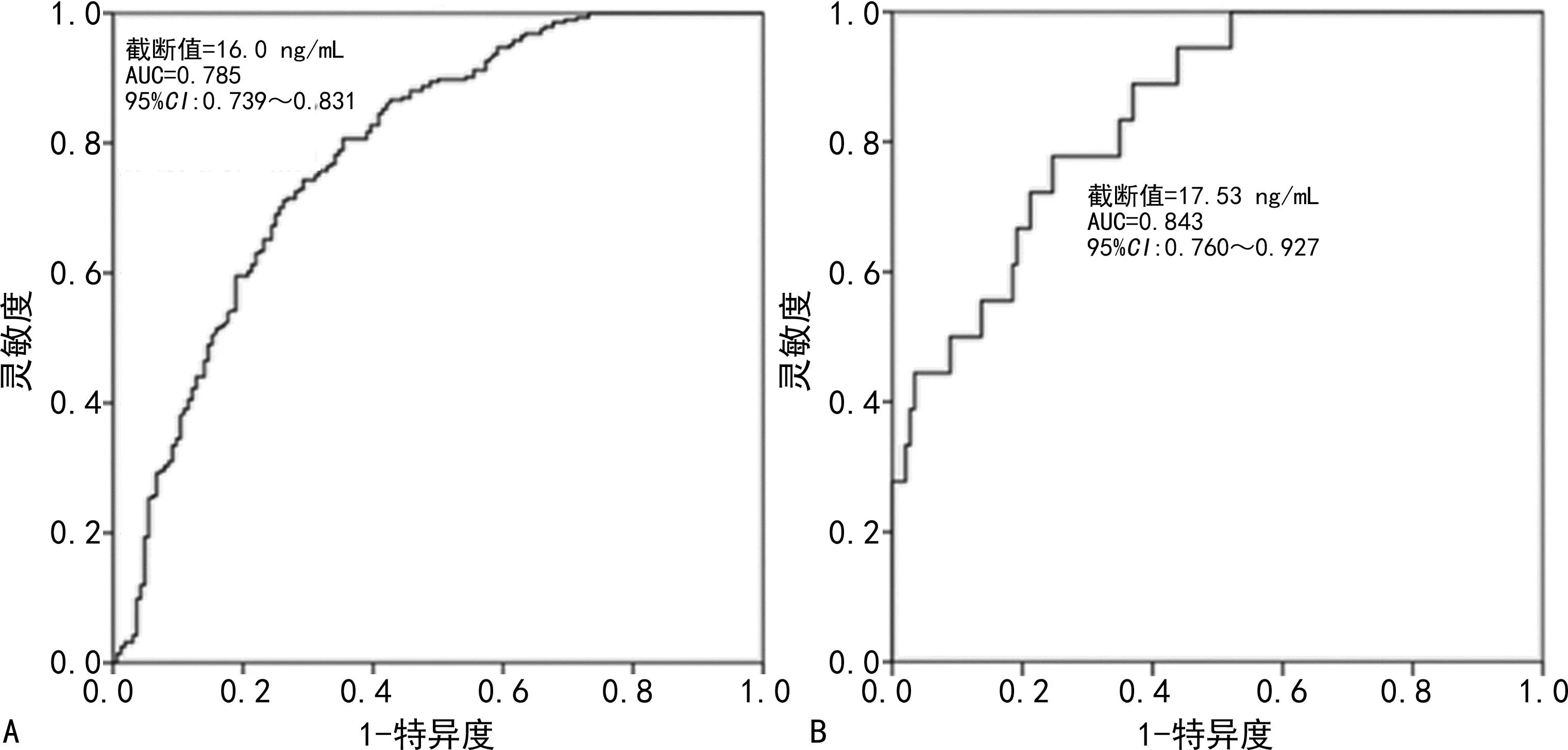
注:A为血清HMGB1水平用于诊断癫痫的ROC曲线图;B为血清HMGB1水平用于诊断ADS的ROC曲线图。
2.3血清HMGB1水平与疾病严重程度的关系 癫痫组中,有193例(67.96%)患儿脑电图检查结果为无异常/轻度异常,66例(23.24%)为中度异常,25例(8.80%)为重度异常。其中,脑电图重度异常患儿的血清HMGB1水平最高,中度异常患儿次之,无异常/轻度异常患儿水平最低,3组比较差异有统计学意义[26.85(18.13,31.45)ng/mLvs.32.78(27.63,54.80)ng/mLvs.54.95(39.20,63.40)ng/mL,H=68.285,P<0.001],见图3A。经Spearman相关分析,癫痫组血清HMGB1水平与脑电图异常程度(rs=0.643,P<0.001)、病程(rs=0.186,P=0.002)、抗癫痫药物种类数量(rs=0.122,P=0.041)和采血前最后一次癫痫发作持续时间(rs=0.319,P<0.001)均呈正相关,见图3B~D。在ADS组中,患儿血清HMGB1水平与ADS病程也呈正相关(rs=0.213,P=0.035),见图3E。
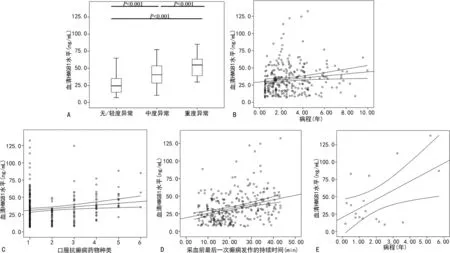
注:A为血清HMGB1水平与癫痫组患儿脑电图异常的关系;B为血清HMGB1水平与病程的相关性;C为血清HMGB1水平与癫痫组患儿口服抗癫痫药物种类数量的相关性;D为血清HMGB1水平与采血前最后一次癫痫发作持续时间的相关性;E为血清HMGB1水平与ADS组患儿病程的相关性。
2.4癫痫患儿血清HMGB1水平与其他临床资料的关系 根据癫痫患儿血清HMGB1水平中位值29.63 ng/mL,将患儿分成低水平亚组(n=142,HMGB1<中位值)和高水平亚组(n=142,HMGB1≥中位值)。血清HMGB1高水平亚组全面性发作(P=0.023)、伴有神经发育共病(P=0.008)、癫痫持续状态(P=0.002)患儿比例显著高于低水平亚组,见表1。
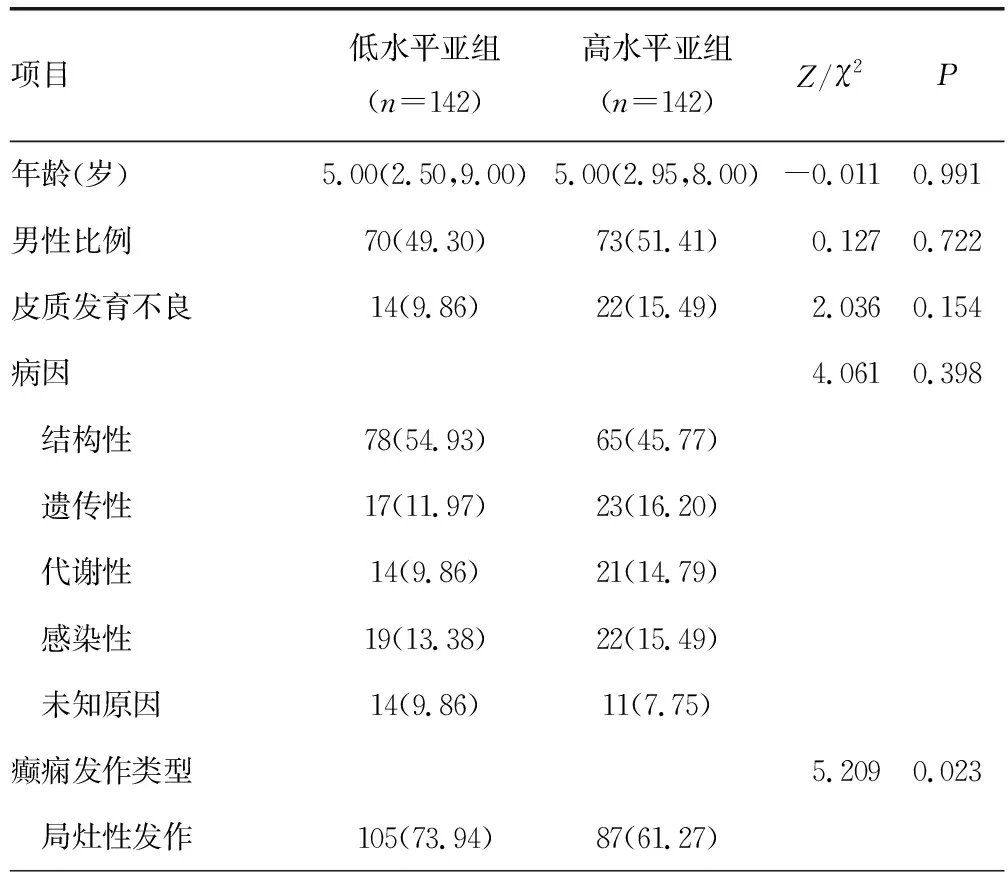
表1 癫痫患儿血清HMGB1水平与其他临床资料的关系[M(P25,P75)或n(%)]

续表1 癫痫患儿血清HMGB1水平与其他临床资料的关系[M(P25,P75)或n(%)]
2.5癫痫患儿预后的影响因素分析 采用单因素和多因素Logistic回归分析影响癫痫患儿预后的因素,本研究中将脑电图中/重度异常或神经发育共病视为预后不良。将癫痫患儿脑电图中/重度异常或神经发育共病作为因变量(赋值:是=1,否=0);纳入年龄、性别、病程、抗癫痫药物治疗、皮质发育不良、癫痫发作类型、癫痫持续状态、病因学和血清HMGB1水平等指标作为自变量,建立回归模型。结果显示,经多因素Logistic回归分析,皮质发育不良、癫痫持续状态及血清HMGB1水平≥29.63 ng/mL是癫痫患儿脑电图中/重度异常的危险因素(P<0.05);病程≥3.5年、皮质发育不良及血清HMGB1水平≥29.63 ng/mL是癫痫患儿神经发育共病的危险因素(P<0.05)。见表2、3。
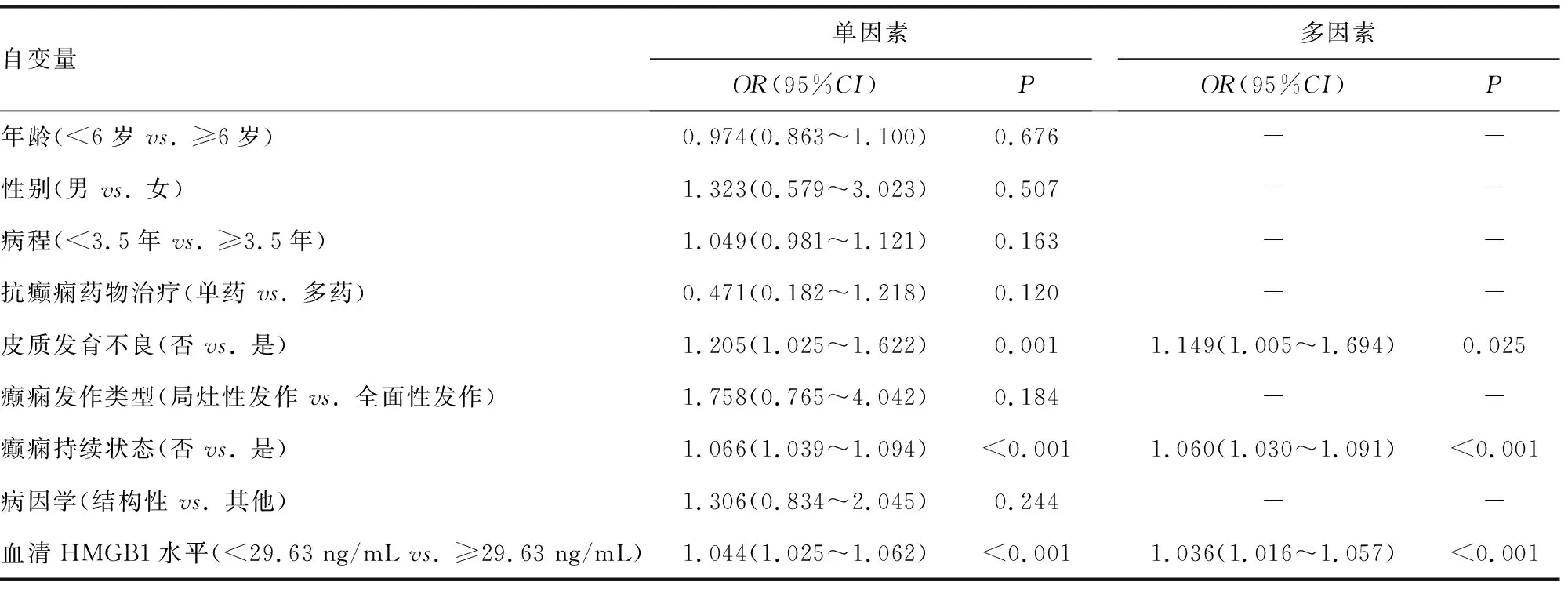
表2 单因素及多因素Logistic回归分析癫痫患儿脑电图中/重度异常的危险因素
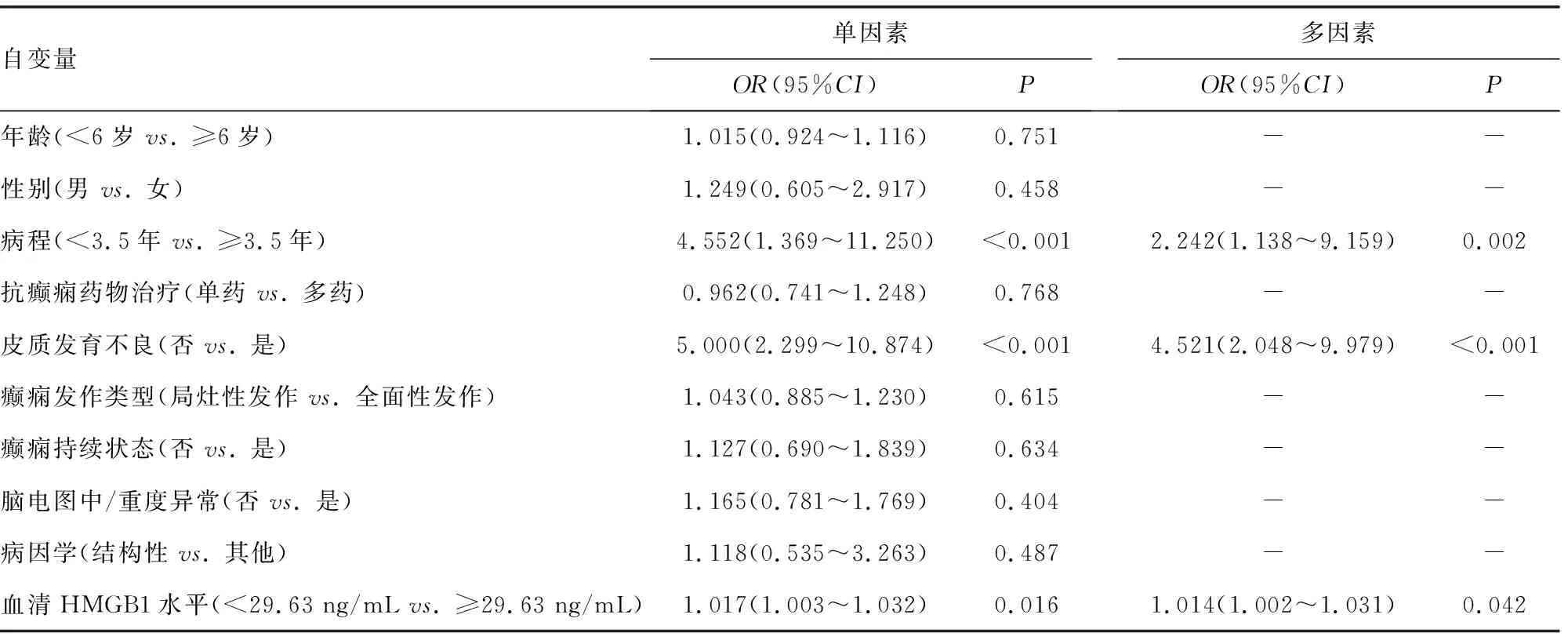
表3 单因素及多因素Logistic回归分析影响癫痫患儿神经发育共病的临床因素
3 讨 论
癫痫是一种严重的神经系统疾病,目前的抗癫痫药物只能缓解症状,而不是从发病机制出发治疗疾病,并且三分之一的患者可能发生获得性耐药[1]。此外,由于认知功能障碍、焦虑和抑郁等一系列相关的合并症,会加重患者心理负担。因此,需要开发出能够评估疾病严重程度以及预后的新型生物标志物。本研究表明,患有癫痫或ADS(自身免疫性神经炎症疾病)的儿童血清HMGB1水平显著升高,并与疾病严重程度相关,这提示了一种神经退行性过程,HMGB1可作为评估儿童癫痫持续神经炎症预后的潜在生物标志物。
儿童癫痫患病率约为成年人的2倍,通常发病较早,更有可能出现智力发育障碍和行为问题[12]。许多研究已经明确了与癫痫相关的病理变化,包括胶质细胞增殖、神经元损伤和脱髓鞘[13-14]。据报道,急性脑损伤(如脑血管损伤、感染、癫痫发作和创伤性脑损伤)后,许多分子通路被激活,不仅在典型的神经炎症性疾病(如ADS)中,而且在癫痫中,也常常导致慢性神经炎症的发展[15]。儿童对急性癫痫发作的高反应性可能会加剧对各种炎症因子的促炎反应,如感染、创伤甚至发热性癫痫发作,并可能导致持续的神经炎症,从而导致癫痫[16]。星形胶质细胞的活化是各种致癫痫性损伤后大脑中发生的最显著的细胞变化之一。癫痫动物实验模型的研究表明,在癫痫发生过程中,活化的星形胶质细胞产生并释放一系列促炎介质,这些介质可能导致自发癫痫发作、细胞丢失和共病[17]。由于神经炎症在癫痫中发病中的作用,使用无创方法监测这一过程可能发现潜在的癫痫生物标志物。
HMGB1水平的变化是一种具有代表性的损伤相关分子模式(DAMP),在许多疾病条件下可促进炎症反应[18]。如HMGB1可介导和放大缺血后的炎症反应,加重脑损伤[19];脓毒症小鼠模型中脑脊液HMGB1浓度升高,这与脑胆碱能系统的过度激活相关;拮抗脑HMGB1有利于胆碱能性抗炎通路的功能内稳态的维持,并对周围树突状细胞的免疫应答具有保护作用[20]。此外,HMGB1作为一种炎症细胞因子对致癫痫性损伤也会作出反应。HMGB1分子结构中包含两个DNA结合结构域,即Box A和Box B,以及由重复的谷氨酸和天门冬氨酸残基组成的C末端酸性尾[18]。DAMP可以影响大脑区域的突触功能,如海马体。海马体与癫痫的过度兴奋和认知能力下降有关。据报道,神经元损伤后,大量HMGB1立即从细胞核被动释放到细胞外空间[21]。而HMGB1可通过激活RAGEs/NF-κB通路促进成年海马神经祖细胞的神经元分化[5-6]。总之,HMGB1作为神经炎症的发起者和放大器在神经元兴奋、维持海马神经发生中发挥着关键作用。此外,有人提出HMGB1可能通过对血脑屏障的破坏和炎症过程的诱导参与癫痫发作[8,22],尽管确切的机制仍不确定。在本研究中,癫痫组和ADS组患儿血清HMGB1水平均高于对照组,这意味着血清HMGB1可能是神经退行性病变过程的潜在生物标志物。ROC曲线分析显示,血清HMGB1诊断癫痫患儿的AUC为0.785,诊断ADS的AUC为0.843,提示监测患儿血清HMGB1水平对预测癫痫和ADS的发生具有一定的价值可为后期治疗提供参考。此外,癫痫患儿血清HMGB1与脑电图异常、病程、抗癫痫药物数量和采血前最后一次癫痫发作持续时间均呈显著正相关,抗癫痫药物数量的增加表明患者存在耐药性,血清HMGB1升高可能与抗癫痫药物耐药性的产生有关,说明脑损伤越严重,患儿越有可能产生耐药性;并且HMGB1水平呈高表达的患儿癫痫全面性发作、伴有神经发育共病、癫痫出现持续状态的患儿比例更高,提示HMGB1影响神经胶质细胞代谢,与癫痫发作相关。多因素Logistic分析显示,血清HMGB1水平升高是癫痫患儿脑电图中/重度异常或神经发育共病的危险因素,提示HMGB1可以用于对癫痫患儿预后的评估,作为评价癫痫疾病转归的预测指标。上述结果表明血清HMGB1浓度变化可能反映癫痫的疾病进展和神经炎症,有助于预测神经发育情况。早期发现智力损伤可能有助于及早进行干预性治疗,以减少癫痫患者后遗症的发病风险。
总之,本研究证明癫痫患儿和ADS患儿血清HMGB1水平普遍升高,而且与疾病严重程度的相关。血清HMGB1能反映癫痫患儿疾病严重程度,是神经炎症预后的生物标志物。在下一步的研究中,将扩大样本量并及进行神经认知测试,以确认其作为癫痫预后生物标志物的可行性。

