多重PCR毛细管电泳细菌快速鉴定方法的建立和临床应用研究
汤荣睿,陈 瑶,李 娟,李 蓉,王 芳,裴光德
重庆市沙坪坝区人民医院医学检验科,重庆 400033
快速、准确地为临床提供细菌鉴定报告有利于临床及时诊断感染性疾病、合理使用抗菌药物、降低病死率、减少患者治疗费用、提高医院感染防控能力。有研究表明,有效的抗菌药物治疗每延迟1 h,感染性休克患者出现低血压后的存活率平均下降7.6%[1]。临床实践中,细菌鉴定采用的传统方法为培养法,检测周期一般为2~4 d,难以实现快速报告检测结果。多重PCR技术是指通过一次PCR反应同时对多个靶标进行扩增,结合一定的检测手段对扩增产物进行检测从而实现对多个靶标进行诊断的技术[2]。该技术操作简便快速,灵敏度高,可直接提取标本核酸进行扩增检测[3-10]。省去了转种分离培养的大部分时间,在时效上明显优于传统培养法。本研究拟建立基于多重PCR毛细管电泳技术的细菌快速鉴定方法,与培养法进行结果比对,评估其临床应用价值,为提高细菌鉴定速度、提升临床感染性疾病诊疗效果、推进抗菌药物合理使用提供参考。
1 材料与方法
1.1标本来源 收集本院2022年1月至2023年2月临床送检的微生物培养标本150例,包括血液44例(29.33%)、尿液52例(34.67%)、痰液41例(27.33%)、胸腹水8例(5.34%)、脑脊液5例(3.33%)。标本的采集、送检、接收均严格按照《全国临床检验操作规程》要求执行,对痰标本按照《WS/T 499-2017 下呼吸道感染细菌培养操作指南》进行质量筛查与评估,判定为可接收标本的标准为鳞状上皮细胞<10个/低倍视野,白细胞>25个/低倍视野。
1.2仪器与试剂 A100型PCR仪(杭州朗基科学仪器有限公司)、Qsep400型全自动毛细管电泳仪[光鼎生物科技(江苏)有限公司]、HH-1型恒温水浴锅(嘉兴俊恩电子有限公司)、VORTEX-GENIE 2型涡旋混匀仪(美国Scientific Industries公司)、5424R型高速离心机(德国Eppendorf公司)、NanoDrop 1000型微量紫外可见分光光度计(美国Thermo Fisher公司)。High Resolution S1 cartridge(一种高分辨率卡夹,用于与Qsep系列仪器搭配进行核酸片段的检测)、DNA标记物1K Size marker、1K Alignment marker均为光鼎生物科技(江苏)有限公司产品,Triton X-100(北京博远泰隆生物科技有限公司)、矿物油(美国BBI公司)、无核酸水(Invitrogen公司)。TDR-300BPLUS型全自动细菌鉴定及药敏分析仪(天地人公司)、TDR-Z200型细菌浊度仪(天地人公司)、DH-160Ⅰ型二氧化碳培养箱(上海三腾仪器有限公司),肠杆菌科细菌生化药敏试验卡、非发酵菌生化药敏试验卡、葡萄球菌生化药敏试验卡、链球菌生化药敏试验卡、奈瑟菌/嗜血杆菌生化药敏试验卡均为天地人公司产品。
1.3方法
1.3.1检测的病原菌 根据感染相关指南中感染病原谱[11-13]、全国细菌耐药监测网[14]以及一些大型三甲医院的统计数据[15-16]。选取23种常见病原菌作为研究对象,分别是大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌、铜绿假单胞菌、鲍曼不动杆菌、醋酸钙不动杆菌、医院不动杆菌、皮特不动杆菌、屎肠球菌、粪肠球菌、嗜麦芽窄食单胞菌、阴沟肠杆菌、流感嗜血杆菌、肺炎链球菌、化脓性链球菌、表皮葡萄球菌、无乳链球菌、普通变形杆菌、奇异变形杆菌、黏质沙雷氏菌、产气肠杆菌、脆弱类杆菌、粪产碱杆菌。
1.3.2建立多重PCR毛细管电泳检测体系 (1)引物设计:通过细菌靶标筛选软件选出23种细菌特异性检测靶标,用Primer5.0软件设计其特异性引物并筛选出最优的多重引物组。(2)引物验证:分别用每对引物对质粒标准品和目标菌株基因组DNA为模板进行单引物单模板的PCR扩增,将PCR扩增产物进行毛细管电泳检测,分析PCR产物是否单一特异性扩增和PCR产物水平,并将PCR产物进行Sanger测序,验证引物敏感性。除去待验证目标菌株DNA,将非检测范围内的菌株DNA和人基因组DNA混合,使用目标菌株的特异性引物进行单引物单模板的PCR扩增,将PCR扩增产物进行毛细管电泳检测,分析PCR产物有无非特异性条带验证引物特异性,建立各病原菌单重PCR检测体系。(3)多重PCR检测体系:在单重PCR检测体系基础上依次増加反应重数,以质粒标准品和标准菌株为模板(各模板拷贝数浓度保持一致),通过调整退火温度和优化引物浓度等方法,建立最优的多重PCR检测体系。每组多重PCR检测体系在一个反应管中进行,每组中均含有需检测病原菌的引物对。第1组检测的病原菌为铜绿假单胞菌、表皮葡萄球菌、嗜麦芽窄食单胞菌、肺炎克雷伯菌和鲍曼不动杆菌;第2组检测的病原菌为流感嗜血杆菌、大肠埃希菌、肺炎链球菌和阴沟肠杆菌;第3组检测的病原菌为金黄色葡萄球菌菌、化脓性链球菌、粪产碱杆菌、皮特不动杆菌、屎肠球菌、普通变形杆菌和无乳链球菌;第4组检测的病原菌为粪肠球菌、医院不动杆菌、黏质沙雷菌、醋酸钙不动杆菌、产气肠杆菌、奇异变形杆菌和脆弱类杆菌。(4)多重PCR毛细管电泳法(以下简称多重PCR法)的检测步骤。①核酸提取释放:将1.5 mL离心管中的样本吹打混匀,12 000 r/min离心10 min,弃上清;在沉淀中加入20~100 μL 0.1% TritonX-100,涡旋混匀,将沉淀悬浮液置于100 ℃沸水浴10 min;沸水浴后迅速冰浴5 min,然后8 000 r/min离心5 min,取上清液于新的1.5 mL离心管中,所得上清液即为检测模板,置-80 ℃备用。②PCR反应体系配制与检测:将反应液分别加入8联管或96孔板中,每孔加17.5 μL,并往反应孔中分别依次加入2.5 μL的阴性质控品、待测样本和阳性质控品,最后加入10 μL矿物油后,盖好盖子,充分混匀并离心。上述配制好的试剂进行PCR扩增,扩增程序如下,98 ℃预变性10 min,98℃ 10 s、60 ℃ 10 s、72 ℃ 30 s,循环35次,最后72 ℃延伸5min,4 ℃结束反应。③毛细管电泳检测及结果分析:按照仪器说明书使用Qsep400全自动毛细管电泳仪对PCR产物进行电泳,根据预期PCR扩增片段大小对结果进行判定。
1.3.3临床标本检测 将每例临床标本分成2份,一份采用培养法,严格按照《全国临床检验操作规程(第4版)》进行细菌培养鉴定,采用TDR-300BPLUS全自动细菌鉴定分析系统及配套细菌鉴定卡;一份采用多重PCR法进行细菌鉴定。
1.4统计学处理 使用SPSS22.0进行统计学分析,计数资料采用频数或百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1培养法检测结果 150例临床标本中,细菌培养检测出阳性标本105例,分离出14种共105株细菌,阳性率为70.0%(105/150),其中大肠埃希菌34株、流感嗜血杆菌12株、肺炎克雷伯菌10株、肺炎链球菌9株、奇异变形杆菌8株、金黄色葡萄球菌6株、粪肠球菌6株、屎肠球菌6株,其他细菌7种14株。
2.2多重PCR法检测结果 在150例标本中,多重PCR法检测出阳性标本110例,分离出15种138株细菌,阳性率为73.3%(110/150),其中大肠埃希菌35株、肺炎链球菌24株、流感嗜血杆菌16株、肺炎克雷伯菌10株、屎肠球菌9株、金黄色葡萄球菌8株、奇异变形杆菌8株、粪肠球菌8株、鲍曼不动杆菌6株,其他细菌6种14株。
2.3两种方法检测的阳性率比较 培养法和多重PCR法检测的阳性率比较,差异无统计学意义(P>0.05),见表1。
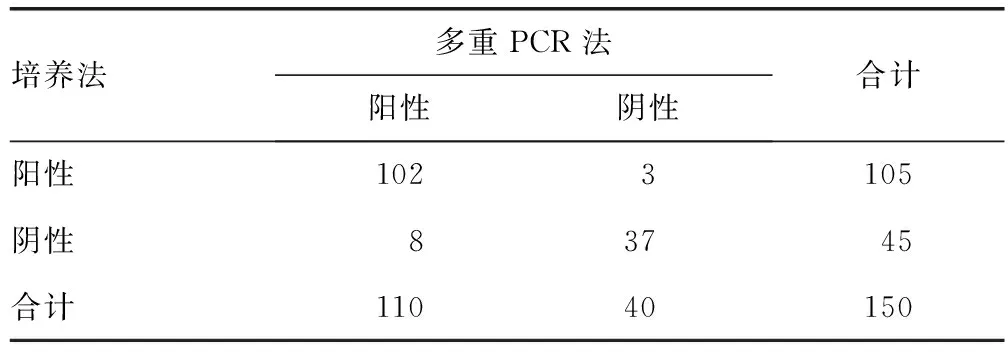
表1 培养法和多重PCR法检测结果的比较(n)
2.4两种方法检出病原菌的检出率和构成比 培养法和多重PCR法检测出的菌株种类构成情况和检出率见表2。

表2 病原菌检出率与构成比[n(%)]
2.5两种方法对5种病原菌检测结果的比较 选取临床常见苛养菌及多重PCR法检出率前三的细菌,对其两种方法的检出率进行对比,见表3。多重PCR法对肺炎链球菌的检出率[16.0%(24/150)]高于培养法[6.0%(9/150)],差异有统计学意义(P<0.05);两种方法对流感嗜血杆菌、大肠埃希菌、肺炎克雷伯菌、屎肠球菌四种病原菌的检出率比较,差异无统计学意义(P>0.05)。

表3 两种方法对5种致病菌检测结果的对比(n)
2.6多重PCR法的检测效能评价 以培养法为参考标准,多重PCR法检测效能的评价指标见表4。以培养法为参考标准,对150例临床标本的检测中,多重PCR法的符合率为79.3%;对血液标本检测的符合率最高,为100.0%,其次为体液标本,符合率为84.6%,痰液标本符合率为48.8%。

表4 多重PCR法检测效能的评价(%)
2.7多重PCR对混合菌标本的检出情况 多重PCR法共检出23例混合菌标本,其中痰标本有16例,尿液标本有7例,多重PCR对混合菌标本的检出率为15.3%,培养法未检出混合菌标本。见表5。

表5 多重PCR对混合菌标本检出情况(n=150)
2.8检测时效性 培养法需将样品接种在平板培养纯化后,再通过微生物鉴定仪进行鉴定。检测时间需要2~4 d;多重PCR法检测时间为3~6 h。可见用多重PCR法进行细菌鉴定,可明显缩短检测周期。
3 讨 论
目前,各医疗机构微生物室细菌鉴定采用的方法大多为培养法,其优点是成本较低,适合基层医院开展,缺点是耗时长,从标本接种、分纯、鉴定结果报告一般需要2~4 d甚至更长时间,难以实现临床细菌鉴定结果的快速报告[17],而且实验室的培养条件、采集标本前患者是否使用抗菌药物、技术人员操作因素等都会影响培养结果。虽然近几年基质辅助激光解析电离-飞行时间质谱(MALDI-TOF)技术已经逐步在三甲医院中应用,可在一定程度上缩短鉴定时间,但该方法目前还不能直接检测临床标本,在鉴定前仍需进行细菌培养和分纯,因此耗时一般也在24 h以上。近年来国内外基于多重PCR技术对病原体鉴定的相关研究取得了一定进展,多重PCR具有高灵敏度、高通量、快速高效等优势,有利于临床快速鉴定感染病原体,及时诊断并启动靶向治疗,从而缩短有效治疗的时间[18-21]。
本研究建立的多重PCR法和培养法的结果比对显示,多重PCR对肺炎链球菌检出率为16.0%,培养法为6.0%,两者之间比较,差异有统计学意义(P<0.05)。本研究中,多重PCR对儿童社区获得性肺炎首要病原菌肺炎链球菌检测的灵敏度达到100.0%,检出率是培养法的2.7倍,优于培养法,且检测时间仅为3~6 h,比传统细菌培养快很多,对临床早期使用抗菌药物具有重要的指导意义。由于抗菌药物滥用等原因,老人和儿童等免疫力低下患者更容易发生混合菌感染,因多重PCR技术在单次反应中可以同时检测多个病原菌,能快速检测出潜在的混合菌感染,对临床及时诊断和治疗混合感染具有重要意义[4],本研究结果显示,在150例标本中,多重PCR对混合菌标本的检出率达到15.3%,而传统培养法未检出,也显示多重PCR相比培养法对混合菌标本具有更高的检出率,但检出的混合菌是致病菌还是定植菌,还需要进一步加强临床符合率的调查。
以培养法为参考标准,多重PCR法检测符合率为79.3%。其差异可能是因为培养法必须先通过培养进行菌落提取和纯化,而实验室的培养条件、细菌本身的结构特性以及技术人员操作因素等都会影响培养的结果,尤其是对混合感染检测结果的影响较大。多重PCR法因为对肺炎链球菌和混合菌检测具有较高的灵敏度,也可能导致与培养法结果不一致的情况,对于不一致的结果,还需要进一步加强临床符合率调查。本研究对不同类型临床标本的检测数量还不够充足,在后续的研究中,会进行更大规模的测试,筛选出不同标本类型的常见菌谱,设计并建立针对不同类型标本的多重PCR检测体系,评价其检测性能,以进一步评估和优化本方法。

