高糖培养条件下lncRNA CCAT2调控心肌细胞损伤和凋亡的机制研究
宋金萍,崔彦杰,刘 熔
新疆维吾尔自治区人民医院临床检验中心,新疆乌鲁木齐 830001
糖尿病心肌病(DCM)是糖尿病患者心脏的特异性病变,独立于高血压和冠心病,与糖尿病患者发生心力衰竭和病死率升高密切相关[1]。DCM发病因素多,确切的发病机制仍不明确[2]。心肌细胞的损伤与凋亡是引起DCM的主要原因[3]。高血糖诱导的心肌细胞的损伤和凋亡可能是造成心室结构改变的重要原因,最终导致心功能障碍[4]。因此,研究如何减轻心肌细胞损伤与凋亡具有重要意义。长链非编码RNA(lncRNA)的异常表达被证实在分子水平调控了DCM的病理发展过程[5]。研究证实,lncRNA结肠癌相关转录本2(CCAT2)可通过调控Wnt/β-catenin信号通路,促进肿瘤细胞增殖,抑制细胞凋亡[6]。那么高糖条件下,lncRNA CCAT2是否通过Wnt信号通路调控心肌细胞的损伤和凋亡。在此,本课题组研究了lncRNA CCAT2在高糖诱导的AC16心肌细胞损伤和凋亡中的作用,并对Wnt/β-catenin信号通路的调控机制进行了研究。研究结果表明,靶向lncRNA CCAT2可能是一种很有前景的DCM治疗策略。
1 材料与方法
1.1细胞来源 人心肌细胞AC16购自雅吉生物公司。
1.2仪器与试剂 DMEM(高糖)培养基购自美国Gibco公司,胎牛血清(FBS)购自Excell Bio公司,青霉素-链霉素双抗和胰酶(0.25% Trypsin-EDTA)购自美国Gibco公司;CCK8细胞增殖/毒性检测试剂盒购自全式金生物公司;Lipofectamine 3000®(Lipo3000)转染试剂购自Invitrogen公司;干扰RNA阴性对照、干扰RNA(干扰靶点为lncRNA CCAT2)、riboMONITOR Transfection Indicator试剂盒购自广州锐博公司;TRIzolTMReagent购自Ambion公司;反转录试剂盒5×All-In-One RT MasterMix (with AccuRT Genomic DNA Removal Kit)和基因扩增试剂盒EvaGreen Express 2×qPCR MasterMix-Low Rox 购自ABM公司;Annexin Ⅴ PE/7AAD凋亡检测试剂盒购自美国BD公司;超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)和天门冬氨酸氨基转移酶(AST)的活性测试剂盒购自南京建成科技有限公司;哺乳动物细胞核和细胞质蛋白提取试剂盒购自北京全式金生物公司。重组β-catenin一抗(小鼠源)、转录因子7类似物2(TCF7L2)一抗(兔源)、细胞周期蛋白(Cyclin)D1一抗(兔源)购自美国Abcam公司。内参组蛋白H3抗体(兔源)、β-actin抗体(小鼠源)购自CST。二抗山羊抗兔IgG H&L(HRP)和山羊抗小鼠IgG H&L(HRP)购自ABM公司。实时荧光定量PCR(qPCR)仪(ABI 7500 Fast型)购自美国ABI公司;酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.3方法
1.3.1用于实验的细胞培养 AC16细胞培养条件为DMEM(高糖)培养基+10%FBS+1%双抗,37 ℃,5%CO2,饱和湿度。AC16细胞生长至对数期时用于实验。取生长状态良好、汇合率达90%的细胞消化传代。
1.3.2实验条件筛选 用含不同葡萄糖水平(5、15、25、35、45、55 mmol/L)的培养基培养细胞。采用增殖最快的葡萄糖水平作为正常培养条件的葡萄糖水平,采用增殖受到明显抑制的葡萄糖水平作为高糖培养条件的葡萄糖水平。
1.3.3实验分组 后续实验中,将AC16细胞分为4组进行培养。对照组:在正常培养条件下培养48 h;高糖组:先在正常培养条件培养24 h,再在高糖培养条件下培养48 h;高糖+干扰RNA阴性对照组:使用Lipo3000(1.5 μL/mL)转染阴性对照干扰RNA(100 nmol/L)24 h后,在高糖培养条件下继续培养48 h;高糖+干扰RNA组:使用Lipo3000(1.5 μL/mL)转染干扰RNA 100 nmol/L(干扰RNA的靶标为lncRNA CCAT2)24 h后,在高糖培养条件下继续培养48 h。
1.3.4干扰RNA的转染 lncRNA CCAT2干扰RNA由3条特异性的小干扰RNA(siRNA)和3条反义寡核苷酸(ASO)组成。转染前1 h接种生长至对数期的AC16细胞于6孔板,接种浓度为3.6×105个/孔,观察细胞生长状态,当细胞生长融合达80%~90%时转染阴性对照干扰RNA、干扰RNA,转染采用瞬时转染。转染24 h后,再在高糖培养条件下培养48 h,收集细胞,用于细胞增殖、凋亡及基因表达等后续检测。
1.3.5CCK8检测细胞增殖 将AC16细胞接种于96孔板(每孔100 μL,5×103个/孔)中,在37 ℃、5%CO2条件下培养24 h。然后,将细胞进行分组培养,按1.3.3中的方法进行处理。处理后,每孔加入100 μL制备的10% CCK8溶液。孵育1 h后,用酶标仪测定其在450 nm处的吸光度(A)值。
1.3.6细胞凋亡检测 处理后,收集AC16细胞,在500 μL 1×结合缓冲液中重新悬浮。将细胞悬液与5 μL Annexin Ⅴ-PE和10 μL 7-AAD试剂在4 ℃下孵育10 min。用流式细胞仪检测细胞凋亡情况。计算凋亡细胞数目的总和(Q2+Q3象限),计算凋亡率。
1.3.7细胞损伤指标检测 细胞分组处理后,收集细胞和细胞培养上清,用相应的试剂盒测定SOD、LDH和AST的活性。
1.3.8qPCR检测lncRNA CCAT2及Wnt/β-catenin通路基因表达水平 按Trizol试剂盒提取操作流程提取细胞RNA,用反转录试剂盒反转录成cDNA。以cDNA为模板,使用ABM公司的基因扩增试剂,采用20 μL的反应体系,进行qPCR检测。反应条件:95 ℃预变性10 min,95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。采用2-ΔΔCt法计算lncRNA CCAT2、β-catenin、TCF7L2、Caspase-3、c-Myc、CyclinD1的相对表达水平。qPCR引物及干扰RNA序列见表1。

表1 qPCR引物及干扰RNA序列
1.3.9Western blot检测Wnt/β-catenin通路相关蛋白表达水平 收集细胞1×106个,冷PBS漂洗2次,1 000×g离心3 min,弃上清。细胞蛋白提取步骤如下,向细胞沉淀中加入1 mL细胞质蛋白提取液Ⅰ,剧烈振荡15 s,冰上孵育10 min,其间每2 min振荡混均1次。加入55 μL 细胞质蛋白提取液Ⅱ,高速涡旋振荡5 s,冰上孵育1 min,4 ℃ 16 000×g离心15 min,小心收集上清(得到细胞质蛋白标本),冰上放置。向沉淀中加入500 μL细胞质蛋白提取液Ⅰ,重悬,高速涡旋振荡5 s,4 ℃ 16 000×g离心5 min,小心弃上清。加入500 μL核蛋白提取液,将沉淀重悬,高速涡旋振荡15 s,冰上孵育30 min,其间每隔5 min高速涡旋振荡15 s。4 ℃ 16 000×g离心10 min,小心收集上清(得到细胞核蛋白标本)。采用BCA法测定蛋白浓度。然后,通过10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,并转移到PVDF膜上。然后,将膜与抗β-catenin、TCF7L2、CyclinD1、内参(组蛋白H3和β-actin)的一抗以及相应的二抗一起孵育。用ECL试剂盒进行显色处理。计算蛋白相对表达水平。
2 结 果
2.1不同水平葡萄糖对AC16细胞增殖的影响 用含不同水平葡萄糖的培养基培养AC16细胞48 h后,检测细胞增殖情况。葡萄糖水平为5 mmol/L和15 mmol/L的培养基中,AC16细胞增殖受到抑制;葡萄糖水平增加到25 mmol/L时,AC16细胞增殖最快;葡萄糖水平增加到35 mmol/L时,细胞增殖开始受到抑制,并且随葡萄糖水平增加抑制程度增加,见图1。CCK8法检测各组细胞的增殖情况:结果与细胞生长形态观察结果一致;葡萄糖水平为25 mmol/L时A值最高,与其他葡萄糖水平A值比较,差异有统计学意义(P<0.05);葡萄糖水平低于25 mmol/L时,A值随葡萄糖水平的增加而增加;葡萄糖水平增加到35、45、55 mmol/L时,A值随葡萄糖水平的增加而逐渐降低。因此,采用增殖最快的葡萄糖水平25 mmol/L作为正常培养条件,采用增殖受到明显抑制的葡萄糖水平55 mmol/L作为高糖培养条件。

图1 不同葡萄糖水平培养AC16细胞生长情况(×100)
2.2lncRNA CCAT2在高糖培养条件下的AC16细胞中表达上调 qPCR检测lncRNA CCAT2的表达,与对照组比较,高糖组和高糖+干扰RNA阴性对照组的lncRNA CCAT2的表达上调(P<0.05)。与高糖组和高糖+干扰RNA阴性对照组相比,高糖+干扰RNA组lncRNA CCAT2的表达降低(P<0.05)。见图2。lncRNA CCAT2特异性干扰RNA能有效抑制lncRNA CCAT2的表达。
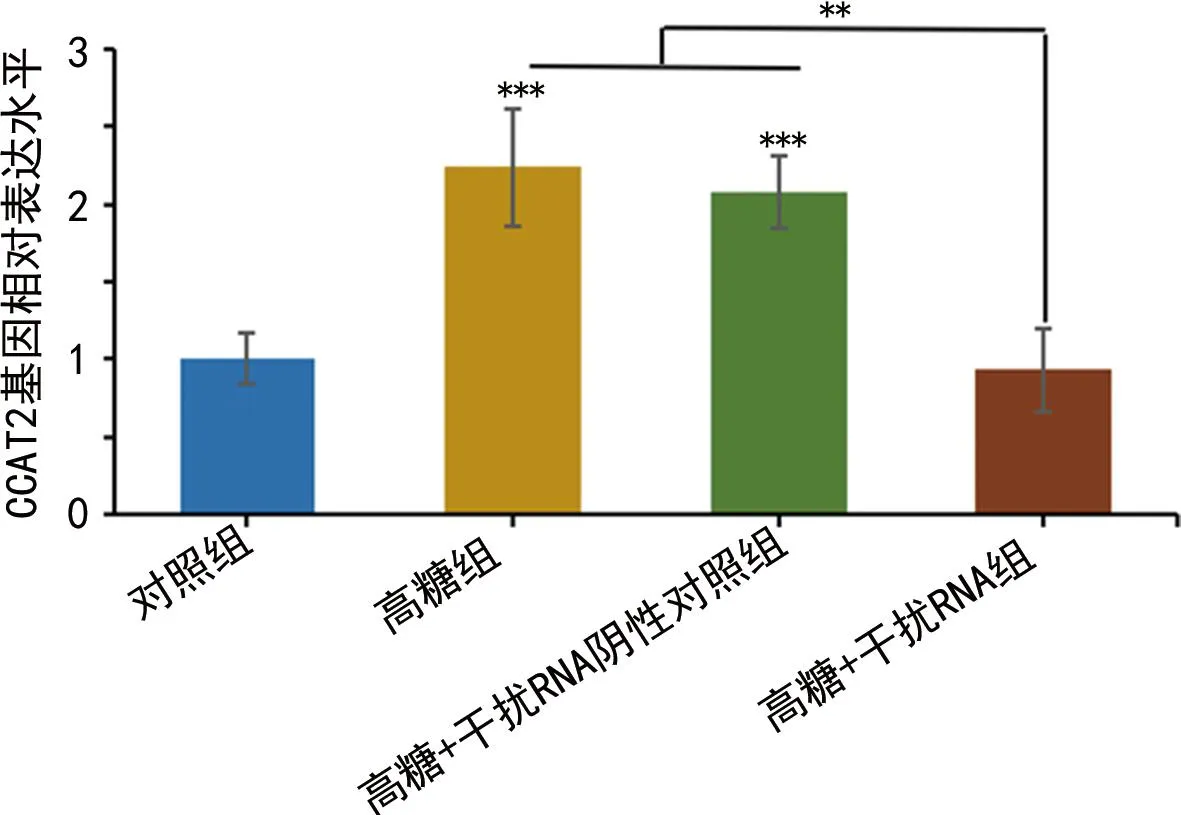
注:与对照组或高糖+干扰RNA组(星号标于连线上方)比较,**P<0.01,***P<0.001。
2.3下调lncRNA CCAT2可提高AC16细胞增殖能力 采用CCK8法检测细胞增殖情况。结果显示,与对照组比较,高糖组和高糖+干扰RNA阴性对照组的A值降低(P<0.05);与高糖组和高糖+干扰RNA阴性对照组比较,高糖+干扰RNA组的A值升高(P<0.05)。抑制lncRNA CCAT2表达可以促进高糖条件下AC16细胞的增殖。见图3。

注:A为各组细胞生长形态图(×100);B为CCK8检测各组AC16细胞的A值;与对照组或高糖+干扰RNA组(星号标于连线上方)比较,*P<0.05,**P<0.01。
2.4下调lncRNA CCAT2可抑制AC16细胞损伤和凋亡 与对照组相比,高糖组和高糖+干扰RNA阴性对照组的LDH和AST活性显著升高(P<0.05),而SOD显著降低(P<0.05);高糖+干扰RNA组LDH和AST活性显著低于高糖组(P<0.05),而SOD显著高于高糖组(P<0.05),见图4。采用流式细胞术检测高糖培养条件下,lncRNA CCAT2对AC16细胞凋亡的影响,lncRNA CCAT2特异性干扰RNA会抑制高糖培养条件下的AC16细胞凋亡(P<0.05),见图5。

注:与对照组或高糖+干扰RNA组(星号标于连线上方)比较,*P<0.05,***P<0.001。

注:A为对照组;B为高糖组;C为高糖+干扰RNA阴性对照组;D为高糖+干扰RNA组;E为各组细胞凋亡率比较,细胞凋亡率=凋亡细胞数(Q2+Q3)/细胞总数;与对照组或高糖+干扰RNA组(星号标于连线上方)比较,*P<0.05,**P<0.01,***P<0.001。
2.5lncRNA CCAT2对高糖培养条件下AC16细胞Wnt信号通路的影响 qPCR检测显示,在高糖培养条件下,核内β-catenin mRNA表达显著升高(P<0.05),细胞质中β-catenin mRNA表达显著下降(P<0.05),见图6A。Western blot检测结果显示,细胞质中β-catenin的表达显著下调(P<0.05),而细胞核中的表达显著上调(P<0.05),采用干扰RNA下调lncRNA CCAT2的表达逆转了β-catenin表达的上述变化(P<0.05),见图6B。此外,在高糖培养条件下,lncRNA CCAT2靶基因TCF7L2的mRNA和蛋白表达均显著上调(P<0.05),抑制lncRNA CCAT2的表达后,TCF7L2的表达显著下调(P<0.05),见图6。在高糖条件下,Wnt/β-catenin信号通路被激活,抑制lncRNA CCAT2的表达可以通过β-catenin抑制Wnt/β-catenin信号通路及其下游基因的表达。

注:A为qPCR检测lncRNA CCAT2表达对Wnt信号通路基因表达的影响;B为Western blot检测lncRNA CCAT2对Wnt信号通路蛋白表达的影响;与对照组或高糖+干扰RNA组(星号标于连线上方)比较,*P<0.05,**P<0.01,***P<0.001。
3 讨 论
一些lncRNA通过调节凋亡过程参与DCM的病理生理过程[7]。lncRNA CCAT2是一种新型的lncRNA,位于8号染色体长臂2区4带(8q24),高度保守,由1 752个核苷酸组成,首先在大肠癌中被发现并命名[8]。lncRNA CCAT2除了在结直肠癌,还在卵巢癌、宫颈癌、乳腺癌等其他肿瘤疾病中异常表达,并对肿瘤细胞的增殖、凋亡起调控作用[9]。然而,lncRNA CCAT2在心血管疾病中的研究鲜见报道。本研究发现,在高糖条件下,lncRNA CCAT2在心肌细胞中显著上调,而沉默lncRNA CCAT2可降低心肌细胞的损伤和凋亡。提示lncRNA CCAT2可能是糖代谢异常诱导DCM发病的关键因素。
由于lncRNA CCAT2在调节心肌细胞损伤和凋亡中表现出了重要作用,因此本研究进一步探索了lncRNA CCAT2调控心肌细胞凋亡的机制。已经有研究证实糖尿病患者长期高血糖可诱导心肌细胞凋亡[10]。心肌细胞凋亡导致的细胞损失降低了心脏舒张、收缩功能,并且促进了心脏重塑和心力衰竭[11],参与了DCM的发病过程。典型的Wnt/β-catenin信号通路与心脏重构、心肌梗死、心力衰竭和心律失常的病理过程相关。TCF7L2是Wnt信号通路的一员,位于10q25染色体上,是调节胰腺β细胞增殖的必要分子,参与调节胰岛素的表达、分泌和加工[12]。然而,TCF7L2在不同的组织和细胞中的作用是不同的。例如,TCF7L2在糖尿病小鼠的视网膜神经细胞中高表达,引起内质网应激,进而促进糖尿病视网膜病变[13],而TCF7L2在脂肪细胞中低表达,可导致脂肪细胞和葡萄糖代谢受损[14]。本研究中,高糖培养条件下,人AC16心肌细胞中TCF7L2基因和蛋白的表达显著上调。而沉默lncRNA CCAT2后,其TCF7L2基因和蛋白被下调。这一结果证明TCF7L2在高糖培养条件下的心肌细胞中异常表达,并提示lncRNA CCAT2对TCF7L2有调控作用。
此外,TCF7L2在肠道、肝脏、骨骼肌、胰腺组织和大脑中的Wnt信号通路和葡萄糖代谢的调控中起着关键作用[15]。Wnt/β-catenin信号通路已被证明通过调控下游基因来管理许多不同器官的成体干细胞的胚胎发育和更新,并密切参与了的增殖和凋亡过程[16]。TCF7L2/Wnt/β-catenin通路参与了多种糖代谢疾病,包括糖尿病肾病和糖尿病视网膜病变[17]。已知TCF7L2是肿瘤细胞中Wnt/β-catenin 激活剂[18],但是也有报道证实TCF7L2在脂肪组织中具有拮抗Wnt/β-catenin信号通路的作用[14]。
本研究发现,高糖条件下,Wnt/β-catenin通路被显著激活,而沉默lncRNA CCAT2后,该通路被显著抑制,同时细胞损伤和凋亡减少。因此,在高糖培养条件下,lncRNA CCAT2表达上调,能促进Wnt/β-catenin通路中β-catenin蛋白的核转移,并进一步上调靶基因TCF7L2以及下游细胞周期和凋亡基因的表达。这些最终导致细胞损伤和凋亡增加。值得注意的是,抑制lncRNA CCAT2的表达可以抑制Wnt/β-catenin通路的激活,减轻高糖诱导的细胞损伤和凋亡。
本研究发现,lncRNA CCAT2可通过调控TCF7L2/Wnt/β-catenin信号通路来促进心肌细胞凋亡和损伤,可能是DCM诊断和治疗的潜在生物标志物。研究结果揭示了lncRNA CCAT2在体外DCM模型中对心肌细胞损伤和凋亡的调控机制。在后续研究中,本课题组还将利用DCM的动物模型和临床样本进行实验,以进一步揭示lncRNA CCAT2在DCM中的作用。

