BRAF、TP53、Pax8-PPARγ在甲状腺癌中的表达及疗效预测价值
苏镇军,赵艳春,李 娟,国方娜,温丽莎
河北工程大学附属医院核医学科,河北邯郸 056002
甲状腺癌平均年增长率约6.6%,现已跃居为发病率升高最快的实体肿瘤[1]。手术联合131I是目前治疗甲状腺癌重要手段,可有效延缓病情进展,但其疗效具有较明显个体差异性,部分患者易出现复发、转移,甚至死亡。基因突变、异位及甲基化可刺激肿瘤相关信号通路,诱发甲状腺癌细胞癌变[2-3]。丝氨酸/苏氨酸蛋白激酶(BRAF)可通过刺激BRAF/MEK/ERK信号转导通路参与肿瘤形成,仅在甲状腺癌与甲状腺癌起源的未分化癌中发生突变[4]。肿瘤蛋白P53(TP53)突变影响细胞生长、凋亡、DNA修复,促进肿瘤形成,在甲状腺癌发生、发展中扮演重要角色[5]。配对盒基因8-过氧化物酶体增殖物激活受体γ(Pax8-PPARγ)是配对盒基因编码区染色体2q13断裂点与过氧化物酶体增殖物激活受体γ编码区3q13断裂处融合形成新基因,在甲状腺良恶性结节中均有表达,但关于其在甲状腺癌鉴别及疗效评估中研究报道较少[6]。本研究拟分析TP53、BRAF、Pax8-PPARγ在甲状腺癌中的表达及131I治疗中的价值,以期为临床确定合理诊治方案提供参考,现报道如下。
1 资料与方法
1.1一般资料 将2020年4月至2022年4月本院收治的150例甲状腺癌患者纳入研究,男52例,女98例,年龄20~65岁,平均(49.92±4.41)岁。纳入标准:(1)符合甲状腺癌诊断标准[7],结合细胞病理学检查证实为甲状腺乳头状癌(甲状腺恶性肿瘤中最常见的病理类型);(2)行甲状腺癌根治术且于术后拟行首次131I治疗。排除标准:(1)患其他恶性肿瘤;(2)有其他甲状腺疾病;(3)有严重心脑血管疾病;(4)有凝血功能障碍;(5)临床资料缺失。患者及家属均对本研究知情同意并签署知情同意书。本研究经医院伦理委员会审核批准。
1.2方法
1.2.1组织TP53、BRAF、Pax8-PPARγ表达水平检测 取甲状腺癌组织及癌旁组织约30 mg,采用Trizol法提取总RNA,反转录为cDNA,采用SYBR Green Ⅰ染料行实时荧光定量PCR(qPCR)扩增反应。TP53引物序列为F:5′-TTGCCGTCCCAAGCAATGGATGA-3′,R:5′-TCTGGGAAGGGACA GAAGATGAC-3′;扩增程序为95 ℃ 5 min,95 ℃ 30 s、53 ℃ 30 s、72 ℃ 30 s,共35个循环。BRAF引物序列为F:5′-TCATAATGCTTGCTCTGATAGGA-3′,R:5′-GGCCAAAAATTTAATCAGTGGA-3′;扩增程序为95 ℃ 10 min,95 ℃ 30 s、56 ℃退火30 s、72 ℃ 45 s,共38个循环。Pax8-PPARγ引物序列为F:5′-GTCCGGACTCAGATCTCGAGCTATGCCTCAACAACTCCATCAG-3′,R:5′-GATCCCGGG CCCGCGGTACCGTACAAGTCCTTGTAGATCTC CTG-3′;扩增程序为95 ℃ 10 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 60 s 共30个循环。U6为内参基因,反转录引物序列为5′-CGCTTCACGAATTTGCGTGTCAT-3′。PCR引物序列为F:5′-GCTTCGGCAGCACATATACTAAAAT-3′,R:5′-CGCTTC ACGAATTTGCGTGTCAT-3′。采用2-ΔΔCt法计算TP53、BRAF、Pax8-PPARγ的相对表达水平。Trizol试剂盒由美国Invitrogen公司提供。qPCR检测试剂盒及TP53、BRAF、Pax8-PPARγ引物由广州复能基因有限公司提供。7500荧光定量PCR仪由美国ABI公司提供。
1.2.2采用放射性131Ⅰ清除术后残留的正常甲状腺组织(简称清甲) 治疗前,停服甲状腺激素、低碘饮食4周,待促甲状腺激素(TSH)>30 μIU/mL接受首次131I治疗。术后4周,口服131I(安盛科兴药业有限公司,国药准字H20057721),剂量(350~650)×1010Bq,治疗7 d后服用左甲状腺素钠片(德国默克公司,国药准字H20090234),100 mg/d,结合血浆TSH调整服药剂量,确保临床分期Ⅰ期患者TSH始终低于0.10 mol/L,Ⅱ、Ⅲ期患者TSH维持在0.05~0.10 mol/L。
1.2.3首次清甲成功标准 首次131I治疗后1周进行全身碘扫描及局部断层融合显像检查,无甲状腺残留或放射性浓聚。
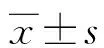
2 结 果
2.1甲状腺癌及癌旁组织TP53、BRAF、Pax8-PPARγ mRNA表达水平比较 甲状腺癌组织TP53、BRAF、Pax8-PPARγ mRNA表达水平高于癌旁组织,差异均有统计学意义(P<0.05)。见表1。
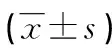
表1 甲状腺癌及癌旁组织TP53、BRAF、Pax8-PPARγ mRNA相对表达水平比较
2.2甲状腺癌患者临床病理因素与TP53、BRAF、Pax8-PPARγ mRNA表达水平的关系 甲状腺癌患者淋巴结转移、肿瘤最大径、包膜浸润均与TP53、BRAF、Pax8-PPARγ mRNA表达水平有关(P<0.05)。见表2。
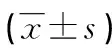
表2 甲状腺癌患者临床病理因素与TP53、BRAF、Pax8-PPARγ mRNA表达水平的关系
2.3清甲成功和失败患者TP53、BRAF、Pax8-PPARγ mRNA表达水平比较 甲状腺癌患者经首次131I治疗后,61例清甲失败,89例清甲成功。清甲失败患者组织TP53、BRAF、Pax8-PPARγ mRNA表达水平均高于清甲成功患者(P<0.05)。见表3。
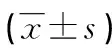
表3 清甲成功和失败患者组织TP53、BRAF、Pax8-PPARγ mRNA相对表达水平比较
2.4ROC曲线分析 将甲状腺癌患者131I治疗的效果作为状态变量(1=清甲失败,0=清甲成功),组织TP53、BRAF、Pax8-PPARγ mRNA表达水平作为检验变量,绘制ROC曲线,结果显示TP53 mRNA、BRAF mRNA、Pax8-PPARγ mRNA、三者联合预测甲状腺癌患者清甲失败的AUC分别为0.726(95%CI:0.647~0.796)、0.822(95%CI:0.752~0.880)、0.743(95%CI:0.666~0.811)、0.916(95%CI:0.860~0.955),其中三者联合的预测价值最高(P<0.05)。见图1。
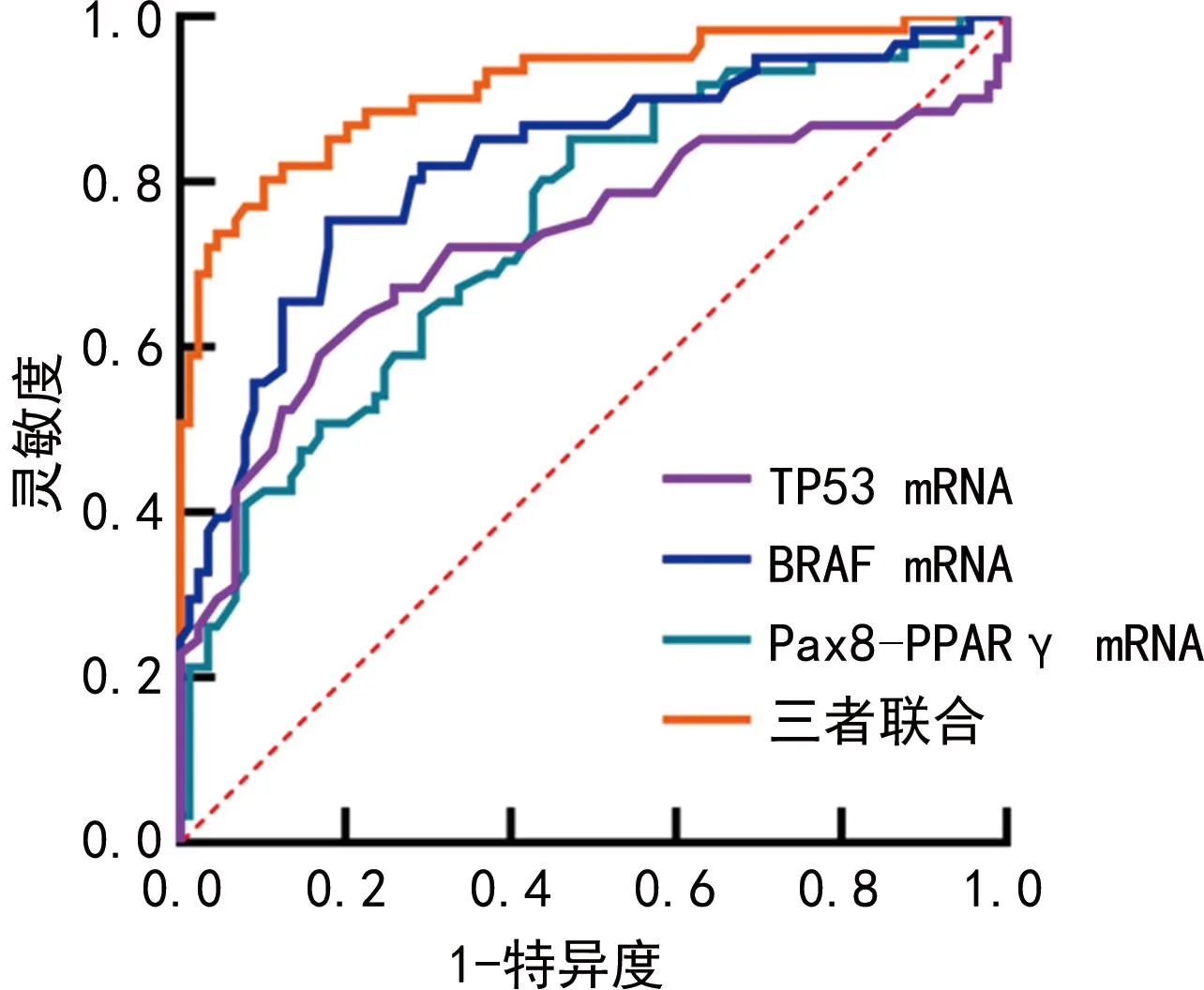
图1 TP53 mRNA、BRAF mRNA、Pax8-PPARγ mRNA单独及联合预测甲状腺癌患者清甲失败的ROC曲线
2.5决策曲线分析 以净收益率为纵坐标,高风险阈值为横坐标,绘制决策曲线,当高风险阈值为0.2~0.9时,三者联合预测甲状腺癌清甲失败的净收益率优于TP53、BRAF、Pax8-PPARγ(P<0.05)。见图2。
3 讨 论
甲状腺肿瘤分子病理学研究取得较大进展,多分子联合检测可在超声引导下细针穿刺细胞学基础上准确划分结节恶性风险,提高甲状腺癌诊断效能,有助于患者预后的改善。Pax8-PPARγ、BRAF、TP53均为甲状腺肿瘤分子病理学研究的热点分子,但上述分子与甲状腺癌疗效的关系研究较少。
Pax8-PPARγ是配对盒基因8(Pax8)与过氧化物酶体增殖物激活受体γ(PPARγ)基因重排融合结果,其中Pax8可通过调控甲状腺球蛋白、甲状腺过氧化物酶表达促进甲状腺细胞分化。PPARγ可调控细胞增殖分化、促细胞凋亡及肿瘤形成,在甲状腺细胞生长、分化、转录过程中发挥关键作用。尽管目前已有Pax8-PPARγ在甲状腺癌中的研究[8],但关于其致癌作用机制尚未完全阐明,本研究发现甲状腺癌组织中Pax8-PPARγ mRNA表达水平高于癌旁组织,Pax8-PPARγ可抑制PPARγ被噻唑烷二酮激活,参与细胞周期调控,增强细胞增殖能力,干扰细胞正常分化,抑制甲状腺特异性基因表达[9]。本研究发现Pax8-PPARγ与淋巴结转移、肿瘤最大径、包膜浸润有关,说明该融合基因表达的患者甲状腺癌恶性程度高,更易出现淋巴结转移、包膜浸润,但上述结果与陈庆毫等[10]的研究结果存在一定差异,考虑与患者异质性、病例数量较少有关,具体原因及机制有待后续研究。既往研究显示,Pax8过表达可抑制甲状腺癌细胞增殖,促进钠/碘转运(NIS)蛋白表达,增强摄碘能力,改善其预后[11]。然而本研究结果显示,清甲失败患者Pax8-PPARγ表达水平高于清甲成功患者,与上述观点相悖,推测原因:Pax8-PPARγ融合基因可影响Pax8、PPARγ功能,随着其表达增加,可促进肿瘤细胞增殖分化,抑制NIS蛋白表达,降低摄碘能力及131I治疗效果。ROC曲线分析显示,Pax8-PPARγ预测甲状腺癌清甲失败AUC为0.743,说明Pax8-PPARγ或许不能作为临床实际工作中的单一预测因子,建议与其他指标联合应用。
BRAF属于特异性较强甲状腺癌基因,BRAF基因突变是甲状腺癌常见基因突变,以第15位外显子上单个碱基因错义突变为主,可引起翻译蛋白600位密码子所对应的缬氨酸由谷氨酸代替,生成活化蛋白激酶,促进甲状腺癌发病[12-13]。动物实验表明,BRAF基因突变可介导小鼠甲状腺细胞转化,诱发甲状腺癌[14]。本研究结果显示,甲状腺癌组织BRAF mRNA表达水平高于癌旁组织,而且与淋巴结转移、肿瘤最大径、包膜浸润密切有关,表明BRAF参与甲状腺癌发生、发展,其过表达可增加酶活性,刺激下游信号通路,促使肿瘤细胞过度增殖、分化,最终导致肿瘤癌变[15]。本研究还发现,清甲失败患者BRAF mRNA水平高于清甲成功患者,其预测甲状腺癌患者清甲失败的AUC为0.822,可为临床学者评估甲状腺癌131I治疗效果提供有利参考依据,有助于后续治疗方案的调整。
TP53突变是指该基因第72位密码存在G/C多态性。既往的研究探讨了TP53基因突变与甲状腺癌关系,但研究结果极具争议性,有学者认为TP53基因突变与甲状腺癌无关[16],有学者则认为TP53基因Arg72Pro位点突变与甲状腺癌密切相关[17],特别是在亚洲人群中。在此背景下,本研究分析了TP53在甲状腺癌患者中的表达,发现甲状腺癌组织TP53 mRNA表达水平高于癌旁组织,其表达水平与包膜浸润、肿瘤最大径等有关。分析原因:TP53基因突变可刺激Wnt-5α信号转导通路,引起细胞增殖特征性变化,进而出现增殖失控,促进肿瘤发生、发展,积极有效治疗显得十分重要[18]。有研究表明,甲状腺癌患者预后大多良好,但仍有10%~15%患者复发,约5%患者对131I治疗无反应,最终死亡[19]。本研究探讨了TP53与甲状腺癌131I治疗效果关系,发现TP53 mRNA预测甲状腺癌患者清甲失败的AUC仅为0.726,可见TP53单独预测甲状腺癌131I治疗效果的价值有限。
由于TP53、BRAF、Pax8-PPARγ mRAN单独预测甲状腺癌131I疗效的价值不高,本研究采用三者联合预测甲状腺癌患者清甲失败的价值,AUC高达0.916,接近于1,提示三者联合预测效能好,可为本病疗效评估提供参考。然而ROC曲线着重关注各检测指标的灵敏度、特异度,针对低灵敏度、高特异度指标,虽具有较大AUC,但在早期筛查中可能会出现假阴性,无法直接代表临床患者受益[20-21]。因此,本研究引入决策曲线,发现三者联合预测甲状腺癌清甲失败发生的净收益率优于单独预测,后续治疗中可通过检测TP53、BRAF、Pax8-PPARγ mRAN表达来预测清甲失败风险,结合具体情况加强治疗强度,提高131I治疗效果。
综上所述,TP53、BRAF、Pax8-PPARγ在甲状腺癌组织中呈高表达,联合检测有助于预测131I治疗效果,为临床确定合理治疗方案及时机提供参考。受限于临床实际,本研究病例源自同一家医院,病例数少,同时三者均突变是否会造成更差预后尚不得知,日后仍需开展多中心、大样本的前瞻性研究。

