HPV DNA负荷量、辅助性T细胞17、FoxP3+调节性T细胞及炎症因子与高危型HPV感染的相关性分析
吴淑霞,李金珠,刘迎光
潍坊医学院附属济南市第五人民医院妇科,山东济南 250022
人乳头瘤病毒(HPV)感染是宫颈癌发生的主要因素,HPV可根据致病能力差异分为低危型和高危型;多项研究表明,持续性高危型HPV16/18感染与宫颈病变发生、进展联系密切[1-3]。HPV DNA检测已由基因分型初筛拓展至更精准的特异性检验,但HPV感染并非宫颈病变的唯一原因,宫颈局部免疫微环境的免疫细胞功能和炎症反应具有高度组织特异性,可通过免疫应答、免疫逃逸等机制促使高危型HPV持续感染、宫颈病变程度加重,故备受关注[4-5]。辅助性T细胞17(Th17)属T淋巴细胞亚群,在肿瘤细胞与机体免疫水平的分析中发挥重要作用;叉头状转录因子3阳性(FoxP3+)调节性T细胞(Treg)参与肿瘤免疫应答整个调控过程,对机体免疫状态十分关键[6-7]。宫颈灌洗液中炎症因子表达异常与宫颈菌群及微环境改变有关,可直观反映宫颈感染状态[8]。本研究分析了HPV DNA负荷量、FoxP3+Treg、Th17及宫颈灌洗液中炎症因子与高危型HPV感染、宫颈病变的相关性,以期为高危型HPV持续感染临床防治提供新的思路。现报道如下。
1 资料与方法
1.1一般资料 将2020年9月至2021年2月本院收治的高危型HPV感染患者100例纳入研究作为研究组,进一步将其中50例高危型HPV16/18阳性患者作为HPV16/18组,50例其他12种高危型阳性患者作为其他亚型组(HPV31、33、35、39、45、51、52、56、58、59、66、68亚型中有一个以上为阳性)。研究组纳入标准:(1)经病理检查确诊为宫颈上皮内瘤变或宫颈癌且均有高危型HPV感染;(2)自身免疫功能正常;(3)近3个月无抗HPV治疗史、性激素用药史、抗感染治疗史;(4)无宫颈手术史、放化疗史。排除标准:(1)内分泌异常;(2)处于哺乳、妊娠状态;(3)伴有结缔组织疾病;(4)存在妇科恶性肿瘤病史;(5)蒙特利尔认知评估异常;(6)存在活动性阴道感染;(7)肝肾功能障碍。另外,选取同期健康体检女性50例作为对照组。研究组和对照组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究符合《赫尔辛基宣言》要求并经本院伦理委员会审批通过。纳入研究者及家属对本研究知情同意,愿意接受本研究相关检测。
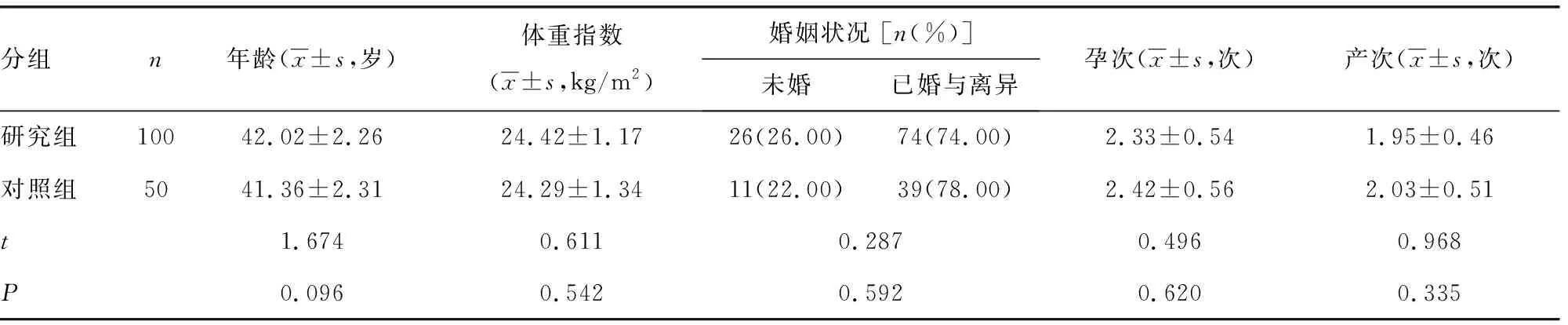
表1 一般资料比较
1.2方法
1.2.1标本采集 检测标本均于纳入研究者经期结束后3 d采集,采用宫颈刷在宫颈口鳞柱交接处逆时针轻微旋转3圈并停留10 s,收集宫颈脱落细胞,置于细胞保存液中送检。
1.2.2液基薄层细胞学检查、HPV检测 将合格标本采用液基薄层制片仪(爱尔兰Cellslide系统)完成制片,进行巴氏染色后阅片。阅片结果包括以下类型:正常细胞、未确定意义的非典型鳞状上皮细胞、宫颈上皮内瘤变Ⅰ级、宫颈上皮内瘤变Ⅱ级、宫颈上皮内瘤变Ⅲ级、鳞状细胞癌。将细胞标本采用苏州华益美生物科技有限公司生产的HPV核酸分型检测试剂盒以PCR-荧光法进行检测,观察检测结果,若可见清晰的蓝紫色圆点为阳性,否则为阴性;根据膜条HPV分型分布图进行亚型区分。
1.2.3HPV DNA负荷量检测 无需阴道冲洗,将所收集的合格标本采用HC-Ⅱ杂交捕获试验试剂盒(美国Digene公司,第2代)进行HPV DNA负荷量检测。
1.2.4Th17检测 采集受试者4 mL肘静脉血,EDTA抗凝,室温静置15 min,离心(1 000 r/min,10 min),取下沉部分的血细胞与磷酸盐缓冲液(PBS)等比例稀释,再加入等体积的人淋巴细胞分离液,离心(1 500 r/min,15 min)吸取分层液云雾层,PBS洗涤后采用RPMI-1640培养液吹打混匀,采用流式细胞仪[厂家:艾森生物(杭州)有限公司,型号:NovoCyte D1040]检测外周血Th17水平。
1.2.5FoxP3+Treg检测 将100 μL血液标本加入100 μL RPMI-1640培养液稀释,将其加入96孔平板,使用离子霉素、丙二醇甲醚醋酸酯及莫能霉素工作液进行混合,在CO2培养箱(5%)中培养5 h,弃上清液,加入10 μL CD4 FITC单克隆抗体。在避光状态下保存15 min,PBS清洗,加入破膜剂,避光放置15 min,PBS再次清洗,采用流式细胞仪检测FoxP3+Treg水平。
1.2.6宫颈灌洗液中炎症因子检测 采用无菌盐水(10 mL)注入宫颈后穹窿灌洗(受试者处于非月经期且3 d内无性生活),收集宫颈灌洗液,采用Luminex多重分析检测宫颈灌洗液中炎症因子白细胞介素(IL)-10、肿瘤坏死因子α(TNF-α)、IL-17A水平。
1.3观察指标 (1)比较研究组和对照组HPV DNA负荷量、Th17、FoxP3+Treg及宫颈灌洗液中炎症因子(IL-10、TNF-α、IL-17A)水平情况。(2)比较HPV16/18组、其他亚型组HPV DNA负荷量、Th17、FoxP3+Treg、炎症因子水平。(3)比较不同宫颈病变(包括宫颈上皮内瘤变Ⅰ级、宫颈上皮内瘤变Ⅱ级、宫颈上皮内瘤变Ⅲ级、宫颈癌)患者HPV DNA负荷量、FoxP3+Treg、Th17及炎症因子水平。(4)分析HPV DNA负荷量、FoxP3+Treg、Th17及炎症因子水平与高危型HPV感染及宫颈病变的相关性。(5)分析HPV DNA负荷量与Th17、FoxP3+Treg及炎症因子的相关性。(6)分析HPV DNA负荷量、Th17、FoxP3+Treg及炎症因子对宫颈病变患者高危型HPV16/18阳性的诊断价值。
2 结 果
2.1研究组和对照组HPV DNA、Th17、FoxP3+Treg及炎症因子水平比较 两组HPV DNA负荷量、Th17、FoxP3+Treg及宫颈灌洗液中IL-10、TNF-α、IL-17A水平比较,差异均有统计学意义(P<0.05)。见表2。
表2 研究组和对照组HPV DNA、Th17、FoxP3+ Treg及炎症因子水平比较
2.2HPV16/18组、其他亚型组HPV DNA、Th17、FoxP3+Treg、炎症因子水平比较 HPV16/18组HPV DNA负荷量、Th17、FoxP3+Treg及宫颈灌洗液中IL-10、TNF-α、IL-17A水平均高于其他亚型组(P<0.05),见表3。
表3 HPV16/18组、其他亚型组HPV DNA、Th17、FoxP3+ Treg、炎症因子水平比较
2.3不同宫颈病变患者HPV DNA、FoxP3+Treg、Th17及炎症因子水平 不同宫颈病变患者HPV DNA负荷量、FoxP3+Treg、Th17及宫颈灌洗液中IL-10、TNF-α、IL-17A水平比较,差异均有统计学意义(P<0.05),见表4。
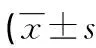
表4 不同宫颈病变患者HPV DNA、FoxP3+ Treg、Th17及炎症因子水平
2.4HPV DNA、FoxP3+Treg、Th17及炎症因子水平与高危型HPV感染、宫颈病变的相关性分析 HPV DNA负荷量、FoxP3+Treg、Th17及宫颈灌洗液中IL-10、TNF-α、IL-17A水平与高危型HPV感染分型(HPV16/18=1,其他亚型=2)均呈负相关(P<0.05),与宫颈病变(宫颈上皮内瘤变Ⅰ级=1,宫颈上皮内瘤变Ⅱ级=2,宫颈上皮内瘤变Ⅲ级=3,宫颈癌=4)均呈正相关(P<0.05),见表5。

表5 相关性分析结果
2.5HPV DNA负荷量与Th17、FoxP3+Treg及炎症因子的相关性分析 HPV DNA负荷量与Th17、FoxP3+Treg及宫颈灌洗液中IL-10、TNF-α、IL-17A水平均呈正相关(r=0.692、0.724、0.605、0.587、0.631,P<0.05)。
2.6HPV DNA负荷量、Th17、FoxP3+Treg及炎症因子诊断宫颈病变患者高危型HPV16/18阳性的ROC曲线分析 以HPV16/18阳性作为阳性样本,其他亚型阳性作为阴性样本,绘制ROC曲线,结果显示,HPV DNA负荷量、Th17、FoxP3+Treg、IL-10、TNF-α、IL-17A单独诊断高危型HPV16/18阳性的曲线下面积(AUC)分别为0.704(95%CI:0.604~0.791)、0.732(95%CI:0.634~0.816)、0.773(95%CI:0.679~0.851)、0.781(95%CI:0.687~0.858)、0.741(95%CI:0.644~0.823)、0.795(95%CI:0.703~0.869)。各项指标联合诊断高危型HPV16/18阳性的AUC为0.911(95%CI:0.837~0.959),大于各指标单独诊断(P<0.05),见图1、2。
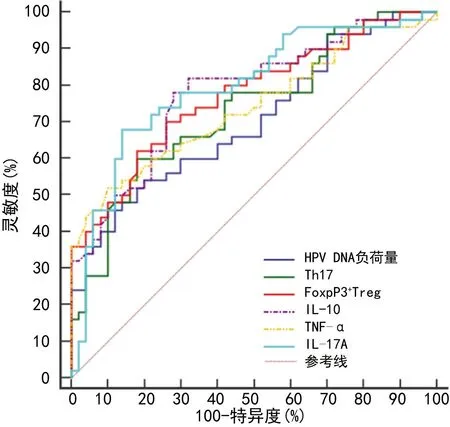
图1 各指标单独诊断高危型HPV16/18阳性的ROC曲线
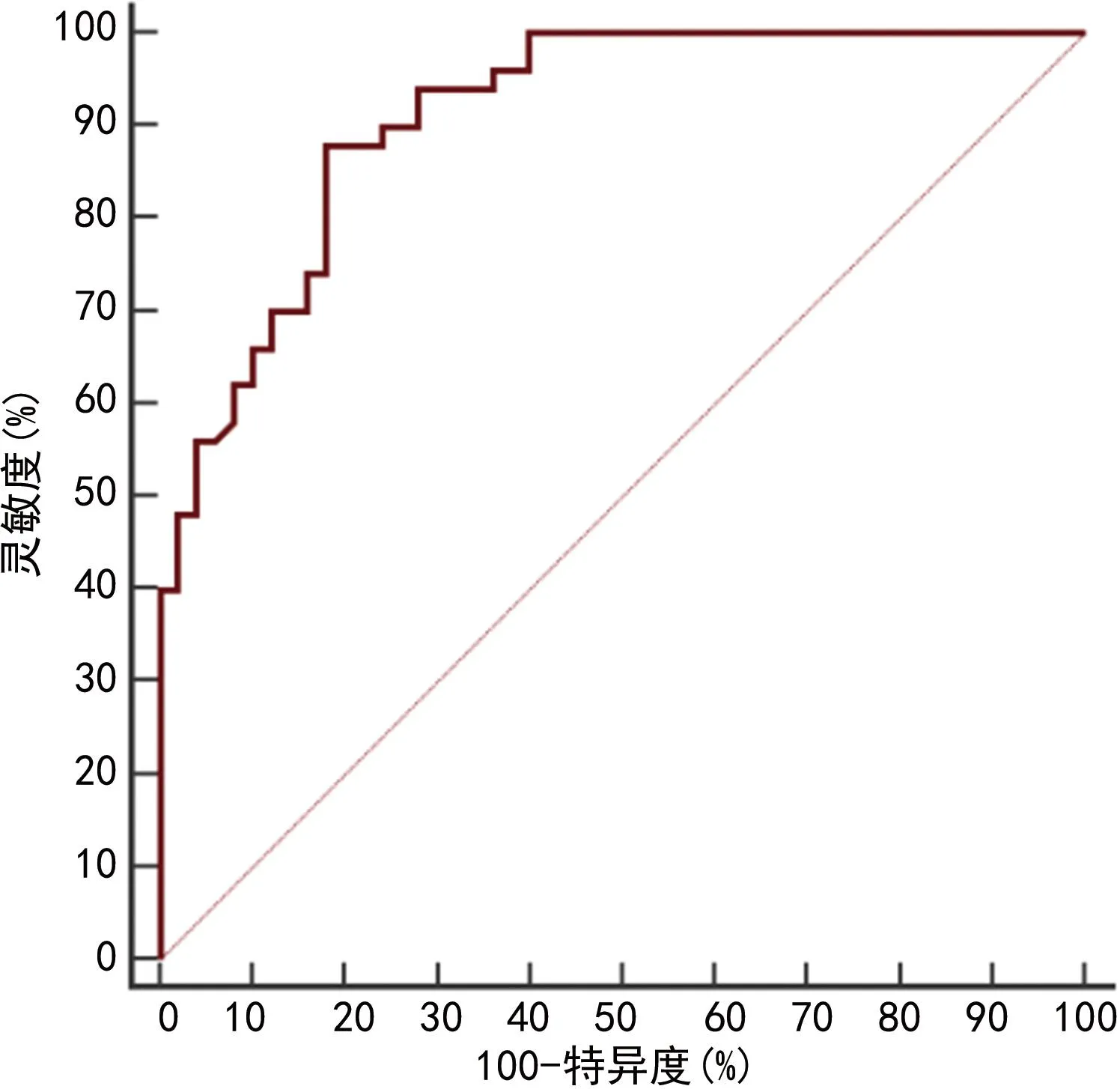
图2 各指标联合诊断高危型HPV16/18阳性的ROC曲线
3 讨 论
高危型HPV持续感染是导致宫颈癌的危险因素,宫颈上皮细胞发生高危型HPV感染后,HPV遗传物质进入宿主细胞的基因组DNA,改变癌基因、抑癌基因表达,激活癌细胞生长、侵袭活性,改变免疫调节基因表达,导致免疫应答紊乱[9-10]。HPV DNA负荷量与宫颈癌、宫颈病变程度的关系尚不十分明确,武振宇等[11]研究显示,HPV DNA单独检测用于宫颈癌诊断的特异度、阳性预测值不足,需HPVE6/E7 mRNA检测辅助诊断。本研究结果显示,HPV DNA负荷量、FoxP3+Treg、Th17及炎症因子水平随宫颈病变程度加深而升高。分析原因:高危型HPV持续感染影响机体免疫耐受,Th17/Treg介导的免疫应答失衡是宫颈病变患者体内重要特征[12]。Treg作为辅助性T细胞亚群发挥机体免疫抑制功能,叉头状转录因子3(FoxP3)是Treg的特征性分子标志,广泛存在于细胞生物中,参与FoxP3+Treg新陈代谢[13-14]。既往研究证实,Treg与多种急慢性病毒感染、肿瘤疾病有关,FoxP3+Treg水平在非小细胞肺癌、乳腺癌、肝细胞癌患者中明显上升[15-17]。有报道指出,Treg可通过抑制T细胞杀伤作用或抑制抗体产生等协助肿瘤免疫逃逸[18]。HPV感染早期,FoxP3+Treg在宫颈病变进展的免疫调节、免疫逃避机制中发挥重要作用[19]。FoxP3+Treg水平升高表示病毒在免疫系统中的逃逸风险升高,可一定程度反映患者预后,对监测肿瘤进展具有指导意义。
陈国艳等[20]的研究表明,宫颈病变患者外周血Th17水平与HPV感染有关,可影响疾病进展。Th17与Treg有同源性,Th17分泌的IL-17可促使癌细胞侵袭,Treg分泌的转化生长因子-β1可以导致抗肿瘤免疫耐受,增加癌细胞免疫逃逸机会[21]。研究组HPV DNA负荷量、Th17、FoxP3+Treg及宫颈灌洗液中IL-10、TNF-α、IL-17A水平均高于对照组,HPV16/18组各项指标水平均高于其他亚型组,表明HPV DNA负荷量、Th17、FoxP3+Treg及炎症因子共同参与了HPV感染发生、进展,影响高危型HPV持续感染情况,分析可能与Th17、FoxP3+Treg异常表达打破机体免疫功能平衡有关。正常状态下Th17、Treg在分化过程中互相影响、共同保持平衡,维持生殖道微生态环境稳态;在宫颈病变过程中,二者平衡被打破,引起免疫功能紊乱[22]。另一方面,局部病灶部位炎症级联反应也可上调Treg水平,导致机体免疫系统紊乱,减弱机体对HPV的杀伤能力,增大持续感染风险[23]。
本研究分析了FoxP3+Treg、Th17及宫颈灌洗液中炎症因子水平分别与HPV感染、宫颈病变的相关性,发现HPV DNA负荷量、FoxP3+Treg、Th17及炎症因子水平与高危型HPV感染分型相关,与宫颈病变类型相关,而且HPV DNA负荷量与Th17、FoxP3+Treg及炎症因子水平呈正相关。ROC分析显示,HPV DNA负荷量、Th17、FoxP3+Treg及宫颈灌洗液中炎症因子对宫颈病变患者高危型HPV16/18感染的诊断价值较高,而且联合预测的AUC达0.911,进一步证实高危型HPV16/18感染与上述指标介导的免疫功能紊乱密切相关,临床可通过检测各项指标来预测、评估宫颈病变患者高危型HPV16/18持续感染情况。
综上所述,HPV DNA、Th17、FoxP3+Treg及炎症因子表达与高危型HPV感染分型、宫颈病变联系密切,HPV DNA负荷量与Th17、FoxP3+Treg、炎症因子具有相关性,各项指标联合检测有利于临床筛查宫颈恶性病变高危患者、防治高危型HPV持续感染,对改善患者预后具有指导意义。

