LINC_00355通过miR-15a-5p调节PHF19在肺癌侵袭转移中的作用机制研究
徐柯楠,刘 静,夏 丽,周 平,杨海龙
衡水市人民医院胸外科,河北衡水 053000
非小细胞肺癌(NSCLC)是导致肺癌的主要危险因素,数据显示其发病率为80%至85%,是全球癌症相关死亡的主要原因之一[1]。手术、化疗、放疗是NSCLC治疗的常规方式。由于耐药和肿瘤转移,NSCLC患者的5年生存率仍然很低,尤其是晚期患者[2-3]。虽然NSCLC的诊断和治疗取得了很大进展,但预后仍然较差。因此,需要确定有效的生物标志物来预测NSCLC的进展和预后,从而推动其他靶向治疗的进展。长链非编码RNA(lncRNA)是一种长度超过200 nt的非编码RNA。lncRNA在癌症的发展过程中充当肿瘤诱导剂或抑制剂,已发现LINC_00355在膀胱移行细胞癌中高表达[4],LINC_00355参与竞争性内源性RNA(ceRNA)网络的调控,并在结直肠癌的多个病理阶段差异表达,先前的研究结果表明LINC_00355在癌症发展中起着至关重要的作用[5]。然而,LINC_00355是否在肺癌的发展中发挥作用仍然未知。lncRNA可以通过竞争性结合microRNA(miRNA)来调控靶基因的表达,研究发现发现LINC_00355在肝癌中高表达,LINC_00355通过与miR-195竞争性结合促进肝癌细胞增殖和集落形成,抑制细胞周期停滞和凋亡[6-7];LINC_00355作为miR-195海绵通过增加同源框A10表达来增强头颈部鳞状细胞癌(HNSCC)细胞的活力、侵袭、迁移和抑制细胞凋亡[8]。本研究拟探讨lncRNALINC_00355在肺癌中的作用,探索LINC_00355通过调节miRNA/mRNA轴参与肺癌的发展的机制,以期为肺癌的发病机制提供理论依据。
1 材料与方法
1.1细胞来源 人NSCLC细胞系A549购自美国典型培养物保藏中心(ATCC)。
1.2仪器与试剂 MTT溶液(默克公司),Annexin V-FITC,碘化丙啶(BioLegend公司),PYr-MirTarget萤光素酶载体(Ambion公司),小鼠单克隆抗人PHF19(1∶1 000,Santa Cruz公司),小鼠单克隆抗人GAPDH(1∶5 000,Santa Cruz公司),HRP缀合的山羊抗小鼠IgG(1∶5 000,Santa Cruz公司),转染试剂HiPerFect Transfection Reagent(Qiagen公司),实时荧光定量PCR(qPCR)检测试剂购自BioRad公司。由上海吉玛制药技术有限公司设计和合成引物。FACScan流式细胞仪(美国BD公司),Eclipse Ti-U倒置显微镜(日本奥林巴斯公司),NanoDrop紫外分光光度计(Thermo Scientific公司),Realplex4 Mastercycler PCR仪(Eppendorf公司),BioRad成像系统(BioRad公司)。
1.3.1细胞培养 所有细胞均在添加了10%胎牛血清(FBS)的Dulbecco改良Eagle培养基中培养,培养环境为37 ℃、5%CO2,根据细胞的生长速度,使用胰蛋白酶-EDTA进行细胞消化后传代。
1.3.2细胞分组及处理 将细胞分为A549肺癌细胞组、lncRNA-NC组、LINC_00355 mimics组、LINC_00355 inhibitor组,进行不同处理后用于后续实验。A549肺癌细胞组:不进行任何处理;lncRNA-NC组:加入空白载体;LINC_00355 mimics组:加入LINC_00355过表达载体;LINC_00355 inhibitor组:加入LINC_00355低表达载体。A549细胞用于转染时,按照试剂说明书使用转染试剂进行瞬时转染。使用qPCR评估转染效率,转染72 h后采用qPCR检测LINC_00355表达,各组设6个平行检测标本,培养72 h。
1.3.3肺癌细胞A549细胞活力的MTT法检测及癌细胞单克隆形成数检测 转染72 h后使用MTT分析细胞细胞活力。将细胞以每孔3 000个细胞的密度接种在96孔板中。维持72 h后,每孔加入20 μL MTT,37 ℃ 孵育4 h。然后,去除培养基,每孔加入150 μL二甲基亚砜(DMSO),摇匀后,使用多孔板读数器在490 nm处测量吸光度(A)值。每个实验一式3份进行5次重复,并计算平均值作为最终结果。测量每个孔的A值。将各组肺癌细胞A549用0.25%胰蛋白酶消化成单细胞,并以4×105细胞个细胞/孔的密度接种到6孔培养板中,24 h后,将50个细胞接种于6孔组织培养板中,继续培养2周。然后将细胞用结晶紫-福尔马林溶液染色10 min并计数。
1.3.4肺癌细胞A549凋亡率测定 转染72 h后收获细胞,将细胞置于6孔板中,密度为4×105个细胞/孔,AnnexinV-FITC(5 μL)和碘化丙啶(PI,10 μL) 处理,采用流式细胞仪进行检测,计算凋亡细胞的百分率。
1.3.5肺癌细胞A549侵袭迁移水平测定 使用包含聚碳酸酯膜的Boyden室进行侵袭测定。培养结束细胞重悬于无血清培养基中,在6孔板(5×104)中孵育24 h(孵育后细胞第2天用一层培养板覆盖)。在室温下孵育24 h后,用200 μL无菌移液器吸头刮擦细胞并用PBS洗涤3次。观察细胞迁移,并使用光学显微镜拍摄图像。
1.3.6萤光素酶报告基因检测 通过生物信息学网站(www.Targetscan.org)检索,初步确定LINC_00355与miR-15a-5p,miR-15a-5p与PHF19是否有潜在的结合位点。为了构建萤光素酶报告载体,通过PCR扩增含有预测的潜在LINC_00355结合位点的miR-15a-5p cDNA片段的3′-UTR,并亚克隆到PYr-MirTarget萤光素酶载体中的萤光素酶基因的下游。萤光素酶活性测定:A549细胞在24孔板中培养,与50 ng含有萤火虫萤光素酶的相应载体以及25 ng LINC_00355或对照共转染。使用Lipofectamine®2000试剂进行转染。在转染后48 h,使用双萤光素酶报告分析系统计算萤光素酶相对活性。
1.3.7双萤光素酶报告基因系统验证靶向调节作用 使用在线StarBase软件(http://starbase.sysu.edu.cn/)预测PHF19的miR-15a-5p 3′UTR区域的结合位点。使用Lipofectamine 2000试剂将上述载体共转染到细胞中。转染24 h后,使用双萤光素酶报告基因系统检测萤光素酶活性,以验证PHF19和miR-15a-5p 3′UTR区域的结合位点。
1.3.8肺癌细胞A549 LINC_00355、miR-15a-5p、PHF19 mRNA表达水平检测 使用TRIzol试剂分离总RNA,进行反转录。使用SYBR®Green Ⅰ Supermix在20 μL的最终反应体积中进行qPCR。所有检测均在iCycler IQ多色检测系统上运行3次,循环参数如下:95 ℃ 10 s,然后94 ℃ 15 s,55 ℃ 30 s,最后70 ℃ 延伸30 s,40个循环。PCR反应体系:5 μL SsoFast EvaGreen Supermix、0.5 μL正向引物(10 μmol/L)、0.5 μL 反向引物(10 μmol/L)和4 μL cDNA。所有定量都以人GAPDH为内参。采用2-ΔΔCt法计算相对表达水平。
在冬小麦的全生育期间,平均气温偏高一点,其降水量也比较多,雨水的分布比较集中。在冬小麦的种植期间,其平均气温为8.3℃,比常年高0.5℃;降水量为243.4 mm,比常年多3.8 mm;日照的时间为2531 h,比去年少126 h。在这期间其极端最高气温为35.7℃,出现在7月19日,极端最低气温为-15.7℃,出现在12月31日。
1.3.9肺癌细胞A549 PHF19蛋白表达水平检测 使用含有蛋白酶抑制剂的RIPA裂解缓冲液从细胞中提取蛋白质,使用BCA蛋白质测定试剂盒测定蛋白质浓度,使用10% SDS-PAGE凝胶分离等量的蛋白质裂解物(每条泳道20 μg),然后电印迹转移到硝酸纤维素膜上,用含有0.1% Tween-20的Tris缓冲盐水中的5%脱脂奶粉封闭膜2 h,并与以下一抗在4 ℃下孵育过夜:小鼠单克隆抗人PHF19抗体(1∶1 000)、小鼠单克隆抗人GAPDH抗体(1∶5 000)。GAPDH用作蛋白质上样的内部对照,将膜与HRP结合的山羊抗小鼠IgG(1∶5 000)在室温下进一步孵育1 h,通过ECL试剂盒检测免疫复合物,条带的整合密度由 Quantity One 软件 (Bio-Rad) 量化。
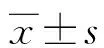
2 结 果
2.1各组细胞A值、存活率比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组A值、存活率升高(P<0.05),LINC_00355 inhibitor组A值、存活率降低(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组A值、存活率降低(P<0.05)。见表1。
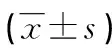
表1 各组细胞A值、存活率比较
2.2各组细胞单克隆形成数的比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组单克隆形成数增加(P<0.05),LINC_00355 inhibitor组单克隆形成数减少(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组单克隆形成数减少(P<0.05)。见表2。

表2 各组细胞单克隆形成数的比较个)
2.3各组细胞凋亡率比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组细胞凋亡率降低(P<0.05),LINC_00355 inhibitor组细胞凋亡率升高(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组细胞凋亡率升高(P<0.05)。见表3、图1。
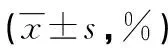
表3 各组细胞凋亡率比较
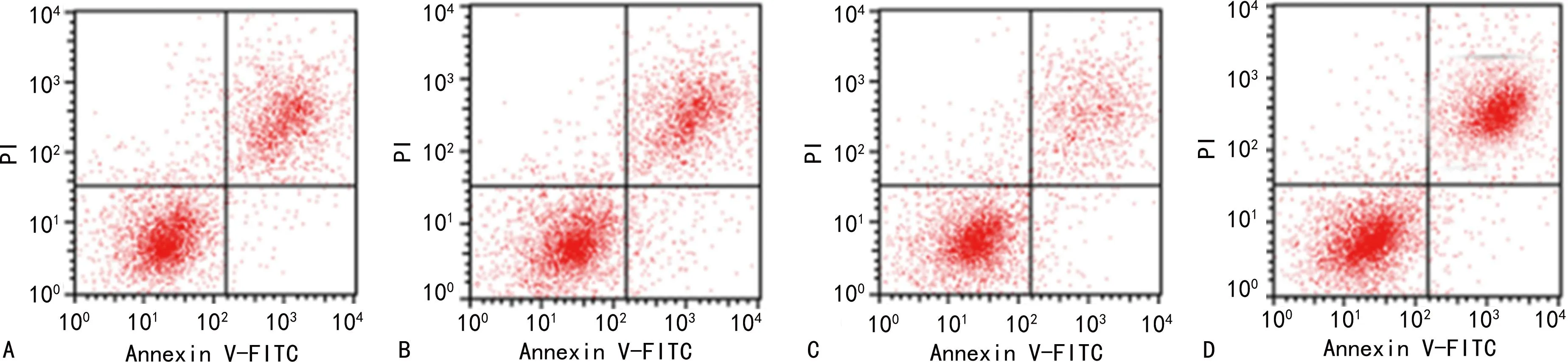
注:A为A549肺癌细胞组;B为lncRNA-NC组;C为LINC_00355 mimics组;D为LINC_00355 inhibitor组。
2.4各组细胞侵袭能力比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组穿膜数增加(P<0.05),LINC_00355 inhibitor组穿膜数减少(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组穿膜数减少(P<0.05)。见表4、图2。

表4 各组A549肺癌细胞穿膜数的比较个)

注:A为A549肺癌细胞组;B为lncRNA-NC组;C为LINC_00355 mimics组;D为LINC_00355 inhibitor组。
2.5各组细胞迁移能力比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组迁移距离增加(P<0.05),LINC_00355 inhibitor组迁移距离缩短(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组迁移距离缩短(P<0.05)。见表5、图3。
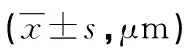
表5 各组A549肺癌细胞迁移能力的比较

注:A为A549肺癌细胞组;B为lncRNA-NC组;C为LINC_00355 mimics组;D为LINC_00355 inhibitor组。
2.6LINC_00355对miR-15a-5p的靶向调节作用 通过生物信息学网站(www.Targetscan.org)检索发现,LINC_00355与miR-15a-5p有潜在的结合位点;萤光素酶报告基因实验显示,LINC_00355过表达可降低miR-15a-5p-wt(wt表示野生型)的荧光素酶活性(P<0.05),LINC_00355低表达可提高miR-15a-5p-wt的荧光素酶活性(P<0.05);LINC_00355过表达或低表达对miR-15a-5p-mut(mut表示突变型)均无有影响,差异均无统计学意义(P>0.05)。表明LINC_00355与miR-15a-5p存在靶向调节作用。见表6、图4。
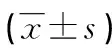
表6 萤光素酶报告基因实验验证LINC_00355对miR-15a-5p的靶向调节作用

图4 Targetscan网站预测LINC_00355与miR-15a-5p的互补配对序列
2.7miR-15a-5p对PHF19的靶向调节作用 通过生物信息学网站(www.Targetscan.org)检索发现,miR-15a-5p与PHF19有潜在的结合位点;萤光素酶报告基因实验显示,miR-15a-5p过表达可降低PHF19-wt的荧光素酶活性(P<0.05),miR-15a-5p低表达可明显提升PHF19-wt的荧光素酶活性(P<0.05);miR-15a-5p过表达或低表达对PHF19-mut没有影响,差异无统计学意义(P<0.05)。表明miR-27a-3p与PHF19存在靶向调节作用。见表7、图5。
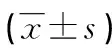
表7 萤光素酶报告基因实验验证miR-15a-5p对PHF19的靶向调节作用

图5 Targetscan预测miR-15a-5p与PHF19 mRNA>的互补配对系列
2.8各组A549肺癌细胞LINC_00355、miR-15a-5p、PHF19表达水平比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组细胞LINC_00355、PHF19 mRNA表达上调(P<0.05),miR-15a-5p表达降低(P<0.05),LINC_00355 inhibitor组细胞LINC_00355、PHF19 mRNA表达降低(P<0.05),miR-15a-5p表达升高(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组细胞LINC_00355、PHF19 mRNA表达降低(P<0.05),miR-15a-5p表达升高(P<0.05)。见表8。
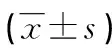
表8 各组细胞LINC_00355、miR-15a-5p mRNA相对表达水平比较
2.9各组细胞PHF19蛋白表达水平比较 与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组细胞PHF19蛋白表达上调(P<0.05),LINC_00355 inhibitor组细胞PHF19蛋白表达降低(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组细胞PHF19蛋白表达降低(P<0.05)。见表9、图6。
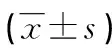
表9 各组细胞PHF19蛋白表达水平比较
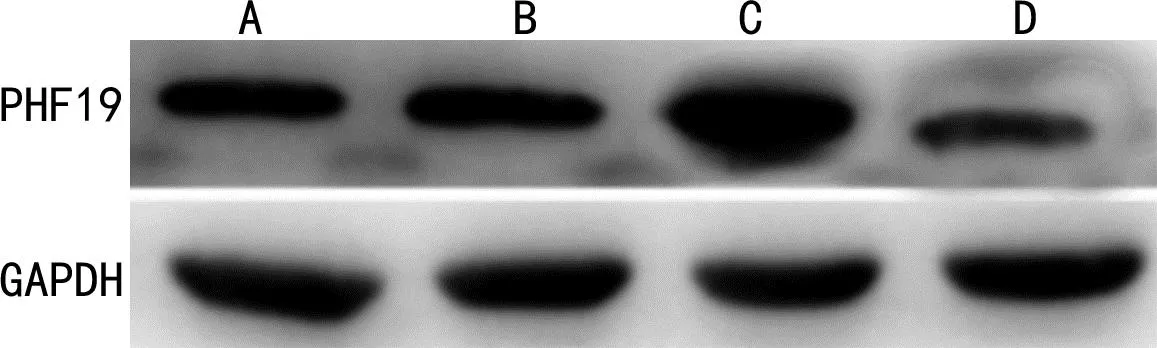
注:A为A549肺癌细胞组;B为lncRNA-NC组;C为LINC_00355 mimics组;D为LINC_00355 inhibitor组。
3 讨 论
本研究首次探讨了LINC_00355在肺癌发展中的作用及其潜在机制,证明了LINC_00355过表达促进肺癌细胞的增殖、迁移和侵袭并诱导细胞凋亡,敲低LINC_00355则出现相反的效果;LINC_00355通过竞争性抑制miR-15a-5p的结合来增加PHF19的表达,PHF19被确定为肺癌发展的促进者。因此,本研究表明LINC_00355可能通过抑制miR-15a-5p表达进而诱导PHF19表达来促进肺癌的发展。
研究表明,lncRNA在调节细胞过程中起着至关重要的作用,包括细胞周期、生长和细胞凋亡。lncRNA在转录或转录后水平的变化直接或间接导致不受控制的肿瘤生长。临床研究显示,LINC_00355与结直肠癌的临床特征相关,与生存率呈负相关[9];此外,LINC_00355在前列腺癌中高表达,并且与癌症患者的存活率相关;在胃癌组织和细胞中也观察到高表达的LINC_00355,表明LINC_00355可能在胃癌的发生发展中起到促进作用[10-11]。本研究结果表明,与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组A值、细胞活力、单克隆形成数、穿膜数、迁移距离增加,凋亡率降低,差异均有统计学意义(P<0.05);LINC_00355 inhibitor组A值、细胞活力、单克隆形成数、穿膜数、迁移距离减少,凋亡率升高,差异均有统计学意义(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组A值、细胞活力、单克隆形成数、穿膜数、迁移距离减少,凋亡率升高,差异均有统计学意义(P<0.05)。这表明,LINC_00355过表达促进肺癌细胞的增殖、迁移和侵袭并诱导细胞凋亡,敲低LINC_00355则出现相反的效果。相关研究显示,LINC_00355抑制还可改善其他癌症的恶性表型,例如,LINC_00355敲低抑制了膀胱癌细胞的增殖和侵袭;LINC_00355的下调抑制了HNSCC中癌症干细胞的活力、侵袭、迁移和上皮-间质转化,并促进了肿瘤干细胞的凋亡[12]。这些研究与本研究结果一致。
miR-15a-5p在多种癌症的发展中发挥负调节作用,包括胃癌、膀胱癌和宫颈癌。具体而言,miR-15a-5p在胃癌中的表达患者显著减少,miR-15a-5p过表达抑制了胃癌细胞增殖和肿瘤侵袭;证明miR-15a-5p下调与晚期肿瘤分级和转移有关[13-14]。生物信息学分析表明LINC_00355与miR-15a-5p之间存在结合位点,双萤光素酶报告基因检测证实了这一点。单个lncRNA通常通过吸收多个miRNA在癌症中发挥作用。例如,LINC_00355通过结合miR-195促进HNSCC进展;在肝细胞癌(HCC)中,LINC_00355作为ceRNA海绵化miR-6777-3p并进一步促进HCC进展[15];这些发现表明LINC_00355通过多种途径调节癌症发展并突出了LINC_00355在癌症进展中的重要作用。本研究证明LINC_00355通过负调控miR-15a-5p促进肺癌进展,表明LINC_00355/miR-15a-5p轴可能是LINC_00355调控肺癌发展的方式之一。
PHF19是多梳状蛋白的成员,可以调节多梳抑制复合物2(PRC2)的酶活性和募集。PHF19表达的失调与多种癌症的发展有关。先前的研究发现PHF19表达与胶质母细胞瘤进展呈正相关;PHF19沉默减少了卵巢癌细胞的增殖,并诱导细胞凋亡和细胞周期停滞;此外,PHF19的过表达与胃癌患者的紫杉醇耐药性相关[16-17];此外,最近的一项研究表明,PHF19的下调可以抑制胃癌细胞的增殖和迁移[18]。这些该研究结果突出了PHF19在癌症发展中的正向调节作用。本研究结果显示:与A549肺癌细胞组、lncRNA-NC组比较,LINC_00355 mimics组细胞LINC_00355、PHF19 mRNA升高,miR-15a-5p降低,差异均有统计学意义(P<0.05),LINC_00355 inhibitor组细胞LINC_00355、PHF19 mRNA和蛋白降低,miR-15a-5p升高,差异均有统计学意义(P<0.05);与LINC_00355 mimics组比较,LINC_00355 inhibitor组单细胞LINC_00355 mRNA、PHF19 mRNA和蛋白降低,miR-15a-5p升高,差异均有统计学意义(P<0.05)。这说明LINC_00355负调控miR-15a-5p上调肺癌细胞中PHF19的表达。
综上所述,LINC_00355过表达促进肺癌细胞的增殖、迁移和侵袭并诱导细胞凋亡,敲低LINC_00355则出现相反的效果;其机制可能与LINC_00355负调控miR-15a-5p进而上调肺癌细胞中PHF19的表达有关。

