薯蓣皂苷调控miR-146a表达抑制高糖诱导的大鼠视网膜血管内皮细胞损伤机制研究
吴贵福 董春萍 高珊 李辉
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病初期的微血管并发症,已成为主要的致盲性疾病之一。DR的发病机制尚不十分明确,一般认为高血糖是引起糖尿病患者视网膜损伤的重要因素[1],细胞凋亡和氧化应激贯穿DR发病的过程。流行病学调查显示,我国糖尿病患者居全球首位,DR发病呈增长趋势,严重影响患者视力健康[2]。DR治疗方法或手段较多,西药治疗存在一定的局限性,不能从根本上治愈DR。由于中草药具有低毒、不良反应少等优点,中医疗疗法在DR的治疗中得到广泛应用[3]。薯蓣皂苷是中药穿山龙的有效成分,具有抗炎、镇痛、调节免疫等作用,其对糖尿病周围神经病变的防治作用也日益受到关注[4]。研究表明,薯蓣皂苷可增强糖尿病合并颈动脉粥样硬化患者血清SOD、GSH-Px等抗氧化酶的活性,清除血液及组织中的氧自由基及MDA,防止血管内皮的氧化损伤[5]。薯蓣皂苷可提高氧化低密度脂蛋白诱导的血管内皮细胞eNOS表达,促进NO的合成与释放,从而降低血管内皮细胞的凋亡[6]。微小RNA(micro RNA,miRNA)是一类长度为18~25个核苷酸的小分子非编码RNA,参与多种疾病的发生、发展。研究表明,miR-146a在糖尿病周围神经病变患者外周血中的含量降低,且miR-146a低表达与患者的病情严重程度密切相关[7]。miR-146a在DR患者血清中表达降低,NF-κB和VEGF明显增加,miR-146a可能通过介导炎症反应和血管增生参与DR的发病过程[8]。目前,薯蓣皂苷和miR-146a对高糖诱导的大鼠视网膜血管内皮细胞(RRVEC)损伤的影响,以及薯蓣皂苷是否通过调控miR-146a影响大鼠RRVEC损伤还未见报道。本研究主要探讨了薯蓣皂苷对高糖诱导的大鼠视网膜血管内皮细胞损伤的影响及作用机制,以期为DR的治疗提供新的作用靶点和新型药物的开发提供一定的理论依据。
1 材料与方法
1.1 实验试剂 清洁级SD大鼠,北京维通利华实验动物技术有限公司,合格证号:SCXR(京)2015-005。薯蓣皂苷粉由国家天然药物研究中心提供,纯度为98%;胎牛血清(FBS)和L-DMEM培养基美国Gibico公司;荧光(Cy3)标记羊抗兔IgG购自武汉博士德生物有限公司;Trizol试剂、反转录试剂盒和PCR试剂盒购自Invitrogen公司;引物序列由宝生物工程(大连)有限公司 提供;BCA蛋白测定试剂盒购自碧云天公司;Bcl-2、Bax和Cleaved-caspase-3以及内参GAPDH抗体购自美国Santa Cruz公司;ROS、SOD和MDA试剂盒均购自南京建成生物工程研究所;LipofectamineTM2000试剂盒购自上海瓦兰生物科技有限公司。
1.2 实验方法
1.2.1 RRVEC细胞培养和鉴定:参照文献方法分离培养RRVEC细胞[9]。SD大鼠腹腔注射10%水合氯醛麻醉,脱颈椎处死,头部常规消毒,取出完整眼球。75%酒精消毒30 s,加入预冷的含200 U/ml青霉素和链霉素的PBS冲洗,去除血污。然后置于含预冷的PBS纱布的培养皿中,获取视网膜组织,剪碎,加入培养液进行培养。视网膜组织加入0.1% Ⅰ型胶原酶溶液37℃消化0.5 h,网孔为100 μm的两层不锈钢细胞滤网过滤。收集洗脱液,室温离心(1 500 r/min、5 min)。弃上清液,沉淀加入含肝素钠和胎牛血清的改良培养基,置于37℃、5%CO2培养箱中培养。取第4代RRVEC细胞,以1×104个/ml接种于涂有明胶的盖玻片上,培养24 h。细胞贴壁后,取出盖玻片,免疫细胞荧光染色法鉴定RRVEC细胞。以PBS代替一抗作为阴性对照组,加入Cy3二抗工作液,37℃孵育显色,荧光显微镜观察。阳性表达时Cy3发出红色荧光。
1.2.2 RRVEC细胞分组:对数生长期的RRVEC细胞,以1×105个/ml浓度接种于6孔板中,每孔1 ml,贴壁后分组处理。实验设置5个组,对照组:含10%FBS的L-DMEM培养基培养24 h;高糖组:含25 mmol/L葡萄糖、10%FBS的L-DMEM培养基培养24 h;高糖+薯蓣皂苷-低组:含25 mmol/L葡萄糖、4.8μg/ml薯蓣皂苷[6]、10%FBS的L-DMEM培养基共同培养24 h;高糖+薯蓣皂苷-中组:含25 mmol/L葡萄糖、12 μg/ml薯蓣皂苷、10%FBS的L-DMEM培养基共同培养24 h;高糖+薯蓣皂苷-高组:含25 mmol/L葡萄糖、30 μg/ml 薯蓣皂苷、10%FBS的L-DMEM培养基共同培养24 h。培养结束后,收集各组细胞用于后续实验。
1.2.3 细胞转染:对数生长期的RRVEC细胞,以1×105/ml浓度接种于6孔板中,每孔1 ml。待细胞融合至60%时,利用LipofectamineTM2000参照其说明进行转染,分别转染miR-NC、miR-miR-146a,细胞分为miR-NC组和miR-146a组。培养6 h后,更换培养基,继续培养48 h后收集细胞用于后续实验。
1.2.4 流式细胞仪检测细胞凋亡:取分组处理后的细胞,PBS清洗后重悬并计数。取5×104~1×105个重悬细胞,1 000 r/min离心5 min,弃上清,加入195 μl Annexin V-FITC 结合液重悬,再加入5 μl Annexin V-FITC,混合均匀,室温避光反应10 min,1 000 r/min离心5 min,弃上清。再加入190 μl Annexin V-FITC 结合液重悬,10 μl碘化丙啶染色液,4℃避光孵育60 min后上机检测,Expo32软件分析,计算细胞凋亡率。
1.2.5 Western Blot法检测蛋白表达:取分组处理后的细胞,加入蛋白裂解液置于冰上充分裂解,4℃、12 000 r/min离心10 min。收集上清液,BCA法测定蛋白含量。取适量蛋白质,加入上样缓冲液,煮沸5 min,进行SDS-电泳。电泳结束后,将分离的蛋白转移至PVDF膜,室温条件下5%脱脂牛奶封闭2 h。TBST洗膜后,加入一抗,4℃孵育过夜。TBST洗膜,加入二抗,室温孵育1 h。TBST洗膜后,滴加ECL显影液。曝光拍照,BandScan分析条带灰度值。以GAPDH为内参,目的蛋白与GAPDH条带灰度值的比值表示目的蛋白的相对表达水平。
1.2.6 细胞ROS、SOD和MDA水平检测:取分组处理后的细胞,参照文献方法[9],采用流式细胞仪检测细胞中ROS相对含量。酶联免疫吸附法检测细胞中SOD活力和MDA含量,操作过程严格参照试剂盒说明书进行。
1.2.7 qRT-PCR检测miR-146a表达:取分组处理后的细胞,Trizol试剂提取总RNA,反转录试剂盒将RNA反转录为cDNA。以cDNA为模板,进行PCR扩增。miR-146a上游引物序列5’-TGAGAACTGAATTCCATGGGTTA-3’,下游引物序列 5’-TGAGAACTGAATTCCATAGGCTA-3’;U6上游引物序列,5’-ATTGGAACGATACAGAGAAGATT-3’,下游引物序列5’-GGAACGCTTCACGAATTTG-3’。扩增条件为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸30 s,共进行40个循环。以U6为内参,采用 2-ΔΔCt法计算miR-146a的相对表达水平。

2 结果
2.1 薯蓣皂苷对高糖诱导的RRVEC凋亡的影响 流式细胞仪检测薯蓣皂苷对高糖诱导的RRVEC细胞凋亡的影响,高糖组RRVEC细胞凋亡率明显高于对照组(P<0.05)。与高糖组比,薯蓣皂苷干预后,RRVEC细胞凋亡率明显降低(P<0.05),并且不同浓度薯蓣皂苷组间比较差异显著(P<0.05)。Western Blot进一步检测凋亡相关蛋白Bcl-2、Bax和Cleaved-caspase-3表达,结果显示,与对照组比,高糖组Bcl-2蛋白水平明显降低(P<0.05),Bax和Cleaved-caspase-3蛋白水平明显升高(P<0.05)。与高糖组比,薯蓣皂苷干预后,RRVEC细胞Bcl-2蛋白水平明显升高(P<0.05),Bax和Cleaved-caspase-3蛋白水平明显降低(P<0.05),且不同浓度薯蓣皂苷组间比较差异显著(P<0.05),说明薯蓣皂苷干预能促进高糖诱导的RRVEC细胞Bcl-2蛋白表达,抑制Bax和Cleaved-caspase-3蛋白表达。见图1、2,表1。

图1 凋亡相关蛋白表达

图2 薯蓣皂苷对高糖诱导的RRVEC凋亡的影响,细胞凋亡流式图
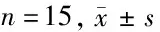
表1 薯蓣皂苷对高糖诱导的RRVEC凋亡的影响
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+薯蓣皂苷-低组组比较,△P<0.05;与高糖+薯蓣皂苷-中组比较,☆P<0.05
2.2 薯蓣皂苷对高糖诱导的RRVEC中ROS水平、SOD活性、MDA含量的影响 流式细胞仪检测RRVEC细胞中ROS相对含量,酶联免疫吸附法检测SOD活性以及MDA含量,高糖组RRVEC细胞中ROS水平和MDA含量明显高于对照组(P<0.05),SOD活性明显低于对照组(P<0.05),而薯蓣皂苷干预后,RRVEC细胞中ROS水平和MDA含量明显低于高糖组(P<0.05),SOD活性明显高于对照组(P<0.05)。见表2。
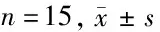
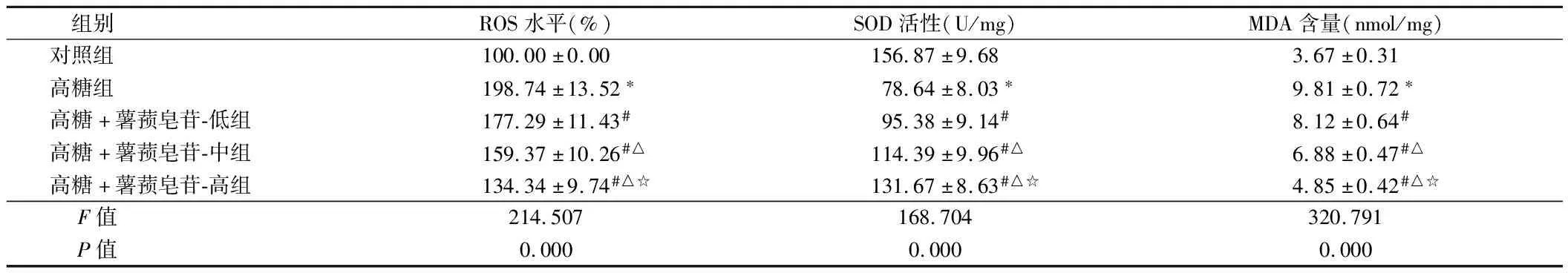
组别ROS水平(%)SOD活性(U/mg)MDA含量(nmol/mg)对照组100.00±0.00156.87±9.683.67±0.31高糖组198.74±13.52∗78.64±8.03∗9.81±0.72∗高糖+薯蓣皂苷-低组177.29±11.43#95.38±9.14#8.12±0.64#高糖+薯蓣皂苷-中组159.37±10.26#△114.39±9.96#△6.88±0.47#△高糖+薯蓣皂苷-高组134.34±9.74#△☆131.67±8.63#△☆4.85±0.42#△☆ F值214.507168.704320.791 P值0.0000.0000.000
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+薯蓣皂苷-低组组比较,△P<0.05;与高糖+薯蓣皂苷-中组比较,☆P<0.05
2.3 薯蓣皂苷对高糖诱导的RRVEC中miR-146a表达的影响 采用qRT-PCR检测RRVEC细胞中miR-146a表达,高糖组miR-146a表达水平明显低于对照组(P<0.05)。与高糖组比,薯蓣皂苷干预后,RRVEC细胞miR-146a表达明显升高(P<0.05),且呈浓度依赖性。见表3。
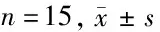
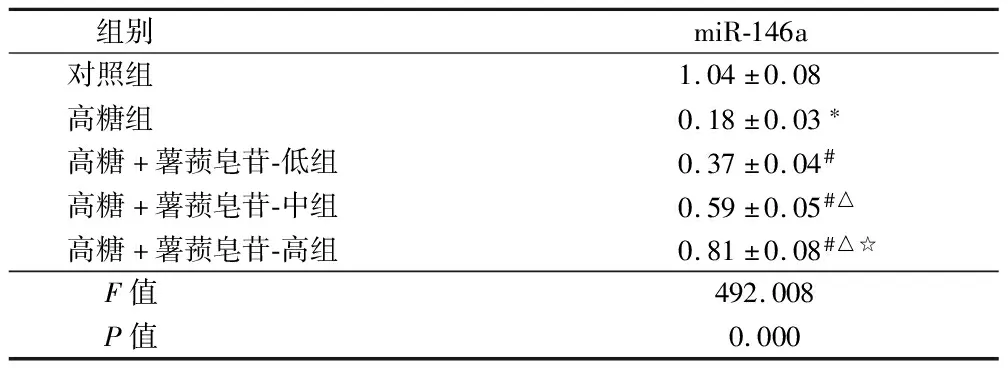
组别miR-146a对照组1.04±0.08高糖组0.18±0.03∗高糖+薯蓣皂苷-低组0.37±0.04#高糖+薯蓣皂苷-中组0.59±0.05#△高糖+薯蓣皂苷-高组0.81±0.08#△☆ F值492.008 P值0.000
注:与对照组比较,*P<0.05;与高糖组比较,#P<0.05;与高糖+薯蓣皂苷-低组组比较,△P<0.05;与高糖+薯蓣皂苷-中组比较,☆P<0.05
2.4 miR-146a过表达对高糖诱导的RRVEC损伤的影响 分别转染miR-NC和miR-146a至高糖诱导后RRVEC细胞,qRT-PCR法检测miR-146a水平验证转染效率,高糖+miR-146a组RRVEC细胞中miR-146a水平明显高于高糖+miR-NC组(P<0.05)。流式细胞仪检测结果显示,高糖+miR-146a组RRVEC细胞凋亡率明显低于高糖+miR-NC组(P<0.05)。Western Blot检测结果显示,与高糖+miR-NC组比,高糖+miR-146a组RRVEC细胞中Bcl-2蛋白水平明显升高(P<0.05),Bax和Cleaved-caspase-3蛋白水平明显降低(P<0.05)。流式细胞仪检测RRVEC细胞中ROS相对含量,酶联免疫吸附法检测MDA含量和SOD活性,结果显示,与高糖+miR-NC组比,高糖+miR-146a组RRVEC细胞中ROS水平和MDA含量明显降低(P<0.05),SOD活性明显提高(P<0.05)。见图3,表4。

图3 凋亡相关蛋白表达

表4 miR-146a过表达对高糖诱导的RRVEC损伤的影响
注:与对照组比较,*P<0.05;与高糖+miR-NC组比较,#P<0.05
2.5 抑制miR-146a表达逆转了薯蓣皂苷(30 μg/ml)对高糖诱导的RRVEC损伤的影响 分别转染anti-miR-NC和anti-miR-146a至高糖诱导后RRVEC细胞,再使用30μg/ml的薯蓣皂苷干预转染后的高糖诱导的RRVEC细胞,qRT-PCR检测miR-146a水平,结果显示,高糖+薯蓣皂苷+anti-miR-146a组RRVEC细胞中miR-146a水平明显低于高糖+薯蓣皂苷+anti-miR-NC组(P<0.05)。流式细胞仪检测结果显示,高糖+薯蓣皂苷+anti-miR-146a组RRVEC细胞凋亡率明显高于高糖+薯蓣皂苷+anti-miR-NC组(P<0.05)。Western Blot检测结果显示,与高糖+薯蓣皂苷+anti-miR-NC组比,高糖+薯蓣皂苷+anti-miR-146a组RRVEC细胞中Bcl-2蛋白水平明显降低(P<0.05),Bax和Cleaved-caspase-3蛋白水平明显升高(P<0.05)。流式细胞仪检测RRVEC细胞中ROS相对含量,酶联免疫吸附法检测MDA含量和SOD活性,结果显示,与高糖+薯蓣皂苷+anti-miR-NC组比,高糖+薯蓣皂苷+anti-miR-146a组RRVEC细胞中ROS水平和MDA含量明显升高(P<0.05),SOD活性明显降低(P<0.05)。见图4,表5。

图4 凋亡相关蛋白表达
3 讨论
细胞凋亡在DR的发生、发展中起重要作用。糖尿病视网膜损伤最早发生在视网膜血管内皮细胞(RRVEC),高血糖代谢紊乱可导致RRVEC细胞凋亡,进而造成无细胞毛细血管结构的出现,以及毛细血管基底膜增厚、微动脉瘤形成等组织病理的改变[10-12]。降低高血糖引起的RRVEC细胞凋亡可能减轻DR,有利于疾病治疗。本研究流式细胞仪检测结果表明,高糖诱导RRVEC细胞后,细胞凋亡率明显升高,与相关报道结果一致,说明高糖能够促进RRVEC细胞凋亡。薯蓣皂苷干预高糖诱导的RRVEC细胞,细胞凋亡率明显降低,且薯蓣皂苷越高,凋亡率越低,说明薯蓣皂苷可剂量依赖性抑制高糖诱导的RRVEC细胞凋亡。Bcl-2是一种抗凋亡蛋白,Bax是一种促凋亡蛋白,两者均在细胞凋亡过程中发挥重要作用[13]。半胱氨酸蛋白酶(Caspase)-3是多种凋亡程序启动的执行者,其通过激活核内核酸酶裂解DNA片段,进而触发凋亡,参与细胞凋亡的发生、发展过程[14]。Western Blot检测结果显示,高糖诱导后,RRVEC细胞中Bcl-2蛋白水平降低,Bax和Cleaved-caspase-3蛋白水平升高,而薯蓣皂苷干预后,高糖诱导的RRVEC细胞中Bcl-2蛋白水平升高,Bax和Cleaved-caspase-3蛋白水平降低,提示薯蓣皂苷可能通过促进RRVEC细胞Bcl-2蛋白表达,抑制Bax和Cleaved-caspase-3蛋白表达降低高糖诱导的RRVEC细胞凋亡。

注:与高糖组比较,*P<0.05;与高糖+薯蓣皂苷+anti-miR-NC组比较,#P<0.05
氧化应激在DR的发病过程中也起关键作用,其可通过多种机制造成RRVEC损伤[15]。拮抗氧化应激引起的RRVEC损伤是早起治疗DR的新手段。大量活性氧自由基(ROS)的产生是氧化应激损伤的机制[16]。ROS可通过改变细胞结构和功能的完整性影响细胞功能[17]。丙二醛(MDA)是脂质过氧化产物之一,其含量高低可间接反映机体受自由基攻击的严重程度[18]。超氧化物歧化酶(SOD)是一种重要的抗氧化酶,其活性高低可反映机体清除ROS的能力[19]。同时,ROS的大量产生也会引起SOD活性的降低。本研究结果显示,高糖诱导后,RRVEC细胞ROS水平和MDA含量升高,SOD活性降低,说明高糖诱导能够引起RRVEC细胞产生氧化应激,损伤细胞。薯蓣皂苷干预高糖诱导的RRVEC细胞,细胞内ROS水平和MDA含量降低,SOD活性升高,并且呈浓度依赖性,提示薯蓣皂苷可能通过降低高糖诱导的RRVEC细胞氧化应激减轻对细胞的损伤。
miR-146a是miR-146家族成员之一,被普遍认为是一个与年龄有关、涉及血管重构过程的标志物[20]。研究表明,miR-146a与DR的关系十分密切。郝义等[21]研究发现,miR-146a在视网膜色素上皮细胞中表达水平降低,miR-146a过表达可抑制VEGF-A mRNA和蛋白表达水平,可能成为视网膜色素上皮细胞衰老的新型分子标记物。本研究qRT-PCR检测结果显示,高糖诱导的RRVEC细胞中miR-146a表达水平明显降低,说明高糖诱导的RRVEC细胞中miR-146a呈低表达,miR-146a可能是治疗DR的新靶点,提示促进RRVEC细胞中miR-146a表达可能有助于该疾病的治疗。通过转染miR-146a至高糖诱导后RRVEC细胞,构建miR-146a过表达的高糖诱导的RRVEC细胞,流式细胞仪检测结果显示,miR-146a过表达可抑制高糖诱导的RRVEC细胞凋亡。Western Blot检测结果显示,miR-146a过表达可促进高糖诱导的RRVEC细胞Bcl-2蛋白表达,抑制Bax和Cleaved-caspase-3蛋白表达。此外,miR-146a过表达还能够降低高糖诱导的RRVEC细胞中ROS水平和MDA含量,提高SOD活性,说明miR-146a过表达可保护高糖诱导的RRVEC细胞氧化损伤。为了进一步明确薯蓣皂苷是否通过调控miR-146a表达对高糖诱导的RRVEC细胞损伤发挥保护作用,qRT-PCR检测检测了薯蓣皂苷干预后高糖诱导的RRVEC细胞中miR-146a水平,结果显示,薯蓣皂苷干预后,高糖诱导的RRVEC细胞miR-146a表达明显升高,提示薯蓣皂苷可能促进高糖诱导的RRVEC细胞miR-146a表达。转染anti-miR-NC和anti-miR-146a至高糖诱导后RRVEC细胞,再用30 μg/ml的薯蓣皂苷干预转染后高糖诱导的RRVEC细胞,结果显示,与高糖+薯蓣皂苷+anti-miR-NC组比,高糖+薯蓣皂苷+anti-miR-146a组RRVEC细胞凋亡率、Bax和Cleaved-caspase-3蛋白水平以及ROS水平和MDA含量明显升高,Bcl-2蛋白水平和SOD活性明显降低,说明miR-146a过表达逆转了薯蓣皂苷对高糖诱导的RRVEC细胞凋亡和氧化应激的影响,提示薯蓣皂苷通过调控miR-146a表达影响高糖诱导的RRVEC细胞损伤。
综上所述,薯蓣皂苷可有效降低高糖诱导的RRVEC细胞凋亡和氧化应激,保护高糖诱导的RRVEC细胞损伤。高糖诱导的RRVEC细胞中miR-146a呈低表达,薯蓣皂苷可能通过促进RRVEC细胞miR-146a表达对高糖诱导的RRVEC细胞发挥保护作用。

