鸡卵转铁蛋白结构与功能的关系
仉 旭,吴子健,吕瑜峰
天津市食品生物技术重点实验室 天津商业大学生物技术与食品科学学院,天津 300134
鸡卵转铁蛋白(hen Ovotransferrin,hOTF),又称卵伴白蛋白[1],是一种非结晶单亚基糖蛋白,存在于鸡蛋卵清中,约占蛋清总蛋白含量的12%~13%,分子量为76Ku,pI 6.0,含有686 个氨基酸残基[2]。hOTF 是转铁蛋白家族中一个重要的成员[3],与Fe3+离子有高度亲和力,并具有抗菌[4]、抗病毒[5,6]、抗氧化[7]、抗肿瘤[8]以及免疫调节等多种活性[9]。本文回顾并总结了前人的研究成果,从分子组成以及空间结构等方面分析讨论该蛋白及其水解产物具有这些生理活性的内在原因。
1 结构与抗菌活性
hOTF 可抑制许多革兰氏阳性或阴性菌的生长,诸如属于革兰氏阳性菌的变形链球菌和蜡样芽孢杆菌,以及属于革兰氏阴性菌的假单胞菌和大肠杆菌;但也有些细菌对hOTF 具有一定的抗性,如革兰氏阴性菌的变形杆菌和克雷伯杆菌等[12,13]。目前对于hOTF 抗菌性原因的研究较为深入,有多方面的解释。

图1 鸡卵转铁蛋白空间结构[10,11]Fig.1 Spacial structure of hOTF
研究者最早提出该蛋白的抗菌机理在于其能够螯合Fe3+离子的分子结构。如图1 所示,天然状态的hOTF 由两个结构相似的球形端瓣(即N 端瓣与C 端瓣)组成,每个端瓣又可分为两个大小相似的子域(N 端瓣含N1 和N2 子域;C 端瓣含C1 和C2 子域),且N1 和N2 子域之间以及C1 和C2 子域之间各形成一个能配位结合Fe3+离子的缝隙(cleft)。未结合Fe3+离子时,裂缝呈开放状;但若在碱性条件下且环境中存在(或)时,位于裂缝处的4 个氨基酸残基(N 端瓣为Asp60、Tyr92、Tyr191和His250;C 端 瓣 为Asp395、Tyr524、Tyr431 和His592)便与(或)共同作用,可紧密地结合Fe3+离子(如图2 所示),形成空间上呈八面体结构的OTF--Fe3+三元复合体[14,15]。天然鸡卵清的pH 值大于7.0,且hOTF 大多为脱辅基状态(即未结合Fe3+离子的状态),因此具有相当强的螯合Fe3+离子能力,且一旦结合则会使Fe3+离子难以逃逸。1978 年Bullen 等人[16]指出hOTF 等转铁蛋白螯合金属离子的作用导致微生物生长环境中的Fe3+离子浓度降低而无法满足菌体生长需要,特别是对于那些必须有Fe3+离子才能生长的细菌;而1981 年Valenti 等人[9]发现离子能够有助于hOTF 对于表皮葡萄球菌、腐生葡萄球菌等微生物的抑制作用,可能也是源于该蛋白螯合Fe3+的原因。
后来随着研究的不断深入,人们逐渐发现[4,13]hOTF 的抗菌性能也并非仅仅因为其捕获并消除微生物生长环境中的Fe3+离子,如:1982 年Valenti 等人[4]的研究表明hOTF 抑制菌株Escherichia coli W1485(E.coli W1485)生长的活性并不只是由于其剥夺了培养基中的Fe3+离子,hOTF 与E.coli W1485菌体细胞直接接触并相互作用也是发挥其抑菌作用的必要条件,且相互接触时间越长,抑制生长的效果也越加明显。1985 年Valenti 等人[17]发现失去结合Fe3+能力的hOTF 全蛋白(即每分子结合两个Fe3+离子的hOTF)比脱辅基的hOTF(即未结合Fe3+离子的hOTF)显示出更强的抗白色念珠菌(C.albicans 3153 serotype A 和C.albicans 3156 serotype B)的性能,且即使培养基中含有游离的Fe3+离子也无法促进C.albicans 的生长。综上,人们认为hOTF 的抗菌活性可能源于更为复杂的机制,还有其它内在原因,如下文所示。
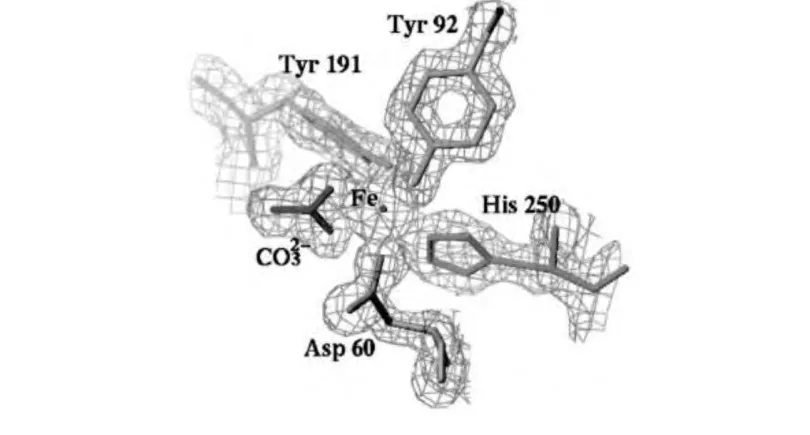
图2 鸡卵转铁蛋白N 端瓣铁离子结合部位结构示意[18]Fig.2 Schematic diagram of the iron-binding site in hOTF N-lobe
hOTF 另一种可能的抗菌机制在于该蛋白含有抗菌残基序列。1998 年Ibrahim 等人[19]报导指出hOTF 对金黄色葡萄球菌、蜡样芽胞杆菌、大肠杆菌等具有抗菌活性,且指出蛋白N 端瓣中的109 位至200 位间的92 个氨基酸残基序列(又称为OTAP-92,Ovotransferrin antimicrobial peptide-92)[9]是其所含的抗菌序列,如图3 所示。

图3 OTAP-92 氨基酸残基序列Fig.3 Amino acid residues sequence of OTAP-92
第三种可能的机制在于:hOTF 可渗透过细菌细胞外膜到达细胞内膜,并引起细胞内膜对各种离子渗透选择性的改变。2003 年Aguilera 等人[20]研究发现,透过大肠杆菌细胞外膜的hOTF 可到达细胞内膜并导致内膜选择性地透过K+离子,而对Na+和H+离子没有作用,结果在未显著改变pH 梯度的情况下,细胞内膜电位显著降低(化学电势从-198mV 下降到-56mV),使原本由电子传递链与氧化呼吸产能的过程解偶联,这种情况虽未直接杀死细菌细胞,但却使细菌停止繁殖。
人们在研究其抗菌活力大小时还发现:结合不同金属离子的三元复合物(OTF--金属离子)具有的抗菌活性大小不同。1987 年Valenti 等人[21]指出螯合Zn2+的hOTF 比螯合其他金属或脱辅基状态的hOTF 具有更强的抗菌活性,可能是由于Zn2+-OTF 复合物具有特殊活性,但该种特殊活性的深层次原因仍有待进一步研究。
2 结构与抗病毒活性
源于鸡蛋卵清的hOTF 及其水解肽段具有抗病毒活性,而该活性与蛋白或肽段的结构以及氨基酸序列、序列的位置具有某种特殊的联系。
首先hOTF 所具有的结构可能对其抗病毒活性具有十分重要的作用。hOTF 与乳铁蛋白(Lactoferrin,Lf)具有49%的同源性[22]以及相似的空间结构(如图1 和图4 所示),Lf 也是由两个类似的端瓣(N 端瓣和C 端瓣)组成,每个端瓣也折叠形成两个大小相近的子域(N 端瓣含N1 和N2 子域;C 端瓣含C1 和C2 子域),且子域间各形成一个Fe3+离子结合位点。人们很早就发现Lf 具有抗病毒活性[23,24],如其可抗单纯疱疹病毒(herpes simplex virus,HSV)1 型和2 型、人类巨细胞病毒(human cytomegalovirus)以及艾滋病毒(human immunodeficiency virus)的性能。后来研究发现hOTF 也同样具有抗病毒的活性,如:2002 年Giansanti 等人[5]的研究显示hOTF 可抗一种禽类疱疹病毒-马雷克病疱疹病毒(Marek's disease virus,MDV),且活性优于牛乳铁蛋白(Bovine Lactoferrin,BLf)和血清转铁蛋白(Serum Transferrin,Trf),同时指出其抗病毒效力与该蛋白本身结合Fe3+离子的程度无关;并推测hOTF 抗MDV 病毒的作用是基于蛋白分子可抑制病毒颗粒对细胞的吸附作用,进而降低细胞的感染率,阻碍病毒繁殖与复制,这种推断与1996 年Marchetti 等人[25]提出的BLf 和人乳铁蛋白(Human Lactoferrin,HLf)抑制HSV-Ⅰ的机理十分相似。

图4 人乳铁蛋白空间结构[10]Fig.4 Spacial structure of human lactoferrin
其次,该蛋白含有具抗病毒活性的肽段。2005年Giansanti 等人[6]研究发现源于hOTF 的两种肽段(如表1 所示)可有效防止MDV 病毒对鸡胚胎纤维母细胞(chicken embryo fibroblasts)的侵染,并分别与源于BLf 的两种抗病毒活性肽段(如表1 所示)具有序列同源性,其中hOTF 219-227 与BLf 222-230都含9 个氨基酸残基,且有6 个氨基酸残基是相同的(即Asp-Gln-Tyr-Glu-Leu-Leu);而hOTF 269-301、hOTF 633-638 与BLf 264-269 都含6 个氨基酸残基,且Asp-Leu 和Lys 所在位置相同。对比后发现hOTF 219-227、hOTF 269-301 和hOTF 633-638 的抗病毒能力是BLf 222-230 和BLf 264-269 的两倍,进一步研究发现这些肽段都分布在各自源蛋白分子的表面,但目前这些肽段所含有的带正电荷氨基酸残基、疏水性氨基酸残基以及肽段长度对于hOTF 和BLf 蛋白的空间构象以及它们所具有的抗病毒活性(包括多肽的抗病毒活性)的作用仍有待进一步研究。

表1 牛乳铁蛋白与鸡卵转铁蛋白抗病毒活性肽段的比较[6]Table 1 Comparison of antiviral activity fragments of bovine lactoferrin and hen ovotransferrin
3 结构与清除自由基、抗氧化活性
hOTF 所具有的清除自由基以及抗氧化性能体现在以下几个方面:首先,天然状态下hOTF 维持着鸡胚发育早期阶段的氧化还原平衡[7,26],并且2007年Ibrahim 等[7]发现hOTF 清除氧自由基的能力和超氧化物歧化酶(SOD)相似,且优于抗坏血酸或血清白蛋白等目前已知的抗氧化剂;其次,Ibrahim等[7]还发现结合了金属离子的hOTF 比脱辅基的hOTF 本身具有更强的清除自由基的能力,其中结合了Cu2+离子的hOTF 清除能力最高,其它依次为Mn2+、Fe3+以及Zn2+;第三,hOTF 两个端瓣(即N-端瓣和C-端瓣)的清除自由基性能也高于完整的hOTF,特别是N 端瓣的作用,可能原因在于其分子内二硫键被还原后所引起的hOTF 结构改变[7],hOTF 是一种对氧化还原环境非常敏感的蛋白,还原条件下(如在二硫苏糖醇等还原剂存在下)会在不同位点自行裂解,并且还原作用会导致蛋白内部产生一些具还原性的自由巯基(甚至引起蛋白内二硫键的重排),这些自由巯基具有极强的清除自由基功能[27];最后,酶解hOTF 得到的产物清除自由基的能力高于hOTF 本身,2013 年Moon 等[28]研究表明经复合蛋白酶(芽孢杆菌蛋白酶复合体)、碱性蛋白酶、胰蛋白酶、中性蛋白酶、风味蛋白酶或木瓜蛋白酶各自水解得到的OTF 酶解产物所具有的清除超氧阴离子活性比完整的hOTF 高出3.2 至13.5倍。
4 结构与抗肿瘤活性
hOTF 及其水解物具有一定的抗肿瘤活性。2009 年Ibrahim 等人研究表明[8]hOTF 在三(2-羰基乙基)磷盐酸盐(tris (2-carboxyethyl)phosphine)还原作用下,肽链上特定的位点(如图5 中箭头所指的位点)发生巯基关联的自我裂解(thiol-linked autocleavage),所产生的肽段能抑制人源乳腺癌细胞系MCF-7(ATCC HTB-22)和人源结肠癌细胞系HCT-116(ATCC CCL-247)的生长,且呈剂量依赖关系,但对正常人源乳腺上皮细胞(normal human mammary epithelial cells)无毒害作用。2013 年Moon等人[28]研究发现hOTF 及其酶解产物(Ovotransferrin enzyme hydrolysates,OTH)可抑制人源肺癌细胞系A549(ATCC CCL-185)、人源胃癌细胞系AGS(ATCC CRL-1739),人源乳腺癌细胞系MCF-7(ATCC HTB-22)、人源肺癌细胞系SK-MES-1(ATCC HTB-58)、人源喉癌细胞系Hep-2(ATCC CCL-23)、人源宫颈癌细胞系HeLa(ATCC CCL-2)以及人源肝母细胞瘤HepG2(ATCC HB-8065)的生长,而且存在剂量依赖关系,特别是40mg/ml 剂量的hOTF 显示出对肿瘤细胞更高的细胞毒性。
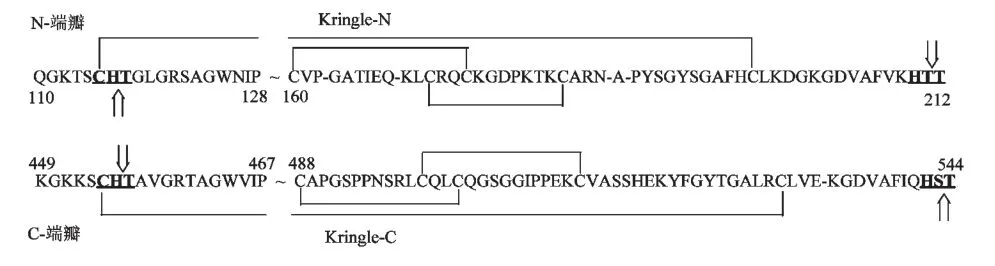
图5 鸡卵转铁蛋白N 端瓣与C 端瓣自动裂解区域氨基酸序列[26]Fig.5 Amino acid sequences of autocleavage regions in the N-and C-lobes of hOTF
hOTF 中有四个较为特殊的三肽模体[26],分别为N-端瓣的CHT(hOTF 115-117)和HTT(hOTF 210-212),以及C-端瓣的HST(hOTF 542-544)和CHT(hOTF 454-456),如图5 所示。2006 年Ibrahim等人[26]研究表明在硫氧还蛋白系统或二硫苏糖醇等还原剂的条件下,hOTF 中这四个三肽模体会发生自动裂解。其中肽段hOTF 115-211 和肽段hOTF 454-544 所含的半胱氨酸残基相对保守,可稳定生成两个典型的Kringle 结构域,即Kringle N 和Kringle C,如图6 所示。而hOTF 及其裂解物抑制肿瘤细胞生长的活性可能正是源于其结构中的Kringle 结构域(Kringle domain)。Kringle 结构域也称为环状结构域,是由3 个二硫键组成的稳定的双环状结构域[29]。同时hOTF 通过自动裂解形成Kringle 结构域的方式与此前已知的纤溶酶原类似,源于牛乳的纤溶酶原在癌细胞分泌的还原酶或其它还原条件下可使自身二硫键还原并自动裂解形成血管生成抑制因子[30],血管生成抑制因子由纤溶酶原的Kringle 1-4 和Kringle 5 结构域组成,早先的研究[31,32]证明,血管生成抑制因子中的这些Kringle 结构域[33,34]可以抑制肿瘤生长,因为其可通过与内皮细胞的受体结合抑制内皮细胞的增殖和迁移,从而抑制肿瘤新生血管的生成,发挥抗肿瘤活性[35]。

图6 鸡卵转铁蛋白中两个Kringle 结构域示意图Fig.6 Schematic diagram of two Kringle domains from hOTF
5 机构与免疫调节活性
鸡卵转铁蛋白(hen egg-white ovotransferrin,hOTF)与鸡血清转铁蛋白(hen serum transferrin,hST)是鸡机体内不同合成场所形成的两种蛋白(hST 在肝脏中合成[5];hOTF 在输卵管中合成[36]),但都是由相同基因编码得到的氨基酸序列相同的蛋白,同样具有两个可以结合Fe3+离子的端瓣以及相似的整体构象,只是蛋白一级结构中糖基化修饰有所差异(hST 糖基位点为Asn52[37];hOTF 糖基位点为Asn473[15]),并且糖基化的差异可能造成了蛋白中两个端瓣的相对取向的不同。在禽类和哺乳类动物还未分化前的侏罗纪时代,转铁蛋白家族成员同时要肩负着Fe3+离子运输和机体防御功能,如今作为进化较先进的哺乳动物,这两种功能分别由Trf与Lf 来承接[5,6],而禽类动物中仍然由hOTF 同时承担。
hST 属于急性期蛋白(acute phase protein,APP)。通常急性期蛋白是一种在炎症、细胞损伤等条件下,由促炎性细胞因子诱导的在肝脏中合成的一类参与急性期反应的蛋白质,具有免疫调节以及修复生理平衡等作用[38,39]。hST 与其他转铁蛋白家族成员同属于先天免疫系统的组成部分,其表达水平会在炎症或疾病期间有所提升,并通过免疫调节作用平衡生物内稳态[9]。2002 年Xie 等人[40]指出,在Escherichia coli(E.coli)、禽痘病毒、呼肠孤病毒、传染性法氏囊病毒以及传染性喉气管炎病毒介导的炎症反应期间,鸡机体内的hST 含量明显提高。同年Xie 等人[41]又利用hST 分别刺激鸡的巨噬细胞(HD-11 细胞)和异嗜性白细胞,均产生了白细胞介素6(interleukin-6,IL-6)、基质金属蛋白酶(matrix metalloproteinases,MMPs),并增强了呼吸爆发活性,引发了异嗜性白细胞的脱颗粒现象,表明hST 具有介导补体启动、促进吞噬作用、产生细胞因子、并清除炎症刺激以及恢复内稳态的作用。1997 年Otani等人[42]研究发现hST 可以抑制由细菌脂多糖(lipopolysaccharide,LPS)和植物凝集素(phytohemagglutinin,PHA)诱导的小鼠脾脏淋巴细胞的增殖,并推测这种抑制增殖的作用与Fe3+饱和度无关,也并非是因为LPS 或PHA 等有丝分裂原的失活,而是淋巴细胞或其辅助细胞与蛋白分子相互作用的结果。Rath 等人[43]2009 年的报导中指出,hST 在鸡血清中的波动水平与炎症以及微生物的应激相关,因此hST 可作为一种生物学标记用于诊断小鸡机体发生的炎症性疾病。
6 总结与展望
目前研究者对于鸡卵转铁蛋白天然存在的结构与其抗菌性能、抗病毒性能等的关系已有较深入的研究,但对于其结构与所具有的抗氧化、抗肿瘤以及免疫调节活性的关系仍需进一步研究,同时卵转铁蛋白作为食源性蛋白,在被人类食用之前要经过一系列加工过程,不同加工方法所引起的结构变化与其功能的关系鲜有报道,也有待深入探讨。
1 Williams J.A comparison of glycopeptides from the ovotransferrin and serum transferrin of the hen.Biochem J,1968,108:57-67.
2 Jeltsch JM,Chambon P.The complete nucleotide sequence of the chicken ovotransferrin mRNA.Eur J Biochem,1982,122:291-295.
3 Mazurier J,et al.Human lactotransferrin:molecular,functional and evolutionary comparisons with human serum transferrin and hen ovotransferrin.Experientia,1983,39:135-141.
4 Valenti P,et al.Antibacterial activity of matrix-bound ovotransferrin.Antimicrob.Agents Chemother,1982,21:840-841.
5 Giansanti F,et al.Antiviral activity of ovotransferrin discloses an evolutionary strategy for the defensive activities of lactoferrin.Biochem Cell Biol,2002,80:125-130.
6 Giansanti F,et al.Antiviral activity of ovotransferrin derived peptides.Biochem Biophys Res Commun,2005,331(1):69-73.
7 Ibrahim HR,et al.Ovotransferrin possesses SOD-like superoxide anion scavenging activity that is promoted by copper and manganese binding.Int J Biol Macromol,2007,41:631-640.
8 Ibrahim HR,Kiyono T.Novel anticancer activity of the autocleaved ovotransferrin against human colon and breast cancer cells.J Agric Food Chem,2009,57:11383-11390.
9 Wu J,Acero-Lopez A.Ovotransferrin:structure,bioactivities,and preparation.Food Res Int,2012,46:480-487.
10 Mizutani K,et al.X-ray structures of transferrins and related proteins.Biochim Biophys Acta (BBA)-General Subjects,2012,1820:203-211.
11 Kurokawa H,et al.Crystal structure of diferric hen ovotransferrin at 2.4 Å resolution.J Mol Biol,1995,254:196-207.
12 Mine Y,Kovacs-Nolan J.New insights in biologically active proteins and peptides derived from hen egg.World Poultry Sci J,2006,62:87-96.
13 Valenti P,et al.Studies of the antimicrobial activity of ovotransferrin.Int J Tissue React,1982,5:97-105.
14 Giansanti F,et al.Physiological roles of ovotransferrin.Biochim.Biophys.Acta (BBA)-General Subjects,2012,1820:218-225.
15 Kurokawa H,et al.Crystal structure of hen apo-ovotransferrin both lobes adopt an open conformation upon loss of iron.J Biol Chem,1999,274:28445-28452.
16 Bullen JJ,et al.Role of iron in bacterial infection.Current topics in microbiology and immunology,Berlin:Springer Berlin Heidelberg,1978,Vol 80,1-30.
17 Valenti P,et al.Antifungal activity of ovotransferrin towards genus Candida.Mycopathologia,1985,89:169-175.
18 Mizutani K,et al.Domain closure mechanism in transferrins:new viewpoints about the hinge structure and motion as deduced from high resolution crystal structures of ovotransferrin N-lobe.J Mol Biol,2001,309:937-947.
19 Ibrahim HR,et al.Identification of a distinct antibacterial domain within the N-lobe of ovotransferrin.Biochim Biophys Acta (BBA)-Molecular Cell Research,1998,1401:289-303.
20 Aguilera O,et al.Transferrins selectively cause ion efflux through bacterial and artificial membranes.FEBS Lett,2003,548:5-10.
21 Valenti P,et al.The effect of saturation with Zn2+and other metal ions on the antibacterial activity of ovotransferrin.Med Microbiol Immun,1987,176:123-130.
22 Metz-Boutigue MH,et al.Human lactotransferrin:amino acid sequence and structural comparisons with other transferrins.Eur J Biochem,1984,145:659-676.
23 Hasegawa K,et al.Inhibition with lactoferrin of in vitro infection with human herpes virus.Jpn Med J,1994,47(2):73-85.
24 Seganti L,et al.Antiviral activity of lactoferrin towards naked viruses.Biometals,2004,17:295-299.
25 Marchetti M,et al.Lactoferrin inhibits herpes simplex virus type 1 adsorption to Vero cells.Antivir Res,1996,29:221-231.
26 Ibrahim HR,et al.Ovotransferrin is a redox-dependent autoprocessing protein incorporating four consensus self-cleaving motifs flanking the two kringles.Biochim Biophys Acta(BBA)-General Subjects,2006,1760:347-355.
27 Biswas S,et al.Redox modifications of protein-thiols:emerging roles in cell signaling.Biochem Pharmacol,2006,71:551-564.
28 Moon SH,et al.Screening for cytotoxic activity of ovotransferrin and its enzyme hydrolysates.Poultry Sci,2013,92:424-434.
29 Shen L(申乐),Chen BS(陈保生).The structure and function of the kringle domain in human apolipoprotein (a).Chem of Life(生命的化学),2007,27:418-421.
30 Su DX(苏东晓),et al.Research advances in anticancer properties of angiostatin.Nat Sci J Hainan Univ(海南大学学报,自科版),2009,27:297-301.
31 Stathakis P,et al.Angiostatin formation involves disulfide bond reduction and proteolysis in kringle 5 of plasmin.J Biol Chem,1999,274:8910-8916.
32 O'Reilly MS,et al.Angiostatin:a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma.Cell,1994,79:315-328.
33 Li ZL(李壮林),et al.Expression and purification of human angiostatin kringles 1-3 and the research of biological activity.China Biotechnol(中国生物工程杂志),2011,31:24-28.
34 Cai WB(蔡卫斌),et al.The effect of inhibiting angiogenesis of plasminogen Kringle 5.Progr Physiol Sci (生理科学进展),2004,35:159-162.
35 Wu JX(吴江雪),et al.Reseach advancement of endogenous angiogenesis inhibitors.Chin J Cancer Res(癌症),2005,3:376-384.
36 Fabiana S,et al.Bioactive egg compounds.New Delhi:Springer,2007.43-50.
37 Guha TP,et al.Structure of diferric hen serum transferrin at 2.8 A resolution.Acta Crystallogr,Sect D:Biol Crystallogr,2003,59:1773-1781.
38 Xie H,et al.Inflammation-induced changes in serum modulate chicken macrophage function.Vet Immunol Immunop,2001,80(3):225-235.
39 Zhang Y(张勇),et al.Acute phase proteins and their function during animal stress process.Chin J Animal Nutri(动物营养学报),2011,23:1877-1883.
40 Xie H,et al.Changes in serum ovotransferrin levels in chickens with experimentally induced inflammation and diseases.Avian Dis,2002,46:122-131.
41 Xie H,et al.Effects of ovotransferrin on chicken macrophages and heterophil-granulocytes.Dev Comp Immunol,2002,26:805-815.
42 Otani H,Odashima M.Inhibition of proliferative responses of mouse spleen lymphocytes by lacto-and ovotransferrins.Food Agr Immunol,1997,9:193-201.
43 Rath NC,et al.Serum ovotransferrin as a biomarker of inflammatory diseases in chickens.Poultry Sci,2009,88:2069-2074.

