吉西他滨对人肝癌HepG2不同浓度吉西他滨对肝癌及其可能机制
宋彬妤
(山西医科大学汾阳学院科技中心,汾阳 032200)
吉西他滨对人肝癌HepG2不同浓度吉西他滨对肝癌及其可能机制
宋彬妤
(山西医科大学汾阳学院科技中心,汾阳 032200)
目的 探讨吉西他滨对人肝癌HepG2细胞的抑制作用以及机制。 方法 采用CCK-8法检测细胞的存活率,将不同浓度(0.4,0.8,1.6,3.2 μg/ml)的吉西他滨作用于人肝癌HepG2细胞24 h、48 h,观察细胞的生长抑制作用,根据结果计算得知细胞的半数抑制浓度(IC50)为1.57 μg/ml,然后在1.57 μg/ml的吉西他滨的基础上加入自噬抑制剂3-MA,观察细胞的生长抑制情况,流式细胞术检测吉西他滨作用于人肝癌HepG2细胞后细胞的凋亡情况,荧光显微镜观察MDC染色后细胞自噬的形态学变化,RT-PCR检测自噬相关基因Beclin-1和LC-3表达的变化。 结果 CCK-8结果显示不同浓度的吉西他滨对人肝癌HepG2细胞有明显的抑制作用,呈现时间和浓度的剂量依赖性,用药后细胞存活率明显下降,与对照组相比较差异具有统计学意义(P<0.01)。在1.57 μg/ml吉西他滨作用基础上加入自噬抑制剂后,细胞的存活率明显上升,由(48.7±1.23)%变为(61.22±2.17)%(P<0.01)。流式细胞术结果显示吉西他滨诱导肝癌HepG2细胞发生凋亡,随着吉西他滨浓度升高,细胞的凋亡率明显上升,MDC染色以及实时荧光定量PCR结果显示吉西他滨可以诱导HepG2细胞发生自噬,引起自噬相关基因基因的Beclin-1和LC-3表达的增加。 结论 吉西他滨对人肝癌HepG2细胞有明显的抑制作用,其机制可能通过诱导细胞发生凋亡和自噬来导致细胞最终死亡。
吉西他滨; HepG2细胞; 细胞自噬; 细胞凋亡; Beclin-1; LC-3
吉西他滨(gemcitabine)是一种抗代谢类的嘧啶核苷类似物,已作为多个国家的临床批准用药。NCCN指南推荐,对于部分转移或者不能切除的肝胆类肿瘤患者可以选用吉西他滨作为基础的一线化疗药物;对于可以切除的肿瘤患者可以选用吉西他滨作为一种辅助的治疗方案[1]。但是由于化疗药的广泛使用以及耐药性的出现,导致化疗药物的疗效有一定的限制[2]。化疗药物对肿瘤细胞的生长抑制通过诱导细胞产生Ⅰ型死亡,即细胞的凋亡。也有部分药物是通过导致细胞发生Ⅱ型程序性细胞死亡,即细胞自噬[3,4]。关于吉西他滨对肝癌细胞的抑制机制的探讨报道较少。本研究旨在探讨吉西他滨对人肝癌HepG2细胞的抑制作用及其可能的机制。
1 材料与方法
1.1 细胞株、主要试剂及仪器
肝癌HepG2细胞(上海细胞库);吉西他滨(武汉东康源科技有限公司);DEME高糖培养液、胰蛋白酶、胎牛血清(Hyclone公司);CCK-8(碧云天beyotime);自噬诱导剂3-MA(Sigma公司);Anexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒(南京凯基生物);自噬体染料MDC(南京凯基生物);细胞RNA提取试剂盒(全式金生物技术有限公司);RNA反转录试剂盒(Thermo Fisher Scientific);PCR扩增试剂盒(TaKaRa)。细胞培养箱(美国Thermo Fisher Scientific公司,型号Labserv CO-150)、倒置生物显微镜(日本Olympus公司,型号CX-41)、酶标仪(上海永创医疗器械有限公司,型号SM800)、流式细胞仪(美国BD公司,型号FACSCalibur)。
1.2 细胞培养及处理
人肝癌HepG2细胞培养于37 ℃、5% CO2培养箱中,动态观察细胞的生长情况,使用DMEM培养基传代培养。
1.3 CCK-8法检测药物作用后细胞的存活率
对数生长期的细胞以1×105个/ml的浓度接种于96孔板中,分别设立加吉西他滨的实验组、不加吉西他滨的对照组以及不加细胞的空白组。实验组的吉西他滨终浓度为0.4,0.8,1.6,3.2 μg/ml。将96孔板放入培养箱中恒温孵育,药物作用24 h和48 h立即加入总体积10%的CCK-8试剂,在酶标仪下检测450 nm处的吸光度值,根据结果计算细胞的抑制率,以及分别计算药物24 h和48 h的半数抑制浓度(IC50)值。根据软件计算得出24 h的IC50值,加入IC50值浓度的吉西他滨,同时设置另一组在加入相同浓度吉西他滨的基础上加入100 μl浓度为5 mmol/L的3-MA试剂,同样,检测吸光度值。抑制率=(A对照孔-A实验孔)/(A对照孔-A空白孔)×100%。
1.4 流式细胞术检测细胞凋亡
对数生长期的细胞以1×106个/ml的浓度接种于6孔板中,分别设立加入吉西他滨的实验组以及不加药物的对照组。实验组的吉西他滨药物终浓度为0.4,0.8,1.6,3.2 μg/ml。将6孔板放入培养箱中恒温孵育,培养24 h立即收集细胞并用PBS清洗细胞两次。将细胞重悬于100 μl含Annexin Ⅴ-FITC和PI的binding buffer,室温避光孵育15 min,上机前再加入200 μl的binding buffer,然后上机检测。
1.5 荧光显微镜观察自噬
对数生长期的细胞以1×106个/ml的浓度接种于6孔板中,分别设立加入吉西他滨的实验组以及不加药物的对照组。根据CCK-8结果计算出的IC50值,实验组加入吉西他滨药物的终浓度为1.57 μg/ml。将6孔板放入培养箱中恒温孵育,培养24 h弃去上清,加入0.05 mmol/L浓度的MDC试剂,37 ℃孵育30 min,用PBS缓冲液洗去未结合的荧光染料,在荧光显微镜下观察自噬颗粒。
1.6 实时荧光定量PCR检测药物作用后细胞内自噬基因的表达水平
对数生长期的细胞以1×106个/ml的浓度接种于6孔板中,分别设立加入吉西他滨的实验组以及不加入药物的对照组,实验组的吉西他滨药物终浓度为0.4,0.8,1.6,3.2 μg/ml。将6孔板放入培养箱中恒温孵育,培养24 h收集细胞,采用TransZol Up法提取细胞内的总RNA。将RNA反转录为cDNA,使用核酸定量仪分析后,通过实时荧光定量PCR法,比较各组之间细胞内基因表达的相对含量。
1.7 统计学分析
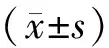
2 结果
2.1 CCK-8结果显示吉西他滨对HepG2细胞具有明显的抑制作用
结果显示,不同浓度的吉西他滨对于肝癌HepG2细胞有明显的抑制作用,并且抑制率随着浓度的上升不断增大,呈现剂量依赖性。吉西他滨对肝癌HepG2细胞24 h的IC50值为1.57 μg/ml,48 h的IC50值为0.72 μg/ml。1.57 μg/ml吉西他滨组对肝癌HepG2细胞的存活率为(48.7±1.23)%,1.57 μg/ml吉西他滨+3-MA组对肝癌HepG2细胞的存活率为(61.22±2.17)%,差异具有统计学意义(t=15.872 5,P<0.01,见图1)。

同时点与对照组(0 μg/ml)相比,*P<0.01图1 不同浓度吉西他滨对肝癌HepG2细胞的抑制作用Figure 1 Inhibitory effects of gemcitabine at different concentrations on survival rate of HepG2 cells
2.2 流式细胞术检测吉西他滨作用于HepG2细胞后的凋亡情况
与对照组比较,不同浓度的吉西他滨组细胞凋亡率明显升高,差异具有统计学意义(P<0.01,见表1),呈现明显的剂量依赖性。
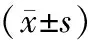

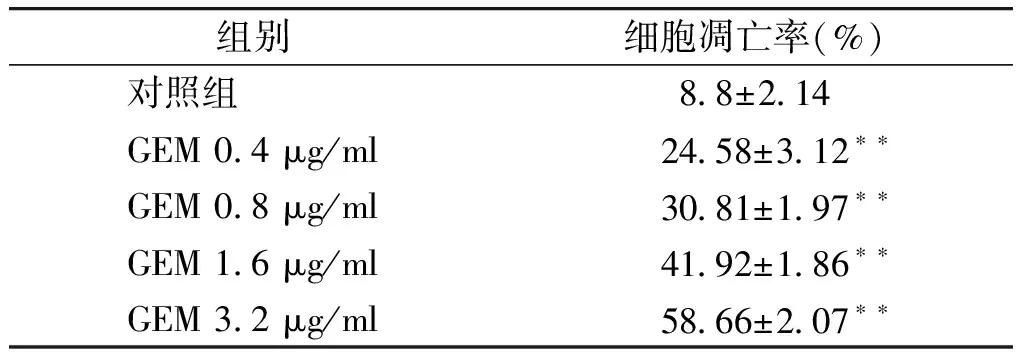
组别细胞凋亡率(%)对照组88±214GEM04μg/ml2458±312∗∗GEM08μg/ml3081±197∗∗GEM16μg/ml4192±186∗∗GEM32μg/ml5866±207∗∗
与对照组相比,**P<0.01
2.3 荧光显微镜检测吉西他滨作用后细胞的自噬情况
细胞经MDC染色,荧光显微镜下观察可见吉西他滨组中自噬颗粒(黄色箭头示)多于对照组细胞,吉西他滨组细胞在胞质及核周区域可见清晰明亮的点状自噬颗粒(见图2)。
2.4 荧光定量PCR检测吉西他滨作用后细胞自噬基因的表达
与对照组相比,不同浓度的吉西他滨处理组Beclin-1的基因表达量呈上升趋势(P<0.05,见图3),且呈现剂量依赖效应。同样,不同浓度的吉西他滨处理组,LC-3基因的表达水平也呈现上升的趋势(P<0.05,见图4)。结果提示吉西他滨可能诱导HepG2细胞自噬的发生。

A.对照组 B.1.57 μg/ml吉西他滨组图2 荧光显微镜观察经MDC染色后细胞自噬情况Figure 2 Observation of autophagy after MDC staining under fluorescence microscopy
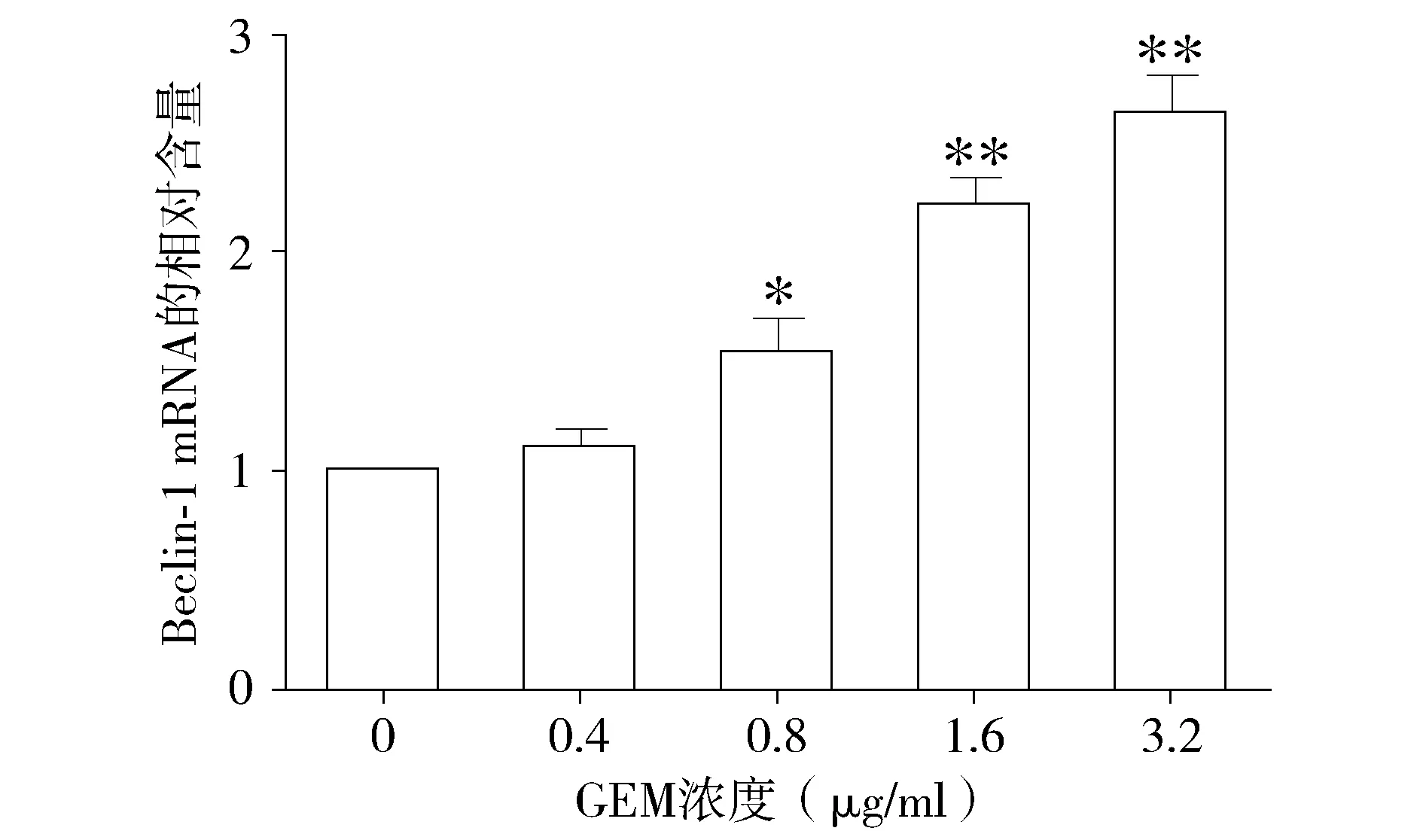
与对照组(0 μg/ml)相比,*P<0.05,**P<0.01图3 不同浓度的吉西他滨对HepG2细胞Beclin-1基因表达的影响Figure 3 Effect of different concentrations of gemcitabine on the expression of Beclin-1 gene in HepG2 cells
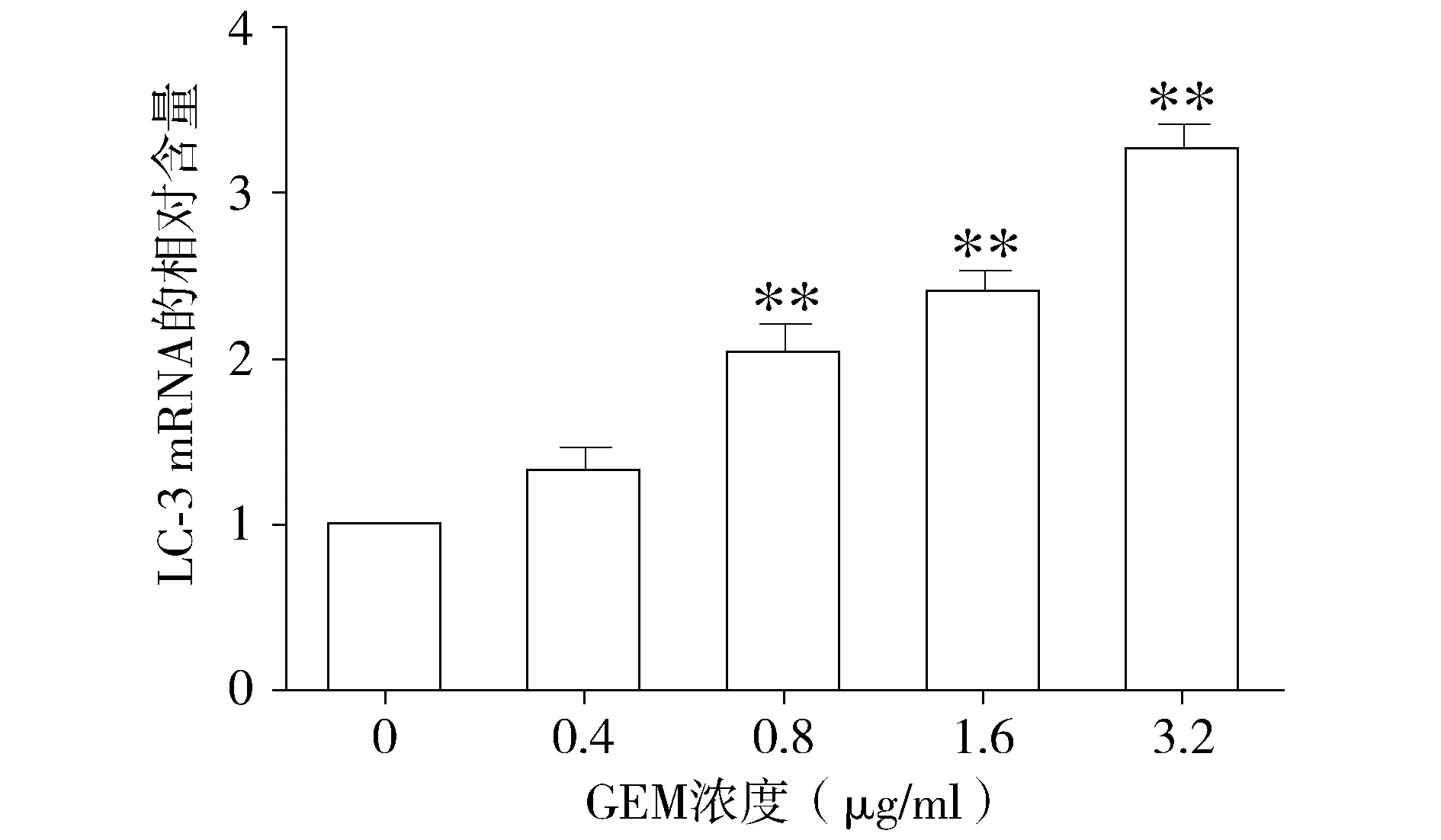
与对照组(0 μg/ml)相比,*P<0.05,**P<0.01图4 不同浓度的吉西他滨对HepG2细胞LC-3基因的表达的影响Figure 4 Effect of different concentrations of gemcitabine on the expression of LC-3 gene in HepG2 cells
3 讨论
肝癌是目前全球癌症致死率极高的疾病,患病初期就诊率较低,确诊时往往已经进入晚期[5],多数患者因手术耐受性较差只能进行化疗,部分经过手术治疗的患者术后复发仍旧需要化疗[6]。因此,为了改善肝癌患者的治疗现状,临床上需要更多的有效药物来治疗肝癌。吉西他滨是一种水溶性的脱氧胞苷类似物,主要功能为抗代谢,以三磷酸盐和脱氧胞苷三磷酸竞争性地结合DNA,影响细胞的代谢,已经广泛的应用于多种肿瘤[7]。由于原发性肝癌的治疗效果受限,因此如何进一步提高吉西他滨在肝癌细胞治疗中的疗效,深入研究其作用机制是研究者探索的目标。
自噬是一种进化上高度保守的溶酶体降解通路,是一种细胞的自我消化过程,是细胞为了自身发展、分化、生存,维持稳定的一种生理过程。自噬包括3种形式:一种为巨自噬,一种为微自噬,还有分子伴侣介导的自噬[8]。一般情况下,自噬即为巨自噬,形成典型的双层膜囊自噬体。自噬对肿瘤细胞具有双重作用,一方面可以帮助细胞度过不良的生活环境,另一方面自噬可以直接导致细胞死亡[9]。目前,关于肝癌中自噬与药物的关系的研究已经有部分报道,但是吉西他滨作为治疗肝癌的新药,凋亡和自噬在研究中的关系尚未完全清楚,本研究旨在初步探讨吉西他滨对于肝癌细胞的自噬和凋亡的作用。
Beclin-1与LC-3在自噬的发生中起着重要的作用,Beclin-1是自噬过程的起始信号,参与激活自噬的信号通路。LC-3是自噬体膜上的重要分子,被广泛的公认为是自噬的一种可靠的标志物[10]。本研究采用荧光定量PCR检测Beclin-1与LC-3基因的表达量,结果显示,与对照组相比较,不同浓度的吉西他滨组Beclin-1,LC-3的基因表达量均有所上升,并且随着浓度的升高表达量逐渐上升。结合MDC染色中出现的自噬泡,可见,吉西他滨可以诱导人肝癌HepG2细胞发生自噬。本研究流式细胞术的结果显示,吉西他滨可以明显地促进人肝癌HepG2细胞发生凋亡。MTT结果显示,吉西他滨对于人肝癌细胞有着明显的抑制作用,通过应用3-AM自噬抑制剂,抑制率明显降低,说明吉西他滨对于诱导的自噬可以抑制肝癌细胞的生长。
早在1995年Huang等[11]学者就发现吉西他滨可以通过抑制细胞内DNA的合成来诱导细胞发生凋亡,后续学者又发现吉西他滨可以诱导多种细胞发生自噬。自噬在肿瘤的不同阶段发挥着不同的作用,大量研究表明自噬的紊乱在肿瘤细胞中发挥着较大的作用[12]。但是吉西他滨是否同时通过诱导肝癌细胞发生自噬和凋亡来共同促进对肝癌细胞的杀伤作用,并没有研究。总而言之,根据本实验的研究结果证明,吉西他滨可以抑制人肝癌HepG2细胞的生长,一部分是通过诱导细胞凋亡,另外一部分是通过诱导细胞自噬。
[1] Zheng Y, Xu D, Bu Z. Chinese version of NCCN Clinical Practice Guidelines in Oncology officially authorized by NCCN [J]. Chin J Cancer Res, 2016, 28(1):144-145.
[2] 吴孟超.原发性肝癌在中国的治疗和研究现状[J].成都医学院报,2012,7(2):161-162.
[3] 张武德,程卫东,鲍英存,等.扶正抑瘤汤对肝癌Hu-7细胞诱导凋亡及自噬的作用[J].中国老年学杂志,2015,35(21):6036-6039.
[4] 陆立鹤,吴伟康.细胞死亡方式研究进展[J].国际病理科学与临床杂志,2005,25(6):507-510.
[5] 尹咪咪,张建华,张萍萍,等.基于BP算法的血液指标联合检测在肝癌及肝炎诊断中的应用[J].郑州大学学报(医学版),2016,51(2):190-193.
[6] 汤钊猷.肝癌治疗的“消灭与改造并举”策略[J].实用肝脏病杂志,2015,(2):113-114.
[7] 阚朝辉,阚庆生.吉西他滨与卡培他滨联合治疗晚期胆管细胞癌的近期效果及随访[J].中国普通外科杂志,2016,25(8):1219-1223.
[8] 左全庭,吴成翰,高丽丽,等.自噬与卒中[J].国际脑血管病杂志,2010,18(7):548-552.
[9] 刘辉,李晓强,朱人大,等.自噬激活如何影响大鼠内皮祖细胞凋亡、增殖和周期的变化?[J].中国组织工程研究,2015,7(1):67-71.
[10] Hu YF, Lei X, Zhang HY,etal. Expressions and clinical significance of autophagy-related markers Beclin1, LC3 and EGFR in human cervical squamous cell carcinoma[J]. Onco Targets Ther,2015,8:2243-2249.
[11] Huang P, Plunkett W. Induction of apoptosis by gemcitabine[J]. Semin Oncol,1995,22:19-25.
[12] Alec CK, Eileen W. Autophagy and tumor metabolism[J]. Cell Metab, 2017, 25(5):1037-1043.
TheinhibitoryeffectofgemcitabineonhumanhepatocellularcarcinomaHepG2cellsanditspossiblemechanism
SONG Binyu
(ScienceandTechnologyCenter,FenyangCollegeofShanxiMedicalUniversity,Fenyang032200,China)
ObjectiveTo investigate the inhibitory effect of gemcitabine on human hepatocellular carcinoma HepG2 cells and its possible mechanism.MethodsCCK-8 method was used to detect the HepG2 cell growth after treated with different concentrations of gemcitabine(0.4, 0.8, 1.6, 3.2 μg/ml) for 24 h and 48 h. Based on the treatment of gemcitabine(the half inhibitory concentration of the cell,1.57 μg/ml), the autophagy inhibitor 3-MA was added to observe the inhibition of cell growth. The apoptosis of HepG2 cells was detected by flow cytometry after exposed to gemcitabine. The morphological changes of MDC cell autophagy after staining were observed under fluorescence microscopy. RT-PCR was used to detect the expression of autophagy-related genes LC-3 and Beclin-1.ResultsThe results of CCK-8 showed that gemcitabine had a great growth inhibitory effect on human hepatoma HepG2 cells in a concentration- and time-dependent manner. After the administration, the cell survival rate decreased significantly compared with control group (P<0.01) When adding autophagy inhibitor 3-MA based on 1.57 μg/ml gemcitabine treatment, the survival rate of the cells was significantly increased from (48.7±1.23)% to (61.22±2.17)%(P<0.01). Flow cytometry showed that the apoptosis of hepatoma HepG2 cells increaced after exposed to gemcitabine in a concentration-dependent manner. MDC staining and real-time fluorescence quantitative PCR results showed that gemcitabine induced the autophagy of HepG2 cells and increased the expression of autophagy-related genes Beclin-1 and LC-3.ConclusionGemcitabine has a significant inhibitory effect on human hepatocellular carcinoma cell line HepG2, which may lead to the eventual death of cells by inducing the apoptosis and autophagy.
gemcitabine; HepG2 cells; cell autophagy; cell apoptosis; Beclin-1; LC-3
R735.7
A
1007-6611(2017)09-0875-04
10.13753/j.issn.1007-6611.2017.09.001
山西医科大学汾阳学院科技发展基金资助项目(2016B02)
宋彬妤,女,1980-03生,硕士,实验师,E-mail:yanbeipan@sina.com
2017-04-12

