肝硬化门静脉高压症的肝移植治疗
李 涛, 陈 皓
(上海交通大学医学院附属瑞金医院外科 肝移植中心,上海 200025)
肝硬化是导致门静脉高压症 (portal hypertension,PHT)最常见的原因,其中约90%的肝硬化病人会出现PHT,而PHT是导致肝硬化病人死亡的主要原因之一[1]。门静脉压力梯度(portal pressure gradient,PPG)超过 5 mmHg(1 mmHg=0.133 kPa)时,提示存在PHT。肝硬化时,PPG可用间接测量的肝静脉压力梯度 (hepatic venous pressure gradient,HVPG)来替代[2]。当 HVPG≥10 mmHg,会出现 PHT的各种并发症,包括腹水、食管胃底静脉曲张及肝肾综合征(hepatorenal syndrome,HRS)等。这意味着肝硬化进入失代偿阶段,肝硬化PHT血流动力学临床关联见图1[3]。肝硬化失代偿病人出现PHT并发症者平均生存时间不足2年[4]。区别于非肝硬化PHT,肝硬化PHT(cirrhotic PHT,CPHT)的病因虽有不同,但其导致的终末期肝病临床症状与转归却基本相同。经半个多世纪的发展,目前肝移植治疗终末期肝病已取得良好的效果,术后病人1年生存率可达90%,5年生存率达77%,病人生存质量也明显提高[5]。肝移植可从病因上彻底治愈肝硬化,是CPHT最有效的治疗方法。
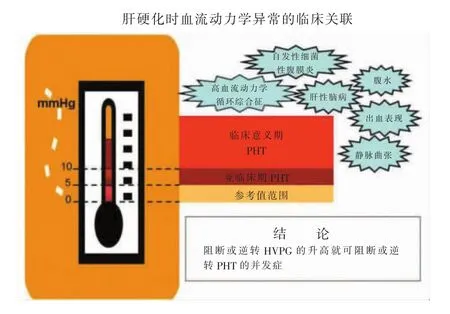
图1 肝硬化PHT血流动力学临床关联图[3]
CPHT的肝移植手术时机
由于供肝短缺、高昂的治疗费用以及肝移植本身固有的风险使得肝移植并不能作为CPHT的一线治疗手段,因此,选择肝移植治疗CPHT时,手术时机的把握尤为重要。确定病人的肝移植手术时机必须权衡移植的固有风险(包括手术、疾病复发和长期免疫抑制等)与病人可能的获益,是一个风险效益分析过程。肝硬化病人目前常用的两个风险评估模型是Child-Turcotte-Pugh(CTP)评分与终末期肝病模型(model for end-stage liver disease,MELD)评分。未行肝移植的Child C级(CTP≥10分)肝硬化和曲张静脉出血的病人5年生存率约25%,而行肝移植的病人可达70%~75%[6]。即便是CTP<10分的肝硬化病人,肝移植术后5年生存率也高于未行肝移植的病人[7]。与CTP评分相比,MELD评分能更准确地预测病人3个月生存率,因此被广泛应用于器官移植分配系统。MELD评分<9分的肝硬化病人3个月死亡率为1.9%,而>40分的病人死亡率则高达71.3%[8]。低钠血症是肝硬化病人中普遍存在的问题之一,其严重程度反映肝硬化的严重程度[9]。因此,目前把血钠值也纳入MELD评分。MELD-Na评分<6分的病人与>40分的病人相比,3个月死亡率分别为7%比90%[10]。CTP评分包含PHT的常见并发症,如腹水及肝性脑病(hepatic encephalopathy,HE),但MELD评分和MELD-Na评分中并未体现PHT的并发症。因此,在器官分配中使用MELD系列评分系统可能会低估移植等待名单中PHT病人的风险,从而延长其等待时间,增加等待期病人的死亡率和移除率(因病情进展不适合行肝移植而从等待名单中移除的概率)。这些PHT的严重并发症作为肝移植的适应证应予以MELD评分之外的额外考虑,以缩短病人在移植系统中的等待时间,但目前尚缺乏针对PHT的可靠评估模型。因此,目前CPHT的肝移植时机通常为MELD评分≥15分;肝功能失代偿和(或)出现PHT严重并发症[11]。
PHT并发症与肝移植指征
一、食管胃底静脉曲张
一旦诊断为肝硬化,30%的代偿期病人与60%的失代偿期病人存在食管胃底曲张静脉[12]。没有曲张静脉的肝硬化病人每年静脉曲张发生率约8%。长期随访发现,高达90%的肝硬化病人最终出现静脉曲张。确诊曲张静脉后,第1年有10%~30%的破裂风险[13]。PHT导致食管胃底曲张静脉破裂出血是CPHT病人的主要死亡原因。当HVPG>12 mmHg,曲张静脉易破裂出血[4]。尽管在过去的十几年间,曲张静脉出血的治疗有很大进展,但第一次曲张静脉出血6周的平均住院死亡率仍高达20%[14]。如不采取预防措施,发生第一次曲张静脉出血后再出血的风险高达60%[15]。肝移植是CPHT合并曲张静脉出血的有效治疗方法。我国肝移植注册系统数据表明,因PHT食管胃底曲张静脉破裂出血而行肝移植的非肿瘤病人3年总体生存率为 80.1%[16]。Iwatsuki等[6]研究证实,肝功能 Child评分C级合并消化道出血的病人,肝移植术后5年生存率明显高于其他治疗手段。因此,对于经药物治疗、内镜治疗、经颈静脉肝内门腔静脉分流术(transjugular intrahepatic portosystemic shunt,TIPS)以及分流或断流术后,仍反复出血的病人,应行肝移植治疗。
二、门静脉高压性胃病
门静脉高压性胃病 (portal hypertension gastropathy,PHG)是由胃黏膜毛细血管充血引起,内镜特征是黏膜弥漫性马赛克征,严重者还会出现红斑,导致慢性胃肠道出血,从而发生严重缺铁性贫血[17]。治疗主要包括使用β受体拮抗剂和补充铁。内镜治疗对PHG没有明显效果。TIPS及外科分流手术有一定的疗效[18]。如病人经上述治疗仍无法控制出血,或因长期慢性出血导致难治性贫血,应行肝移植治疗。Akatsu等[19]的回顾性研究发现,术前诊断为PHG的19例病人,肝移植术后PHG均自行消退,其中1例为重度PHG病人。
三、HE
HE是晚期肝病病人重要的临床阶段,预示病情恶化[20]。肝硬化病人发生严重HE,仅在第1年的死亡率就超过50%[21]。部分病人因门体分流手术或TIPS治疗后而反复出现HE。Lucidi等[22]研究表明,MELD评分会低估先前有HE发作病人的近期死亡率。有明确HE发作病人的MELD评分增加7分能较准确地预测病人半年内死亡率。HE病人肝移植后5年生存率达70%以上[23],且HE相关的认知障碍为可逆[24]。因此,对于经积极治疗后仍有反复HE发作、严重影响生活质量的CPHT病人,应行肝移植治疗。对部分门体分流手术引起的HE病人,肝移植术中还需处理分流道,否则术后HE仍会反复。
四、难治性腹水
肝硬化腹水形成的核心原因是系统性炎症反应介导的外周动脉扩张,PHT导致的病理生理失调参与其中[25]。病人在诊断为肝硬化后的10年内,70%出现腹水[26],其中高达11.4%的病人进展为难治性腹水[27-28]。难治性腹水病人的1年死亡率接近50%[29],平均生存期不超过6个月[30]。因此,肝硬化病人一旦发生难治性腹水,应尽早行肝移植治疗。Somsouk等[31]研究表明,如CPHT病人存在难治性腹水,在肝移植评分时应将MELD评分增加4.7分,MELD-Na评分增加3.5分,以缩短移植等待时间。由于导致肝硬化腹水形成的血液动力学和肾脏生理功能异常需一定时间才能完全恢复,因此,病人腹水可能会在移植术后持续3~4个月。病人需继续坚持低钠饮食和适当利尿,直到腹水消除[32]。
五、HRS
HRS在肝硬化失代偿病人中的发生率约4%,1年累积发生率为18%,5年为39%[33]。大部分HRS病人合并PHT。HRS常见的诱发因素包括自发性细菌性腹膜炎、大量放腹水而未补充血浆以及胃肠道出血[34]。113的自发性腹膜炎病人会进展出现HRS[33]。其中HRS-1型和HRS-2型中位生存期分别为1.0个月和6.7个月[35-36]。HRS肝移植后76%~80%的病人肾功能可以恢复[37-38]。但预测肝移植后受损肾功能的恢复和恢复的程度具有挑战性,因很难准确评估先前存在的合并症、未被识别的固有肾脏疾病、围术期事件和免疫抑制对肝移植后肾功能的影响程度[39]。考虑到CPHT病人一旦出现HRS,病情进展将非常迅速,所以应尽早行肝移植手术,部分病人可能还需肝肾联合移植[39-40]。
六、肝肺综合征
有4%~47%的肝硬化病人和4%~32%肝移植术后合并肝肺综合征 (hepatopulmonary syndrome,HPS)[41]。合并严重HPS的肝硬化病人平均生存期约10个月,其死亡风险是肝移植等待名单中其他病人的2倍[42]。与无HPS的肝硬化病人相比,合并HPS病人肝移植术后会延长重症监护室治疗时间,增加治疗费用和死亡风险[43]。Schenk等[44]报道肝硬化病人移植前合并HPS是独立的高死亡率预后因素,合并HPS的肝硬化病人平均生存期低于不合并HPS的病人(10.6个月比40.8个月),合并HPS的病人随访2.5年内总死亡率为63%。肝移植是治愈HPS的唯一方法。氧分压<60 mmHg的HPS病人应及时肝移植。移植可使病人的氧合在数周至数月内恢复正常,且移植生存率与无HPS的病人相似[45-46]。但严重缺氧的HPS病人(氧分压<45 mmHg)可增加移植术后死亡率,手术需谨慎。
七、门静脉性肺动脉高压
门静脉性肺动脉高压 (portopulmonary hypertension,POPH)在肝移植病人中发病率为5.3%~8.5%[47],其发生可能与PHT病人循环中血管内皮生长因子、激素和细胞因子水平等有关[48]。合并中、重度POPH的CPHT病人,术中或术后极易发生右心衰竭,增加围术期死亡率,部分病人可能需要联合体外膜肺氧合 (extracorporeal membrane oxygenation,ECMO)治疗。因此,POPH在肝移植中常作为禁忌证来考虑。Swanson等[49]的一项回顾性研究发现,POPH病人在未接受治疗的情况下,第1年内54%死亡,5年生存率仅14%,而接受内科治疗和同时接受内科治疗及肝移植的病人5年生存率分别增加到45%和67%。Krowka等[50]研究发现,平均肺动脉压 (mean pulmonary artery pressure,mPAP)>50 mmHg和36~49 mmHg的POPH病人肝移植后死亡率分别为100%和50%。国际肝移植协会实践指南中推荐,合并轻度POPH的肝移植病人术前无需治疗;中度POPH病人需药物治疗并证实治疗有效,肺动脉血流动力学改善后施行肝移植;重度POPH则是肝移植的绝对禁忌证[51]。因此,建议所有肝移植病人术前均需行经胸或食管超声心动图检查,以详细评估右心功能和收缩期肺动脉压[52]。对于收缩期肺动脉压≥50 mmHg或存在右心肥厚、扩张或功能失调的病人应进一步行右心导管检查[47]。
CPHT的肝移植“桥接”治疗
在肝移植时代,针对PHT并发症进行的TIPS、断流术、分流术以及脾切除等传统外科治疗方法,均可看作肝移植前的“桥接”治疗。TIPS用于治疗曲张静脉出血、难治性腹水或HRS,具有微创的特点,可用于肝功能Child C级病人。有报道TIPS还可纠正低氧,有利于逆转HPS[53]。虽然随着新型覆膜支架的应用,支架狭窄或阻塞的发生率下降,并可通过调整支架的直径来控制HE的发生,但肝脏会因分流而丧失部分或全部门静脉血供,可能加速肝衰竭的发生。TIPS作为肝移植“桥接”治疗,放置的支架不宜延伸至门静脉主干过长。位置不当可增加肝移植时门静脉解剖难度或造成门静脉内膜损伤。断流术与分流术的术式繁多,但作为肝移植的“桥接”手术应尽量减少对第一肝门结构的破坏,以避免对后续肝移植手术的影响。一项比较TIPS与分流术治疗曲张静脉出血效果的荟萃分析表明,病人分流术后2年、5年生存率均高于TIPS,且再出血率、HE发生率均低于TIPS[54]。目前分流术多推荐远端脾肾分流术。该术式即可有效控制曲张静脉出血,又不会对后续肝移植手术造成过大影响。但也有报道术后门静脉血栓 (portal vein thrombosis,PVT)的发生率高达6%[7]。断流术虽不破坏门静脉系统,但其术后导致的致密粘连会增加术中出血。该术式多合并脾切除术,术后PVT发生率高达20%[55]。
关于PVT
PVT并不是肝移植的绝对禁忌证,但广泛的PVT对肝移植仍存在技术上的挑战[56]。肝硬化代偿期病人PVT的发生率约1%,而等待肝移植的肝硬化失代偿期病人PVT发生率则高达8%~25%[57]。CPHT时门静脉血流变慢,这是PVT形成的独立危险因素[15]。PVT形成,又进一步加剧PHT,并促使肝功能进一步恶化。一项纳入2 436例肝硬化病人的荟萃分析表明,PVT与病人死亡率和腹水增加密切相关[58]。PVT还增加肝硬化病人急性曲张静脉出血治疗的失败风险[59]。对于合并PVT的CPHT病人,肝移植手术中需根据血栓的Yerdel分级作相应处理。Ⅰ~Ⅲ级血栓可行血栓切除或血栓内膜剥脱[60]。如术中发现门静脉血流不足,可采用结扎门静脉侧支、门静脉动脉化、间置血管等处理[56]。对Ⅳ级血栓,应尽可能利用粗大的曲张静脉、冠状静脉或左肾静脉建立符合生理的门静脉血流,而非生理的门静脉血流恢复,如门腔半转位不能降低门静脉压力[56]。合并广泛PVT的肝移植病人与部分血栓相比,术后30 d内死亡率增加[61]。对这部分病人,理论上多脏器移植(如肝和小肠)是恢复门静脉生理性血流和降低门静脉压力的最好选择。报道1、3、5年生存率分别为80%、72%、72%[62]。
结 语
肝移植是治愈CPHT的唯一方法。但受供肝短缺的限制,目前只有病人在MELD评分≥15分或肝功能失代偿和(或)合并PHT并发症时才行肝移植。在以MELD评分为基础的器官分配体系下,有些PHT并发症被严重低估,因此需进一步优化该特殊病症下的器官分配策略。虽然,活体肝移植的实施可弥补部分器官来源不足,使CPHT病人有望更早获得肝移植机会,但由于成人活体肝移植的技术要求高、捐献者存在潜在的死亡风险、术后更多的并发症发生等,因此更需审慎选择与评估。现阶段CPHT的活体肝移植手术适应证应遵循本文相同的指征。

