肝移植术后撤除免疫抑制剂的回顾性分析
戚德彬, 陈 鹏, 佟 辉, 彭承宏, 李 涛
(上海交通大学医学院附属瑞金医院外科 肝移植中心,上海 200025)
肝移植病人术后需长期规律服用免疫抑制剂,以防止排斥反应的发生。但免疫抑制剂所带来的短期及长期不良反应,如心血管疾病、感染、代谢紊乱、肾功能损害、恶性肿瘤等[1],严重影响病人的长期生存。多中心研究表明,长期生存肝移植病人中有超过40%的成人和60%的儿童可达到免疫耐受而完全撤除免疫抑制剂的应用[2-3]。但如何识别达到免疫耐受的肝移植病人,尚缺乏公认的有效生物标志物。在肝移植病人术后随访工作中,因担心完全撤药可能会让病人暴露于严重排斥反应的风险,临床医师通常不会主动要求病人完全撤药。除个别病人主动要求外,完全撤药的病人多因出现严重并发症而被动撤药。本文回顾性分析本中心撤除免疫抑制剂的15例肝移植病人临床资料,现报道如下。
资料与方法
一、一般资料和围术期免疫抑制方案
回顾性分析本中心在2013年1月至2020年6月期间被动或主动完全撤除免疫抑制剂的随访肝移植病人临床资料。主动撤药为病人要求撤药。男13例,女2例,平均年龄(63.7±14.6)岁,肝移植术后平均时间(140.7±62.1)个月。9例原发病为乙肝后肝硬化失代偿,2例为肝门胆管癌,2例为肝细胞癌合并肝硬化,1例为酒精性肝硬化失代偿,1例为肝豆状核变性(见表1)。
肝移植手术方式均为血型相容的经典原位肝移植。围术期免疫抑制方案如下:术前4 h吗替麦考酚酯(mycophenolate mofetil,MMF)1 g口服,术中应用甲泼尼龙500 mg,术后用他克莫司(FK506)+MMF+肾上腺皮质激素。其中,FK506总剂量按0.05~0.10 mg1(kg·d),浓度调整在 8~10 μg1L,MMF总剂量1.5 g1d,肾上腺皮质激素剂量递减。6例肝移植病人术后d1与d4应用单剂巴利昔单抗(舒莱)。
二、术后免疫抑制维持方案
肝移植病人术后1年免疫抑制维持遵循个体化用药方案。在监测肝功能正常的前提下,免疫抑制剂用量递减。
三、术后免疫抑制完全撤除方案
对于主动撤药的肝移植病人,详细告知其完全撤药的潜在风险,在随访医师严格指导下逐渐撤药。要求撤药前1年内未发生临床或组织病理学明确的急性排斥反应(acute rejection,AR),转氨酶及总胆红素完全正常,影像学检查未发现血管及胆道并发症。减药间隔时间为3个月,直至完全撤除免疫抑制剂。对于被动撤药的肝移植病人,根据不同病情,逐渐减量或直接停药。
四、研究方法
将15例肝移植术后完全撤除免疫抑制剂的病人分为主动撤药组与被动撤药组,撤药成功组与撤药失败组,比较组间差异。
五、随访和撤药结果判定
对于撤药的肝移植病人进行严密随访,撤药后1个月内每周复查1次,1~3个月每2周复查1次,3个月后每个月复查1次,1年后每3个月复查1次。每次复查包括血常规、肝肾功能、血脂及肿瘤指标。每半年肝脏超声复查。在随访过程中,有转氨酶升高并经肝穿刺病理组织学活检证实为急性排斥,复用免疫抑制剂者判定为撤药失败;有转氨酶升高,但经病理组织学活检排除急性排斥,未复用免疫抑制剂,经保肝治疗后转氨酶恢复正常者为撤药成功。
六、统计学方法
采用SPSS 17.0统计学软件进行分析。计量数据以均数±标准差(±s )表示,采用t检验。计数资料采用Fisher精确检验。P<0.05为差异有统计学意义。
结 果
15例肝移植病人中,11例因免疫抑制剂严重不良反应,包括骨髓抑制、肾功能损害、新发肿瘤以及肿瘤复发转移等,而被动撤药(见表1)。其中2例因发生AR而撤药失败,平均撤药时间为(10.4±6.2)个月,撤药成功率81.8%。主动撤药的4例病人,平均撤药时间为(28.8±30.3)个月,撤药全部成功(100%),其中1例完全撤药时间达74个月。末次随访移植物功能及病人结局见表2。
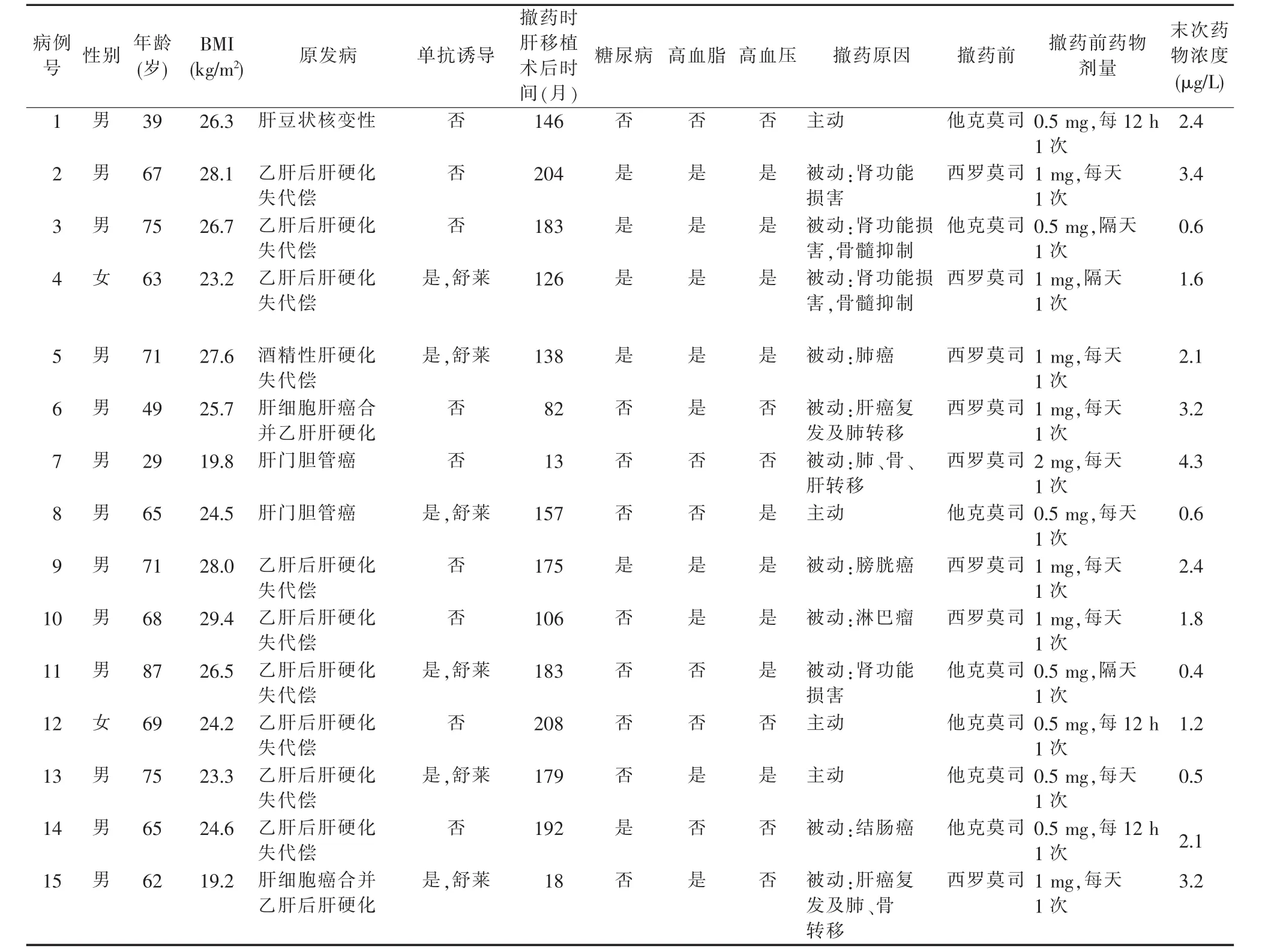
表1 一般临床资料
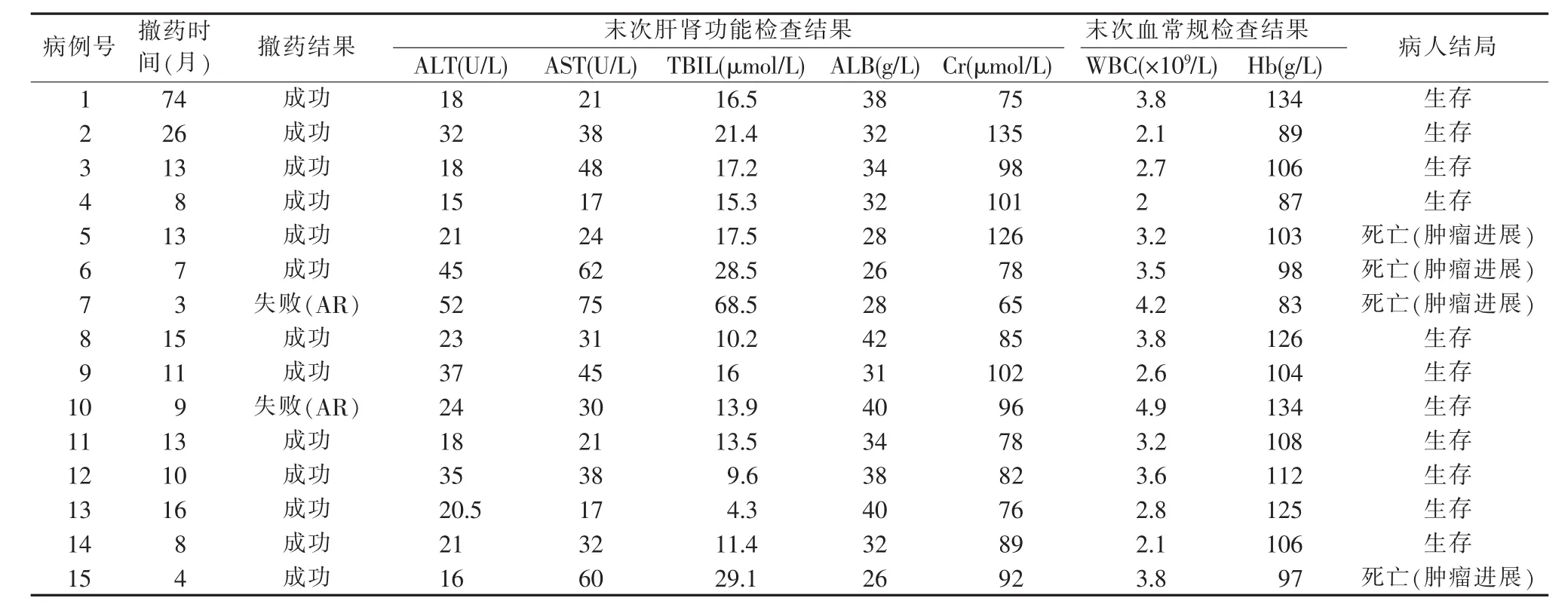
表2 随访病人结局
主动撤药组与被动撤药组在性别、年龄、体质量指数(body mass index,BMI)、使用单抗诱导、撤药时肝移植术后时间、合并症(糖尿病、高血脂、高血压)、撤药时间以及撤药成功率的差异无统计学意义(P>0.05)(见表3)。撤药成功组撤药时肝移植术后时间明显长于撤药失败组,两组间差异具有统计学意义(P<0.05)(见表4)。

表3 主动撤药组与被动撤药组比较
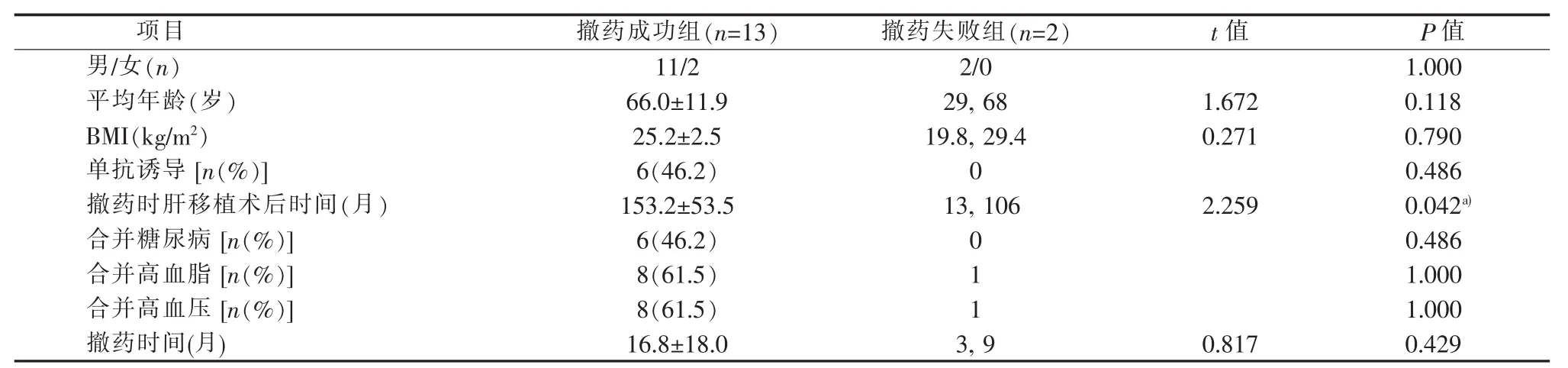
表4 撤药成功组与撤药失败组比较
讨 论
随着外科技术的提高以及新型免疫抑制药物的应用,肝移植已成为各种终末期肝病唯一可靠的治疗方法。肝移植病人术后1、5和10年的生存率分别达到90%、80%和70%[4]。为防止排斥反应的发生,肝移植病人术后需长期应用免疫抑制剂。病人不仅承担巨大的经济负担,还面临长期应用免疫抑制剂带来的短期及长期不良反应,如心血管疾病、感染、代谢紊乱、肾功能损害、恶性肿瘤等。虽然近年来免疫抑制方案不断优化,但有研究报道,肝移植术后10年生存的病人中,77.6%出现高血压,47.9%出现高脂血症,42.9%出现中度以上肾功能受损[5]。肝移植术后10年内死亡的病人中,20%死于感染,18%死于新发肿瘤,14%死于心血管疾病[6]。
操作性免疫耐受 (operational tolerance,OT)是指在不使用免疫抑制剂的情况下,至少1年以上未发生移植物排斥反应,获得移植器官长期存活的现象。肝移植术后OT形成的分子机制目前尚未完全明确,可能与微嵌合现象、Treg细胞、辅助性T细胞(helper T cell,Th)1与Th2细胞因子比例、自然杀伤细胞、未成熟树突状细胞及其来源的外泌体等有关[7-18]。其相关因子可能作为生物标志物预测OT的状态。最近Jhun等[14]发现在逐渐减少肝移植病人免疫抑制剂用量的过程中,Treg与Th17的比值会发生改变。免疫耐受组病人Treg与Th17的比值明显高于非免疫耐受组。Pérez-Sanz等[15]的前瞻性研究证实,SENP6与FEM1C表达对肝移植病人的OT状态有很强的预测作用。但迄今为止,尚未发现能精准预测肝移植病人术后OT状态的生物标志物。因此,目前临床上仍是在监测移植物功能的基础上通过逐渐撤除免疫抑制剂的方法来诱导肝移植病人达到OT状态。Shaked等[16]的多中心研究表明,肝移植术后撤除免疫抑制剂的病人中有67.5%成功减药至标准药量的一半以下,13.0%的病人达到OT状态而完全撤药。肝移植病人完全撤药是否成功与病人年龄、原发病、肝移植类型、免疫抑制方案、肝移植术后时间等多种因素有关。Sánchez-Fueyo等[17]研究发现,肝移植术后10年以上的成人中有较高的比例达到OT。Trotter等[18]认为,对于那些肝移植术后5年以上,最近未发生AR或胆道并发症等,免疫抑制剂血药浓度稳定的肝移植病人可考虑缓慢撤药。撤药周期为6~12个月。撤药期间应缩短随访间期。随访期间必须重视病人肝功能异常的处理,并及时行肝穿刺排除AR。de la Garza等[19]研究认为,撤药随访过程中出现肝功能异常,但低于正常指标上限3倍的肝移植病人,应维持当前免疫抑制剂用量,于7~14 d后复查肝功能,肝功能正常的病人继续撤药。Assy等[20]的随机对照试验有75%的自身免疫性肝炎肝移植病人在完全撤药后9~15周内出现疾病复发。确诊后恢复泼尼松联合硫唑嘌呤(100 mg1d)抢救治疗,病人实验室检查指标于6周内缓解。因此,原发病为自身免疫性肝炎的肝移植病人术后完全撤除免疫抑制剂需谨慎[21]。
本研究主动撤药肝移植病人采用笔者的撤药方案均获得成功,4例病人肝移植术后时间均超过12年,其中1例原发病为肝豆状核变性的肝移植病人已成功完全撤药74个月。但在被动撤药组中有2例病人因发生AR导致撤药失败,其中1例撤药在肝移植术后13个月。撤药成功组撤药时肝移植术后时间明显长于撤药失败组,说明撤药时肝移植术后时间是决定撤药是否成功的重要因素之一。
总之,本研究有限的病例资料表明,有选择地在远期随访肝移植病人中进行完全撤药是安全的。对于肝移植术后10年以上,无血管及胆道并发症,在免疫抑制剂最小剂量维持下肝功能保持正常,依从性良好的肝移植病人可在随访医师指导下逐渐撤除免疫抑制剂。对于原发病为自身免疫性肝病相关的肝移植病人,则不建议完全撤除免疫抑制剂。本研究病例较少,还需在今后随访过程中积累更多完全撤药的肝移植病例,以进一步观察肝移植病人免疫耐受形成的临床特征,并监测其免疫耐受相关因子,以寻找可靠的生物标志物。

