TCR-CD3复合物跨膜区自组装的分子机制*
王凤丽 陈佳林 何程智 罗施中
(北京化工大学生命科学与技术学院,北京软物质科学与工程高精尖创新中心,北京 100029)
T 细胞作为适应性免疫系统中很关键的一部分,在病毒感染、癌症以及自身的免疫中有着举足轻重的地位[1]。T细胞介导免疫反应主要由T细胞受体(TCR)首先辨识结合抗原肽的抗原呈递细胞(APC)形成MHC 复合物(pMHC),接着TCR 经过与之非共价结合的CD3 共受体将抗原信号传递到CD3ζ 亚基的胞内免疫受体酪氨酸激活基序(ITAM),之后通过启动下游的T 细胞内级联免疫信号通路等生理过程来杀死病原感染细胞或者肿瘤细胞[2]。TCR‑CD3 复合物主要包括由二硫键共价连接的TCRαβ 联合,包括γ、δ、ε 和ζ 亚基非共价结合的3个CD3信号传导二聚体[3‑4]。TCR‑CD3复合物各亚基在配体的辨识、信号传导等过程中都有着不可取代的重要作用。由于TCRα、TCRβ 并没有胞内信号传递区域序列,因此普遍认为TCRαβ主要通过与CD3 的胞外区、跨膜区的相互作用,将信号传递给CD3 的胞内区完成下游生理过程[5‑6]。
Call 等[7]发现每一个CD3 二聚体与TCR 的组装都需要一个碱性残基和两个酸性残基的作用界面。最近有研究再一次证实了TCR‑CD3 复合物由二硫键相连的αβ 异二聚体与γε、δε'和ζζ'三个非共价连接的CD3信号传递共受体以αβ∶δε'∶γε∶ζζ'=1∶1∶1∶1的占比组成[8](附件图S1)。然而在该结构解析之前,针对TCR‑CD3 复合物的研究多是以其胞外区为主,而且是单独的二聚体、三聚体的研究,甚至脱离了细胞膜环境[2,9‑12]。
大多数为研究蛋白质‑蛋白质相互作用而设计的技术都是针对可溶性蛋白质开发的,对膜蛋白中疏水的跨膜部分结构和功能研究仍缺乏有效的方法。由于计算机科学的飞速发展,分子动力学模拟逐渐成为研究膜蛋白结构和组装的一种重要手段。在2008年就有研究团队通过粗粒化模拟(CGMD)的方法模拟了最具代表性的跨膜蛋白二聚体GPA,其野生型模拟结果与核磁共振(NMR)结构一致[13]。除此以外,分子动力学模拟在糖蛋白Ibβ[14]、PSGL‑1[15]、DAP12‑NKG2C[16]等跨膜蛋白的研究上已经取得重要的进展。
目前针对TCR‑CD3 复合物亚基间相互作用的研究多是单独胞外区[12]的研究,且只涉及到二聚[10]、三聚[9,11]等,并不全面。同时由于实验条件的限制,多数研究都脱离了细胞膜环境,然而已知细胞膜环境对于膜蛋白的信号传递这类生理活动是至关重要的[17]。尽管解析出了TCR‑CD3八聚体复合物较为完整的晶体结构[8],但对于其自组装机制尚未完全清楚。从研究的目的来看,目前的传统实验是很难在原子级别上对生物大分子的行为进行纳秒微秒尺度的实时观测和分析,而分子动力学模拟恰好可以弥补传统实验研究的这一缺点。传统实验和新兴理论模拟技术能够做到相辅相成、互相佐证,从而可以多方面、多角度、深层次地研究生物体内生物大分子结构与功能的性质。由于模拟体系的限制,难以通过模拟来达到分析TCR‑CD3 复合物全长的组装,且跨膜蛋白的跨膜区受到难分离等特点的限制,导致难以通过传统实验技术分析,使得相应的研究较少。因此本文主要利用CGMD对TCR‑CD3 跨膜区进行自组装的模拟,随后通过拉伸动力学模拟(SMD)来分析全长序列亚基间跨膜区、胞外区的结合特点,最后通过分别去除δε'、γε、ζζ'二聚体的跨膜区六聚体的全原子模拟(AAMD),分析各二聚体对其余六聚体的影响。结合以上模拟和分析,探讨TCR‑CD3 复合物的自组装机制。
1 模拟方法
传统的实验技术手段耗时、成本高,且多数得到宏观、静态的结果,难以分析原子级别的细节。相比之下,分子动力学模拟可以研究分析生物体内动态、原子级别的生物过程,这也是与实验手段相比最具有优势的一点。
1.1 粗粒化模拟(CGMD)
在本研究中所有模拟均是在GROMACS‑2018.3[18]平台进行,CGMD 力场选用Martini22 力场[19]。CD3 二聚体的特异性不是由其跨膜区介导而是由胞外区介导[20],因此在模拟过程中,将每一个二聚单体间主链原子约束在其原先距离1 nm范围内,这样就维持了由于胞外区影响的跨膜区二聚整体构象,但又不是将其像位置限制一样将其固定[21]。
在蛋白质结构数据库PDB 中下载TCR‑CD3 复合物的结构文件(PDB ID 6JXR),之后在Pymol下仅保存附件表S1中跨膜区部分。以αβ与δε'的组装为例,为了研究各二聚体相互之间的作用,先将αβ 与δε'放置在距离5 nm 的位置,添加DPPC 双分子层膜之后进行溶剂化,并加入抗衡离子Na+、Cl-使体系保持电中性。通过最陡下降法能量最小化保证体系的原子之间距离不会过近,结构正常,之后进行限制平衡使脂质更好地堆积在蛋白质附近。非键合Lennard‑Jonesxia 相互作用截断值为1.2 nm,使用粒子网格Ewald(PME)方案处理静电。V‑rescale (323.15 K) 和parrinello‑rahman (1.0 bar、4.5×10‑5bar‑1)用于耦合,压力和温度耦合的时间常数分别为5 ps和1 ps,所有模拟均在时间步长为2 fs的周期性边界条件进行。足够的平衡以后,进行最终3 μs的模拟。
1.2 拉伸动力学模拟(SMD)
SMD 最初是由Schulten 小组提出的,建模者从单分子力谱学中获得了这个灵感[22]。与普通MD 不同的是,在对蛋白质大分子体系进行SMD模拟时,会人为地对蛋白质分子中的某个或某几个原子施加一个假想的外力,或者对其位置进行固定[23‑24]。通 过CHARMM‑GUI[25‑26](http://www.charmm‑gui.org/) 网站建立SMD 的体系,选用CHARMM36全原子力场[27],模拟PDB ID 6JXR中所包含的全部序列,即:胞外区、跨膜区及部分胞内区。同样选用DPPC 双分子层膜、TIP3 水模型、添加抗衡离子。由于在GROMACS 中受周期性边界的影响,要对蛋白质进行拉伸,盒子大小必须大于拉伸距离的两倍。经过多次尝试,拉伸距离在小于15 nm左右就能将其完全拉开,因此设置体系大小为30 nm×15 nm×17 nm。同时还需注意的是,蛋白质一开始放置的位置应该保证αβ 跨膜区的质心到被拉伸的二聚体跨膜区质心的矢量方向在x正方向。在完成能量最小化和平衡操作之后(与CGMD相似),需要对TCRαβ进行固定,之后分别拉伸δε'、γε、ζζ'跨膜区的质心,使其沿着x正方向以1 m/s的速度恒速拉伸15 nm。
1.3 全原子模拟(AAMD)
AAMD 虽然计算量巨大,但是能够精细模拟体系间相互作用。 所有的AAMD 均采用CHARMM36力场[27],全原子的体系建立同样通过CHARMM‑GUI 网站来完成。根据CGMD 中TCR‑CD3 复合物跨膜区序列,保留分别去掉δε'、γε、ζζ'二聚的六聚体,调整好正确的取向后,将其提交到CHARMM‑GUI 网 站,设 置x、y 方 向长 度为12 nm,z 方向根据体系大小自动适配,大约在9 nm。膜仍旧采用DPPC双层膜,溶剂采用经典的TIP3三点水模型,抗衡离子为Na+、Cl-。全部步骤完成后下载整个输入输出文件, 之后于GROMACS 平台做能量最小化、平衡,该步骤与CGMD 相似,之后设置最终产品模拟时长为200 ns。
2 结果与讨论
2.1 CGMD 模拟TCR-CD3 复合物跨膜区的自组装
通过CGMD 模拟TCR‑CD3 复合物跨膜区的自组装,首先将αβ与δε'放置在相距5 nm的位置,经过3 μs 的模拟,αβ 与δε'形成四聚体(图1a)。αβ与δε'形成的四聚体,主要表现为两种类型:a.α出现在αβ与δε'作用的界面上(图1b右);b.β出现在αβ 与δε'作用界面上(图1b 左),且在模拟的14 个样本中,出现的比例为1∶1(附件图S2)。已知,δε'的两个酸性残基(天冬氨酸)应该是与α的碱性残基(赖氨酸)相互作用的[7‑8],因此本文对两种结合模式进行了相互作用能的比较。α在作用界面上的模式相互作用力值更低,表示该种结合模式更具优势(图1c)。这一模拟也说明了TCR‑CD3复合物亚基间的特异性作用不是仅由跨膜区介导的,在胞外区可能存在更强的特异性作用,使δε'与α作用而非β。随后分析了αβδε'四聚体的构象(图1d),与晶体结构(PDB ID 6JXR) 中一致。αK258与δD111ε'D137通过侧链接触稳定了αβδε'四聚体,同时还存在α I250XXXI254、ε'V130XXXV134形成V、I 的相互作用,αF252、L255、F262、δI107、L118、ε'T141等残基参与进一步稳定构象的作用(图1e)。

Fig.1 Coarse-grained simulation of the assembly of αβ and δε'(a) Schematic diagram of the system under VMD: the gray ball represents the DPPC phospholipid head, the off‑white stick shape represents the phospholipid tail,the off‑white small balls at both ends of the phospholipid are water molecules,α is represented by a blue spiral,β is represented by an orange spiral,and a purple spiral is represented δ,the yellow spiral represents ε'.(b)The distance between key residues.On the left is a schematic diagram of β at the binding interface;on the right is a schematic diagram of α at the binding interface.(c)The interaction energy of the two tetramer conformations.(d)αβδε'Tetramer conformation.(e)Enter‑spiral contact matrix calculated using a cutoff value of 1nm.
对αβ 与δε'的组装做关键残基的突变模拟发现(图2),对αK258、βK288做单突变,并不影响αβ与δε'的结合;突变αK258,αβδε'就表现为βK288与δD111ε'D137作用;突变βK288,表现为αK258与δD111ε'D137作用,这也再次说明仅靠跨膜区不足以介导TCR‑CD3 复合物亚基间的特异性相互作用。当αK258、βK288均突变后,破坏了αβ 与δε'的相互作用。而同为碱性残基的αR253并不参与亚基间的相互作用,但是从αR253LβK288L的双突变模拟来看,αR253的突变却不利于αK258与δD111ε'D137的作用,这也是在之前的研究中鲜少提到的关于α两个碱性残基间关系的研究。
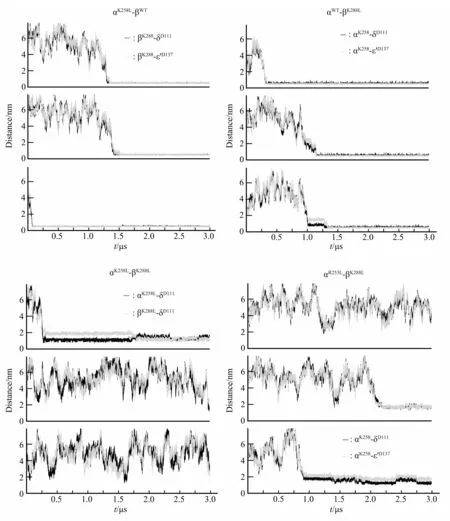
Fig.2 Mutations in key residues of αβ in the assembly of αβδε'Three parallel samples are shown for each mutation experiment.
之后按照同样的方法进行了αβ 与γε、αβδε'与γε的组装(图3a),γε放在组装的第一步不利于其与β的作用。而在δε'存在的前提下,γE122εD137与βK288作用更有效(图3a、c),所形成的六聚体构象与解析的晶体结构一致(图3b)。同时,βI280、L281、I284、Y292、γF118、S125、L129、εV130、V134、T141参与进一步稳定β 与γε 的相互作用(图3c)。
组装为αβδε'γε 六聚体以后,将ζζ'与之前组装好的αβδε'γε 六聚体进行了八聚体的模拟,ζζ'DD36并不能组装到αR253,其出现的位置在六聚体附近,没有规律,甚至是不能与六聚体形成八聚体(附件图S3)。之后将ζζ'分别放在组装的第一步、第二步进行了αβ 与ζζ'、αβδε'与ζζ'的组装,ζζ'DD36均不能像晶体结构中那样结合到αR253(图4)。
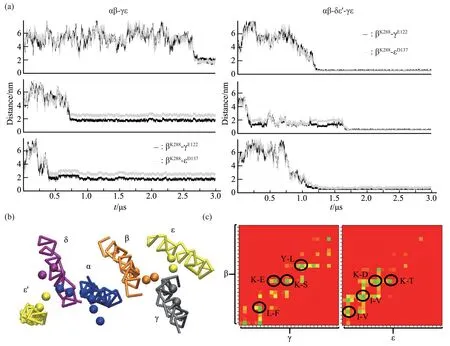
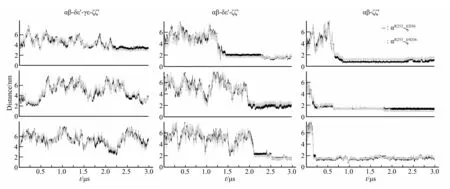
Fig.4 The distance between key residues during ζζ'assemblyThree parallel samples are shown for each experiment.
至此,将仅含跨膜区的TCR‑CD3 复合物组装到αβδε'γε 六聚体,加上关键残基的突变,得到TCR‑CD3 复合物亚基间的特异性作用并非仅由跨膜区来介导,而是在其胞外区可能存在更强的特异性相互作用;同时还发现αR253的突变降低了αK258与δD111ε'D137的作用;然而在跨膜区CGMD中,ζζ'没能和六聚体组装成八聚体。反观TCR‑CD3 复合物八个亚基间的异同,不同于其他六聚体的是,ζζ'的胞外区较短。可能对于ζ来说,其胞外区对于其与其他二聚体的组装来说非常重要。在其他文献中也有各亚基间胞外区的大量相互作用的描述[8,12]。基于此,接下来将对各亚基间胞外区、跨膜区相互作用的差异进行研究。
2.2 SMD研究TCR-CD3复合物胞外区、跨膜区的结合作用力
利用SMD 模拟TCR‑CD3 复合物全长序列(PDB ID 6JXR)各亚基间的结合特点,固定复合物中心的αβ,分别拉开δε'、γε、ζζ'到完全脱离六聚体,通过比较拉开各二聚体跨膜区、胞外区的力的大小,从而分析其结合特点。
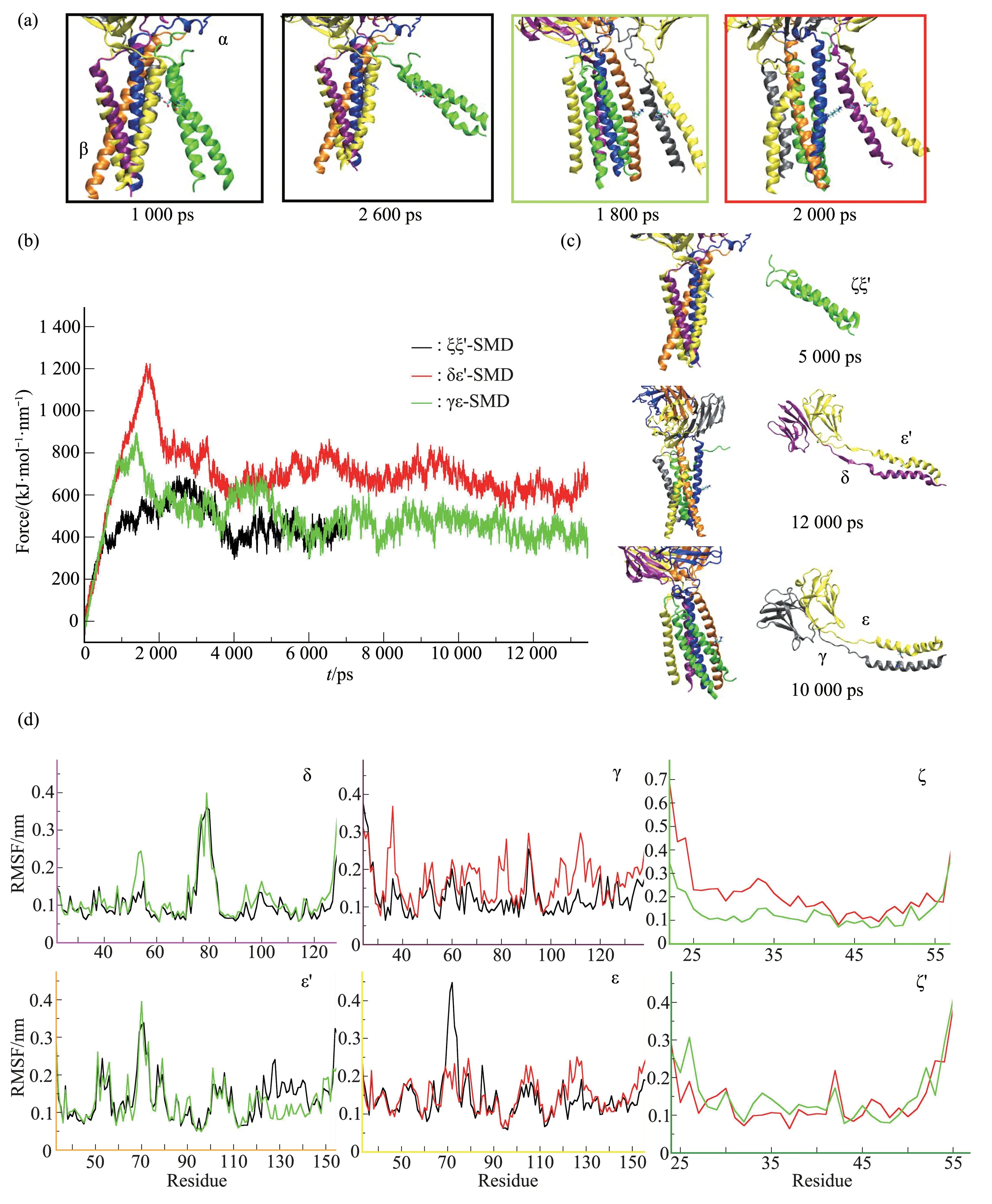
Fig.5 SMD simulations(a, c) Schematic diagram of the steered process, each monomer is represented by cartoon, and different colors represent different monomers. The color representation method is consistent with Figure 3b, and the green represents ζζ'. (b) Pull force as a function of time. (d) RMSF of each monomer.red:δε'‑SMD;black:ζζ'‑SMD;green:γε‑SMD.
如图5 所示,对于ζζ'‑SMD 而言,在1 000 ps时对应的力为拉开其跨膜区的力(ζζ'‑Ftm≈400 KJ/mol/nm),在2 600 ps 时,其胞外区与其余六聚体之间仍有相互作用,在2 800 ps左右对应的力为拉开其胞外区的力(ζζ'‑Fextra≈680 KJ/mol/nm),在5 000 ps之后,ζζ'已完全脱离αβδε'γε六聚体;对于δε'‑SMD 而言,在2 000 ps 左右对应的力为拉开其跨膜区的力(δε'‑Ftm≈1240 KJ/mol/nm),在4 300 ps 附近对应的力为拉开其胞外区的力(δε'‑Fextra≈600 KJ/mol/nm),在6 000 ps 以后,δε'就已完全脱离αβγεζζ'六聚体;对于γε‑SMD 而言,在1 800 ps时对应的力为拉开其跨膜区的力(γε‑Ftm≈900 KJ/mol/nm),在3 500 ps 对应的力为拉开其胞外区的力(γε‑Fextra≈480 KJ/mol/nm),在4 000 ps以后,γε已完全脱离αβδε'ζζ'六聚体。
在SMD 模拟中发现,对于ζζ'而言,Ftm<Fextra;但对于δε'和γε而言,Ftm>Fextra。这说明稳定ζζ'与αβδε'γε 六聚体的主要结构域是ζζ'的胞外区而非跨膜区,这也就进一步解释了本文的跨膜区CGMD中,ζζ'不能结合到α‑R,却能形成αβδε'γε六聚体的现象。
2.3 AAMD分析其中一个二聚体对其余六聚体的影响
根据RMSF结果(图5d)发现,δε'‑SMD对其他二聚体的RMSF影响最大,且对跨膜区的影响差异最大,因此通过AAMD研究TCR‑CD3复合物的跨膜区,分析去除掉其中一个二聚体对其余六聚体的影响。如图6 所示,去除掉δε'的模拟组RMSD变化最大,去除γε 的次之,变化最小的是去除ζζ'的模拟组。这也与SMD结果相符合,即:拉开δε'跨膜区的力是3个CD3二聚体中最大的。RMSD变化越大,表示结构越不稳定,说明ζζ'的缺失,对αβδε'γε 六聚体的构象几乎没有影响,再一次解释了在组装过程中ζζ'结合不上,却不影响αβδε'γε 组装的现象;δε'的缺失对αβγεζζ'的构象影响最大,这就说明δε'对TCR‑CD3复合物跨膜区构象的稳定起着关键作用。
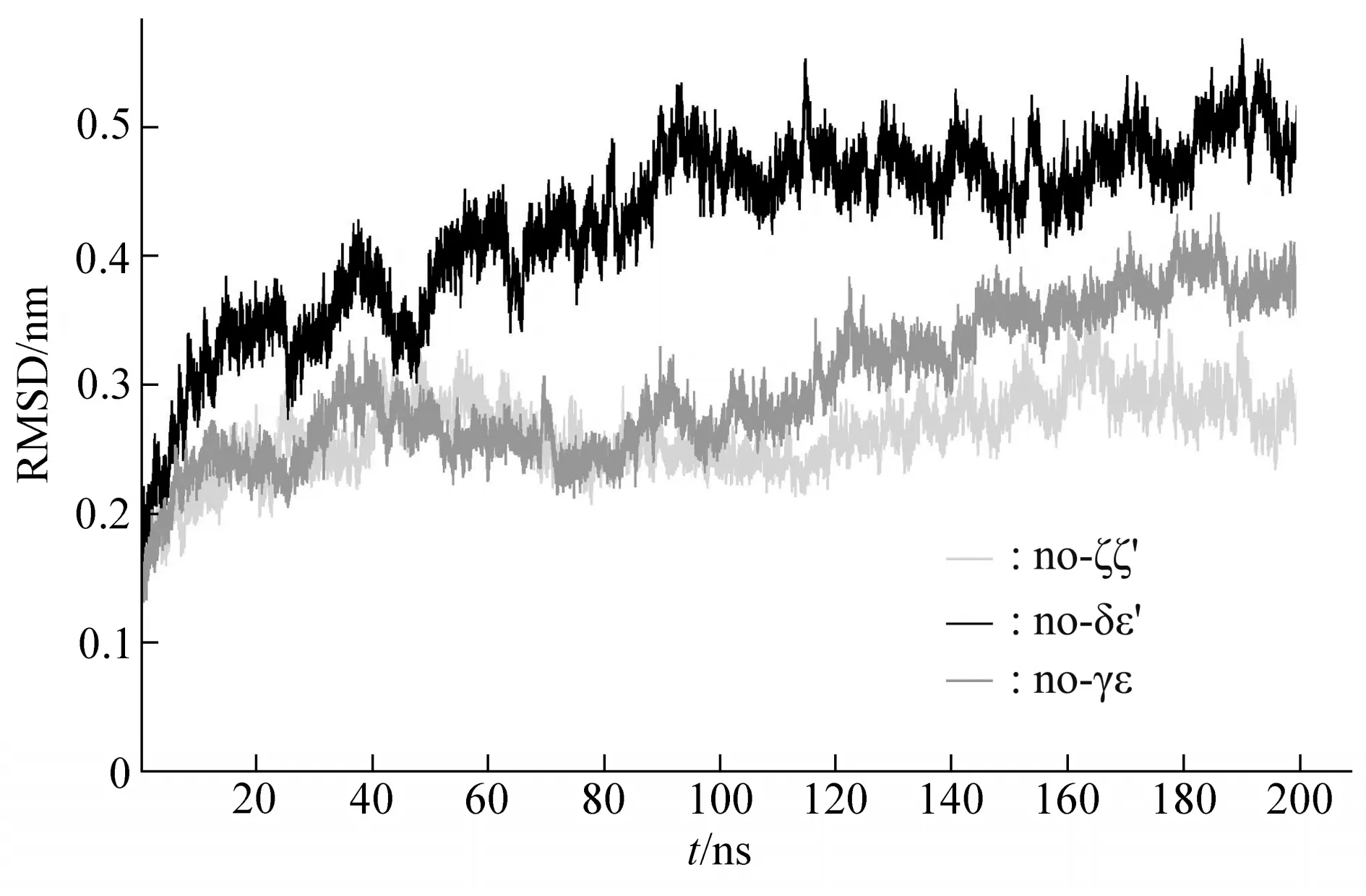
Fig.6 Using all-atom simulation to analyze the RMSD of removing one of the dimers on the remaining hexamers
3 结 论
本文通过CGMD 的方法组装了仅存在跨膜区的TCR‑CD3复合物,αβ与δε'的组装以及相关关键残基的突变,都证明了仅由跨膜区不足以介导TCR‑CD3 复合物亚基间的特异性相互作用,在胞外区可能存在更强的特异性作用,从而使得δε'更倾向于与α 发生相互作用而非β。在组装的过程中还发现,γε 在δε'也存在的前提下与αβ 的结合才更有效,这一点是与实验研究结果[7]相一致的,从侧面说明,γε 的组装发生在δε'之后。ζζ'不管在组装的哪一步,均没有与α产生有效的相互作用,加上AAMD 分析去除ζζ'后对其余亚基形成的六聚体的稳定性影响较小,暗示着ζζ'是发生在δε'、γε 组装之后。本文从分子动力学模拟的角度阐述了TCR‑CD3 复合物组装的顺序:αβ 依此结合δε'、γε、ζζ'。至于在跨膜区CGMD 中,尚未将ζζ'与αβδε'γε 六聚体组装成八聚体的现象,可以通过SMD模拟结果来解释。在SMD模拟中表明,ζζ'与αβδε'γε 六聚体的胞外区相互作用强于其跨膜区作用,而在本文的组装模拟中仅包含了跨膜区。由于模拟体系大小的限制以及跨膜单体序列太长放置膜环境中会发生疏水错配导致倾斜等原因[28],要想模拟全长蛋白质的组装很难,因此只能做到仅含跨膜区的组装模拟。已经有文献[29]表明,不同于其他亚基,ζζ'能独立于αβδε'γε 之外被单独运送,这似乎在暗示ζζ'组装到αβδε'γε 六聚体上形成八聚体的过程可能需要胞外区、甚至是配体的激活等过程的参与。之后通过SMD模拟说明了ζζ'胞外区的重要性,同时辅助说明了TCR‑CD3 复合物的组装顺序。最后通过AAMD表明δε'二聚体是CD3信号体中稳定TCR‑CD3复合物的核心成分。
本文不仅分析了TCR‑CD3 复合物自组装的一些机制,也提出TCR‑CD3 复合物间的特异性相互作用可能由其胞外区主导,TCR‑CD3 复合物胞外区跨膜区共同调控自组装的现象响应了跨膜蛋白在细胞内外传递信号的方式,但详细的机制尚不清楚,可能成为下一步的研究内容。
附件 PIBB_20210134_Doc_S1.pdf 见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net)。

